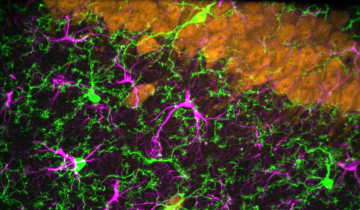
Le cerveau, en plus de contenir des neurones, est constitué de cellules gliales impliquées dans le développement et le fonctionnement du système nerveux, certaines jouant également un rôle immunitaire. Le système immunitaire dans son ensemble interagit avec le système nerveux. De nombreuses études rapportent des associations entre le stress et les troubles anxieux et des anomalies dans les interactions entre neurones et système immunitaire.
Rôle des interactions neuro-immunitaires dans le développement et le fonctionnement du système nerveux
Grandes étapes du développement du cerveau
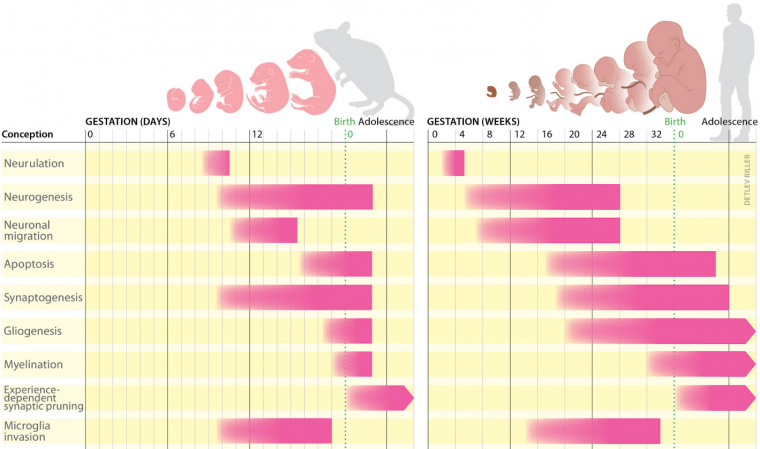
Le développement du cerveau connaît plusieurs phases se succédant tout au long de la vie (périodes embryonnaire, fœtale, post-natale, enfance, adolescence, âge adulte ; Figure 1). Ces séquences développementales impliquent différents types de cellules.
Chez les deux espèces, le développement du cerveau commence par la neurulation, un processus qui aboutit à la formation du tube neural. Celui-ci contient des cellules souches neurales qui permettront la production de neurones, c’est la neurogenèse. Au début du développement humain, à la quatrième semaine de gestation, la partie antérieure du tube neural commence à se subdiviser en régions distinctes. Jusqu’à la 26e semaine environ, certains des neurones précédemment produits migrent vers ces différentes régions cérébrales. Au cours du deuxième trimestre de la grossesse, la synaptogenèse, la gliogenèse et l’apoptose permettent de modeler les connexions cérébrales. En parallèle, les microglies envahissent le cerveau. Au milieu du troisième trimestre, les gaines de myéline se mettent en place autour des neurones. Peu après la naissance, les connexions neuronales précédemment établies sont réduites en fonction de l’activité neuronale.
La première grande étape du développement cellulaire correspond à la neurogénèse où, au cours du développement embryonnaire, des cellules progénitrices vont permettre la formation de neurones qui vont migrer pour former les différentes couches du cortex cérébral et se spécialiser en différents types de neurones excitateurs (glutamatergiques, sensibles au glutamate) et inhibiteurs (GABAergiques, sensibles au GABA). Le maintien d’un équilibre entre neurones excitateurs (80%) et inhibiteurs (20%) est important pour réguler l’activité neuronale et empêcher le développement de pathologies [1]. Plus tard, lors de la gliogenèse, les cellules gliales telles que les astrocytes (régulant les concentrations ioniques, l’apport énergétique, la transmission synaptique et la barrière hématoencéphalique) et oligodendrocytes (myélinisant les axones) se mettent en place. Les neurones maturent et forment ensuite des synapses au cours d’un processus appelé synaptogenèse pendant les périodes fœtales et post-natales. La mise en place des synapses est modulée par l’activité électrique spontanée puis l’activité évoquée (dépendante de stimuli extérieur). La myélinisation, qui augmente la vitesse des transmissions synaptiques, commence chez le fœtus et joue un rôle important jusqu’à l’âge adulte. En parallèle de ces étapes de construction, certaines cellules sont éliminées et un élagage synaptique, dépendant de l’activité des synapses, débute chez le fœtus et se poursuit jusqu’à l’âge adulte.
Le bon déroulement de toutes ces étapes implique des interactions neuro-immunitaires, c’est-à-dire des interactions entre le système nerveux central et les cellules du système immunitaire. Des perturbations de ces interactions neuro-immunitaires sont associées au développement de diverses pathologies.
Rôle des interactions neuro-immunitaires dans le développement du système nerveux
Le cerveau contient plusieurs types de cellules immunitaires (Tableau 1). En conditions physiologiques, elles sont dans un état inactif ou quiescent maintenu par l’activité immunosuppressive des cellules du système nerveux central. Les cellules immunitaires du cerveau sont impliquées dans la protection contre les infections, les blessures ou le développement de tumeurs cérébrales via la présentation ou la reconnaissance d’antigènes ou encore par la détection d’autres stimuli associés à des microbes ou à des signaux de danger. En réponse à ces signaux, certaines de ces cellules peuvent s’activer rapidement et sécréter des molécules pro-inflammatoires recrutant d’autres cellules immunitaires [3,4].
| Cellules |
Rôles pour le système nerveux |
Rôles immunitaires |
|---|---|---|
|
Microglies |
Neurogenèse [4], croissance des axones, synaptogenèse, remodelage et élagage synaptique [10], myélinisation Contrôle du nombre de cellules souches neurales et de la survie des neurones [14] Régulation de l’équilibre entre neurones excitateurs et inhibiteurs Relargage et élimination de neurotransmetteurs (glutamate) [9] Angiogenèse [14] Cognition [14] |
Élimination de cellules mortes et débris par phagocytose [15] Élimination de toxiques [15] Régulation de la perméabilité de la barrière hémato-encéphalique [8] [11] |
|
Macrophages associés aux bordures (BAM, Border Associated Macrophages) |
Favorisent la production d’IL-4 par les lymphocytes T Élimination de débris cellulaire et toxiques [15] |
Présentation d’antigènes et activation des lymphocytes T Surveillance immunitaire |
|
Cellules dendritiques |
Favorisent la production d’IL-4 par les lymphocytes T |
Présentation d’antigènes et activation des lymphocytes T Surveillance immunitaire |
|
Lymphocytes T |
Production d’IL-4 augmentant la production de facteurs neurotrophiques Plasticité synaptique Maturation développementale des microglies Cognition, mémoire, réponse au stress [14] |
Lutte contre les pathogènes |
|
Astrocytes |
Régulation des concentrations ioniques, de l’apport énergétique, de la transmission synaptique et de la barrière hématoencéphalique Production de facteurs neurotrophiques en réponse à l’IL-4 produit par les lymphocytes T Synaptogenèse et élagage synaptique [16] |
Régulation de l’entrée de cellules immunitaires dans le cerveau [16] Régulation des réponses innées et adaptatives locales [16] Expression de récepteurs détectant des pathogènes [17] |
|
Oligodendrocytes (et leurs précurseurs OPC) |
Myélinisation des axones [14] |
|
|
Vaisseaux lymphatiques méningés |
Transport de cellules immunitaires, fonctions cognitives, mémoire, apprentissage [14] [15] |
Élimination des déchets [14] [15] |
Les microglies sont des cellules qui entrent très tôt dans le cerveau, vers quatre à cinq semaines de gestation chez l’Homme, et interagissent rapidement avec celui-ci. Les microglies sont localisées dans le parenchyme cérébral derrière la barrière hémato-encéphalique et sont ainsi directement au contact des neurones et d’autres cellules gliales. De ce fait, ces cellules de type macrophage peuvent avoir des effets directs sur les neurones ainsi que sur les autres cellules gliales. Cela les distingue d’autres cellules immunitaires du cerveau qui jouent un rôle moins direct dans les interactions neuro-immunitaires via la sécrétion de facteurs solubles (cytokines par exemple). Les microglies représentent 5 à 15% des cellules du cerveau humain chez l’adulte et proviennent de progéniteurs du sac vitellin.
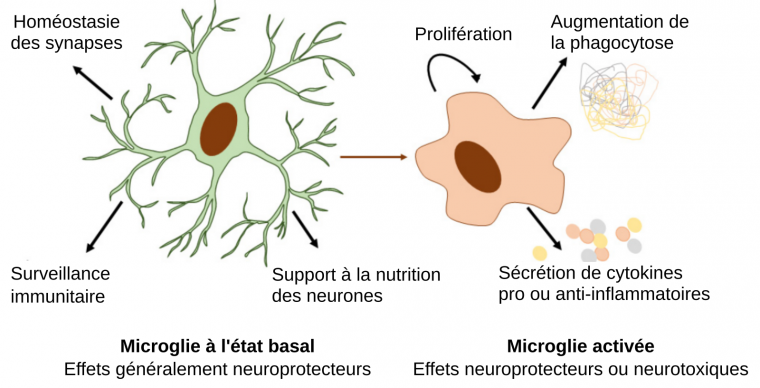
Les microglies sont impliquées dans des processus neuronaux et immunologiques importants à de nombreuses étapes du développement cérébral et dans la protection contre des infections et blessures [8]. En effet, elles participent activement à la neurogenèse [4], la régulation de l’équilibre entre neurones excitateurs et inhibiteurs, le relargage et l’élimination de neurotransmetteurs dont le glutamate [9], l’élimination de cellules mortes et de débris par phagocytose, la synaptogenèse et la croissance des axones, la myélinisation, le remodelage et l’élagage synaptique [10], la régulation de la perméabilité de la barrière hémato-encéphalique [8,11]…
En situation physiologique, les microglies jouent un rôle de soutien aux neurones et de surveillance des pathogènes et des débris cellulaires. Lorsqu’elles sont activées, les gènes exprimés par les microglies changent, ce qui aboutit à une augmentation de leur capacité à réaliser la phagocytose et à sécréter des cytokines pro ou anti-inflammatoires. Elles peuvent ainsi éliminer les pathogènes et les débris cellulaires. Dans certaines maladies neurodégénératives, l’activation des microglies contribue à une inflammation prolongée qui occasionne des effets neurotoxiques.
Les microglies se distinguent des macrophages non cérébraux essentiellement produits par hématopoïèse à l’âge adulte chez l’Homme. Des macrophages cérébraux issus du sac vitellin, dont une partie est remplacée à l’âge adulte par des cellules issues de la moelle osseuse, colonisent également les méninges, le plexus choroïde1 et les tissus nerveux environnants [5]. Comme elles occupent des territoires situés à l’extérieur du parenchyme cérébral, ces cellules sont appelées macrophages associés aux bordures (ou BAM, pour Border Associated Macrophages).
Enfin, d’autres cellules immunitaires telles que des cellules dendritiques, des lymphocytes B et T, des monocytes, des polynucléaires neutrophiles, des cellules NK sont présentes dans les méninges, le plexus choroïde et le liquide cérébrospinal. Les macrophages associés aux bordures et les cellules dendritiques sont capables de présenter des antigènes aux lymphocytes T environnants. Ces derniers peuvent alors sécréter des molécules telles que l’IL4 qui peuvent affecter la production de facteurs neurotrophiques (protéines impliquées dans la croissance et de la survie des neurones en développement et matures). Les lymphocytes T du liquide cérébrospinal ont des caractéristiques différentes de ceux du sang et jouent des rôles importants dans la lutte contre les pathogènes chez la souris et l’Homme [6,7].
Les cellules neurales et immunitaires, quelle que soit leur localisation dans l’organisme, expriment des molécules et récepteurs communs leur permettant de communiquer : récepteurs à neurotransmetteurs sur les cellules immunitaires, récepteurs à chimiokines sur les neurones ; ces derniers étant également capables de produire des chimiokines. Des protéines du système immunitaire sont même essentielles au développement cérébral et à la plasticité synaptique [13].
Perturbations neuro-immunitaires dans le stress et les troubles anxieux
Définition du stress et des troubles anxieux en biologie et en psychologie
Le stress, selon sa définition biologique, correspond à une perturbation locale ou systémique d’un système qui était dans un état d’équilibre (homéostasie). Cette perturbation est due à des facteurs et stimuli stressants qui engendrent une réponse au stress et induisent des effets liés à celui-ci [18].
Les troubles anxieux se distinguent du stress. En effet, ce dernier est plus occasionnel et peut être lié à un examen ou une échéance particulière tandis que les troubles anxieux ne sont pas temporaires, peuvent s’aggraver avec le temps en l’absence de suivi thérapeutique ou de traitement et affectent la vie quotidienne des personnes concernées (efficacité au travail ou dans les études, vie sociale), pouvant aller jusqu’à des comportements d’évitement ayant des répercussions sur leur vie quotidienne (évitement des transports en commun augmentant les temps de trajet…). Les troubles anxieux peuvent être évalués avec des tests auto-déclaratifs qui sont plus ou moins généraux ou bien centrés sur un type de trouble anxieux en particulier. Ces tests prennent en compte différents paramètres et symptômes notamment psychologiques et physiques : difficulté à contrôler son stress, stress chronique, crampes à l’estomac, perte de concentration, problèmes de sommeil, fatigue, impacts sur la vie courante et sociale, anticipation et mise en place de stratégies d’évitement…. Un diagnostic de troubles anxieux ne peut être posé qu’après avoir éliminé certaines pathologies somatiques et psychologiques qui pourraient provoquer des symptômes similaires à ceux associés à l’anxiété [19,20].
Les troubles anxieux constituent les troubles psychiatriques les plus fréquents, puisqu'ils touchent une personne sur treize dans le monde [22]. Les personnes atteintes cumulent souvent plusieurs types de troubles anxieux (48 à 68% de comorbidité) ou présentent également des symptômes dépressifs (50 à 60% de comorbidité), notamment lorsque les symptômes associés au trouble anxieux sont forts et s’installent dans la durée [19,23]. Elles sont également plus touchées par des comorbidités psychologiques et somatiques, particulièrement celles affectant le système immunitaire. Lorsqu’elles sont présentes, ces comorbidités sont souvent associées à des symptômes plus importants et à une prise en charge plus complexe (en cas de comorbidité dépressive, un traitement différent ou plus lourd peut être nécessaire, tandis qu'en cas d'addiction, les benzodiazépines sont à éviter en raison du risque d'addiction associé) [23]. Les troubles anxieux apparaissent généralement au cours de l’adolescence et toucheraient plus les femmes2 [24]. Des facteurs biologiques (dont génétiques), psychologiques et sociaux seraient associés à des risques plus importants de développer ces troubles [25].
Perturbations biologiques associées aux stress et troubles anxieux
De nombreuses différences dans des marqueurs génétiques et biologiques ont été découvertes chez les personnes atteintes de troubles anxieux comparativement à des sujets sains. En effet, des changements neurophysiologiques, endocriniens (augmentation de la concentration en cortisol mesurée dans la salive) et moléculaires (neurotransmetteurs, molécules agissant sur le système nerveux et immunitaire) ont été constatés [26].
Des modifications cérébrales structurelles ainsi que dans l’activité neuronale ont également été observées par IRM fonctionnelle. Plus précisément, des modifications de volume (augmentation ou diminution) et/ou de l’activité neuronale (augmentation ou réduction) de certaines régions cérébrales ont été observées chez des patients atteints d’un trouble anxieux généralisé. Ces perturbations toucheraient particulièrement l’amygdale et les cortex préfrontal et cingulaire qui sont impliqués dans les comportements liés aux peurs, à la reconnaissance des expressions émotionnelles et à la régulation des processus sociaux [28].
Que ces modifications des paramètres biologiques soient des causes (suffisantes ou non) ou des conséquences des troubles anxieux, leur restauration à l’état initial semble, dans de nombreux cas, cliniquement bénéfique. Ce constat souligne l’importance de la prise en compte de facteurs et marqueurs biologiques dans le traitement des troubles psychiatriques tels que les troubles anxieux [26].
Perturbations neuro-immunitaires associées aux stress et troubles anxieux
Il existe plusieurs modèles expérimentaux pour étudier le stress et les troubles anxieux. Chez les rongeurs, l’anxiété peut être induite par l’exposition à des stimuli aversifs (odeur d’un prédateur ou stimuli douloureux par exemple). Elle peut également être obtenue en soumettant les animaux à une hypothermie, à une nage forcée, à un déficit social (par isolement), à des stimulations cérébrales (électriques ou chimiques), ou encore par l’induction de perturbations biologiques (élimination des microglies, traitements, inactivation de gènes par exemple). L’anxiété des animaux peut alors être évaluée par des tests ne nécessitant pas d’apprentissage (par exemple le labyrinthe en croix surélevé3) ou par conditionnement (évaluation de la réaction de l’animal à un bruit préalablement associé à un stimulus douloureux par exemple). Des modèles où l’on induit des perturbations du système immunitaire (par induction d’une inflammation ou d’une immunosuppression, par déplétion des microglies normales) peuvent également permettre d’en étudier les conséquences sur le développement neuronal et le risque de développement de troubles anxieux associés [29].
Chez l’Homme, l’anxiété basale (sans facteur de stress particulier) et l’anxiété induite (avec des stimuli aversifs, par exemple légèrement douloureux) peuvent être évaluées par des questionnaires et/ou des mesures physiologiques et biologiques (niveau de conductance de la peau et sursaut, ce dernier variant similairement chez les rongeurs) [29-31].
Si des facteurs cellulaires et moléculaires pro-inflammatoires et l’inflammation permettent une activation du système immunitaire nécessaire pour lutter contre une infection ou un cancer, ou pour favoriser la réparation de lésions (y compris dans le cerveau) [32], une activation trop forte et/ou prolongée peut entrainer de nombreux dommages (tissulaires et cellulaires) [33] et perturbations (maladie auto-immune [34-36], allergies [36], maladies cardiovasculaires dont athérosclérose [37], fonctionnement cérébral altéré avec risque de dépression ou bipolarité [38] notamment). Les facteurs anti-inflammatoires permettent de limiter cette inflammation, notamment après une activation importante du système immunitaire. Cependant, en cas de déficit en facteurs pro-inflammatoires ou d’excès de facteurs anti-inflammatoires, le risque de développement et de persistance d’infections et de cancers [32] augmente. Ainsi, un équilibre entre facteurs pro et anti-inflammatoires est nécessaire [33].
L’inflammation systémique favorise la neuro-inflammation, c'est-à-dire une réponse inflammatoire localisée dans le système nerveux central, normalement immunoprivilégié. En effet, la barrière hémato-encéphalique permet de limiter les interactions entre les cellules et molécules immunitaires du sang et le système nerveux central [17]. La neuro-inflammation peut être bénéfique dans certaines conditions, par exemple pour lutter contre des pathogènes ou réparer des lésions dans le cerveau. Cependant, selon les contextes, son intensité et sa durée, la neuro-inflammation peut augmenter les risques de développer des pathologies telles que des troubles anxieux, dépressifs et dégénératifs [39,40]. Par exemple, le stress chronique est associé à une activation des microglies et au recrutement de monocytes et macrophages inflammatoires au niveau du cerveau favorisant le développement de troubles anxieux et dépressifs. L’inhibition du recrutement de monocytes inflammatoires dans le cerveau limiterait l’apparition de ces troubles anxieux [39].
De nombreuses études suggèrent que des perturbations immunitaires contribueraient au développement de pathologies neuropsychiatriques. Une réponse immunitaire persistante a d’ailleurs été détectée dans le sérum de souris et d’Hommes ayant des troubles anxieux et/ou de la dépression [25]. En effet, une augmentation de molécules pro-inflammatoires (IL-6, TNFα, IL-1β, IFNα, CRP) et une diminution de molécules anti-inflammatoires (IL-4) dans le sang et le liquide cérébrospinal ont également été observées chez des patients atteints de troubles anxieux [27]. De plus, il existe des comorbidités importantes avec des pathologies associées à une inflammation augmentée (diabète, troubles digestifs, maladies auto-immunes…), une incidence plus importante d’infections et une réponse aux vaccins plus faible, plus tardive, moins stable dans le temps et avec plus d’effets secondaires, soulignant un fonctionnement non adéquat du système immunitaire [42]. Chez les sujets atteints de troubles anxieux, des études post-mortem montrent également une activation immunitaire et microgliale plus importante (associé à un phénotype de microglies activées et la production augmentée de molécules pro-inflammatoires) [43].
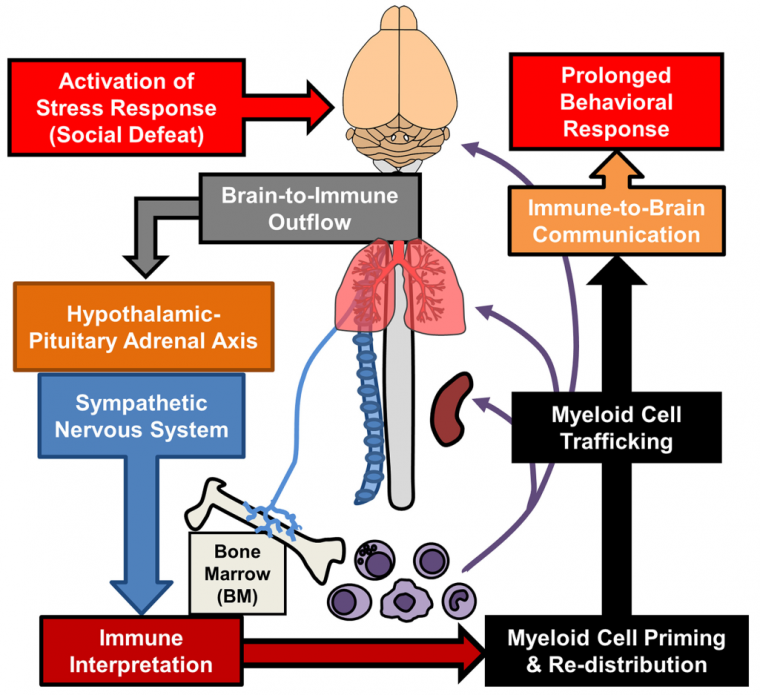
Une inflammation forte et prolongée entraîne une suractivation du système sympathique, ce qui libère des molécules pro-inflammatoires et des neurotoxines dans le cerveau (oxyde d’azote, espèces réactives de l’oxygène…) [44]. Cela maintient le système sympathique dans un état suractivé et engendre des dommages tissulaires et une perte d’activité neuronale fonctionnelle (par élagage neuronal trop important du fait de l’activation des microglies) pouvant être à l’origine du développement et de la persistance dans le temps de pathologies telles que les troubles anxieux et la dépression [26,45,46]. Plusieurs cellules, molécules et processus impliqués dans l’inflammation pourraient ainsi être associés au développement de troubles anxieux [46].
La réponse au stress passe par une activation de l’axe hypothalamo-hypophyso-surrénalien (ou axe corticotrope) qui influence le fonctionnement des cellules myéloïdes. En retour, ces cellules communiquent avec le cerveau et sont impliqués dans les comportements anxieux et dépressifs.
L’élimination des cellules microgliales normales lors du développement embryonnaire ou de la période post-natale augmente les comportements anxieux chez les souris et rats juvéniles et adultes, ce qui n’est pas le cas avec une déplétion à l’âge adulte. [48] Cela suggère l’existence de périodes critiques où des modifications neuro-immunitaires données (déficit en cellules microgliales normales par exemple) auraient des conséquences plus importantes sur l’apparition et le développement de troubles anxieux.
En effet, en post-natal, l’induction de troubles anxieux chez les rats [49] et souris [50] (par neuro-inflammation [49] ou stress répétés [50], chroniques ou aigus) provoque une augmentation du nombre de microglies et de leur activation dans certaines zones du cerveau (amygdale, cortex préfrontal, hippocampe) [49-51]. Cette prolifération microgliale serait suivie peu après d’une mort de certaines de ces microglies et donc d'une diminution de leur nombre dans certaines régions cérébrales [51]. La déplétion génétique ou pharmacologique ainsi que l’inhibition de l’activité des microglies par de la minocycline (un anti-inflammatoire) ou des antidépresseurs par exemple réduirait les comportements de type anxieux chez les souris [47,50,52].
Ces données sont cohérentes avec des études post-mortem chez l’Homme qui montrent une activation immunitaire et microgliale importante chez des patients ayant souffert de troubles anxieux [43]. De plus, des marqueurs spécifiques des microglies visualisées en tomographie par émission de positons montrent une corrélation positive entre l’activation des microglies dans l’hippocampe et le cortex préfrontal et les symptômes anxieux chez l’Homme [52]. Le nombre et l’activation de microglies joueraient un rôle majeur dans les troubles anxieux, particulièrement lors des périodes critiques du développement du système nerveux central, plus sensibles à des perturbations.
En post-natal, les effets néfastes des microglies favorisant des troubles anxieux ou dépressifs seraient dus à des cytokines, à la production de composés toxiques (espèces réactives de l’oxygène) et à leur activité de phagocytose augmentée. La production de composés toxiques tels que les espèces réactives de l’oxygène aurait des conséquences sur le comportement. La phagocytose d’éléments neuronaux telles que des terminaisons axonales [51] ou de lipides composants la myéline, essentielle pour une bonne conduction de l’influx nerveux [48], pourrait induire des dommages et une dégénération neuronale [53] et ainsi participer aux perturbations comportementales liées au stress [51,[53].
D’autres cellules immunitaires pourraient également être impliquées dans les troubles anxieux. Par exemple, un déficit en mastocytes dans le cerveau de souris serait également associé à une augmentation de comportements de type anxieux à l’âge adulte [54]. Chez les souris et l’Homme, la production de certaines molécules immunitaires par les lymphocytes T des méninges ou des perturbations de leur métabolisme dans le sang [55] seraient associées à des niveaux d’anxiété significativement supérieurs [56]. Ainsi, d’autres cellules immunitaires du cerveau et en périphérie comme les mastocytes et lymphocytes joueraient un rôle dans les troubles anxieux.
De par leurs capacités à détecter des molécules de signalisation communes telles que des chimiokines, cytokines, interleukines impliquées dans l’inflammation et l’immunomodulation ou encore des neurotransmetteurs, les neurones, microglies et macrophages (du cerveau ou non) ainsi que d’autres cellules du cerveau et des cellules du système immunitaire peuvent interagir et communiquer ensemble, notamment à distance [13]. Il a d’ailleurs été constaté qu’une inflammation périphérique augmenterait l’activation des microglies chez les souris et chez l’Homme [57].
Chez la souris comme chez l’Homme, des stimulations du système immunitaire sont associées à une augmentation du risque de développer des troubles anxieux, tandis qu’une inhibition de celui-ci diminue les symptômes. En effet, des essais cliniques contre l’hépatite C ont montré que l’administration de molécules pro-inflammatoires (IFNα) induit fréquemment des symptômes anxieux et dépressifs avec une augmentation de l’inflammation dans le sang et le liquide cérébrospinal [59]. De plus, l’administration d’anti-inflammatoires non stéroïdiens tels que l’aspirine pendant la première année suivant le diagnostic d’un cancer est associée à une diminution des risques de développer des troubles anxieux et dépressifs [60]. Similairement, l’administration d’anti-inflammatoires chez l’Homme diminue les symptômes liés à ces troubles [61]. Chez les souris, des liens de causalité ont même été montrés. En effet, le blocage de l’action de l’IL-4 (molécule anti-inflammatoire) avec un inhibiteur spécifique de son récepteur exprimé par les neurones et les macrophages (dont les microglies) empêche l’effet anxiolytique de traitements tels que l’imipramine (antidépresseur), suggérant que l’effet anxiolytique de tels traitements serait lié à leur capacité à restaurer une homéostasie immunitaire (par réduction d’une inflammation trop forte). Chez les jeunes adolescentes et les femmes enceintes, il existe une corrélation entre un taux faible d’IL-4 et la présence de symptômes anxieux importants. Cependant, aucun essai clinique avec de l’IL-4 ne semble avoir été mené chez l’Homme [27]. Le système immunitaire dans son ensemble (éléments cellulaires et moléculaires du cerveau et en périphérie) contribue donc aux troubles anxieux chez la souris et chez l’Homme.
Des facteurs de stress psychosociaux auraient également un impact négatif sur les interactions neuro-immunitaires en suractivant le système neuro-immunitaire. En effet, cela induirait une production de molécules pro-inflammatoires et de molécules du stress oxydatif (telles que les espèces réactives de l’oxygène) entrainant des altérations cellulaires et une perte d’activité neuronale fonctionnelle du fait d’un élagage synaptique trop important [45]. Similairement, des facteurs de stress psychologiques et une privation chronique de sommeil augmenteraient la concentration plasmatique de molécules pro-inflammatoires qui sont connues pour augmenter les risques de développement de troubles anxieux et dépressifs [41].
Pendant la grossesse, chez les souris et l’Homme, une activation du système immunitaire suite à une infection ou du fait d’une maladie auto-immune favorise l’activation des microglies et l’inflammation, ainsi que le développement de troubles anxieux chez les descendants. Des données épidémiologiques et expérimentales suggèrent que ce risque est d’autant plus important si cette activation a lieu lors de périodes critiques et s’il y a ensuite une exposition à des évènements stressants en post-natal (hypothèse de plusieurs « hits ») [62]. Par ailleurs, chez des femmes enceintes atteintes de troubles anxieux et/ou dépressifs, des modifications de la concentration de certains ARNm (augmentation en ARNm codant des protéines pro-inflammatoires tels que l’IL-6) dans le placenta et des modifications épigénétiques dans le sang du cordon ombilical ont été constatées, ce qui pourrait contribuer à augmenter les risques de développement de troubles similaires dans leur descendance. Le suivi médical des femmes enceintes (somatique et psychologique) semble donc particulièrement important pour limiter le développement de troubles anxieux chez leurs descendants [63-65].
Le système immunitaire est donc modulé par de nombreux facteurs biologiques et psychosociaux en pré et post natal. Il est notamment sensible au développement d’infections et aux modifications du microbiote. En effet, les cellules du cerveau peuvent détecter et répondre à des signaux systémiques dont ceux provenant de cellules immunitaires suite à une infection ou selon la composition du microbiote [62].
Ainsi, il existe des interactions bidirectionnelles entre les composantes immunitaires et nerveuses du système neuro-immunitaire ainsi qu’entre le système neuro-immunitaire et des facteurs psychosociaux liés à l’anxiété. Des hypothèses dites de plusieurs hits suggèrent d’ailleurs que le développement de troubles anxieux serait un processus dépendant d’une succession de plusieurs évènements faisant intervenir des facteurs biologiques, psychologiques et sociaux à des périodes critiques et dont les effets pourraient s’additionner [62].
Les traitements contre les troubles anxieux et leurs effets sur les perturbations neuro-immunitaires
Traitements pharmacologiques et biologiques
Les antidépresseurs font partie des traitements de fond pouvant être envisagés dans le traitement des troubles anxieux chroniques, surtout lorsqu’ils sont associés à des symptômes dépressifs. Leur utilisation peut être associée à de nombreux effets secondaires. En cela, elle nécessite un suivi de marqueurs biologiques et un arrêt progressif. Il a été montré que les antidépresseurs induisaient une diminution de l’inflammation chez l’Homme (diminution d’IL-1β and IL-6 notamment) associée à une diminution des troubles anxieux [19,67,68].
Il existe peu d’études sur le système immunitaire et les anxiolytiques [71-74], le meilleur traitement à long terme contre l’anxiété étant la combinaison d’antidépresseurs et de psychothérapies. En effet, les anxiolytiques sont seulement indiqués en cas de crises anxieuses. De plus, ils sont souvent associés à des risques addictifs importants. On peut cependant noter que certains antihistaminiques dont la première indication est de limiter les réactions allergiques sont également prescrits dans le traitement de crises anxieuses suite à la découverte de leurs effets anxiolytiques [19]. Quelques études suggèrent un effet des anxiolytiques sur le système immunitaire mais les conclusions ne semblent pas toujours concordantes [71-74]. L’administration de benzodiazépines augmentant le surrisque infectieux, il est possible d’imaginer un effet au moins en partie immunosuppresseur de ces anxiolytiques [72,73], ce qui pourrait contribuer aux effets thérapeutiques contre l’anxiété. L’exposition prénatale à des benzodiazépines est également associée à des modifications comportementales et neuro-immunitaires [74].
La stimulation transcrânienne est une thérapie non invasive utilisée dans le traitement de diverses pathologies psychiatriques. Elle consiste à stimuler ou inhiber certaines zones et certains neurones spécifiques du cerveau grâce à un champ électromagnétique [75]. Elle est efficace contre l’anxiété chez l’Homme, notamment pour des patients résistants aux antidépresseurs, et est associée à peu d’effets secondaires du fait de son action plus locale. La stimulation transcrânienne est prescrite dans le traitement de la dépression en première ou seconde intention depuis plusieurs années dans certains pays (États-Unis, Canada, Brésil, Australie, Israël) et remboursé dans d’autres [76]. Elle est cependant contre-indiquée pour certains patients (à risque épileptique, avec hypertension intracrânienne, implants ou éléments métalliques au niveau du crâne). En France, elle est actuellement peu pratiquée (presque essentiellement en milieu hospitalier) et non remboursée en libéral, ce qui la rend peu accessible. Il a été montré chez la souris mâle adolescente que cette thérapie diminue significativement les symptômes anxieux et l’activation des microglies [75]. De plus, elle augmente significativement la production d’une molécule anti-inflammatoire (IL-10) et modifie le phénotype des microglies de l’hippocampe et du cortex préfrontal chez les souris vers un phénotype moins inflammatoire [75,77]. En clinique, des baisses de concentration plasmatique de molécules pro-inflammatoires ont été observées lors de ce traitement [78,79]. La stimulation transcrânienne dans le traitement de l’anxiété cible le cortex préfrontal dorsolatéral où l’on retrouve souvent des microglies présentant des altérations morphologiques chez des patients atteints de troubles anxieux [46].
Des changements de régime alimentaire ainsi que d’autres traitements pharmacologiques et biologiques agissant sur le microbiote (probiotiques, transplantation fécale, antibiotiques tels que la minocycline) ou d’autres traitements qui auraient des effets sur le système immunitaire (aspirine par exemple) sont associés à des réductions de l’anxiété dans certains contextes [41,44]. Ces résultats suggèrent que la recherche de traitements ciblant directement le système immunitaire pourrait être pertinente. Il a d’ailleurs été montré que chez des personnes atteintes de maladies auto-immunes, de pathologies immunitaires ou de troubles dépressifs, des molécules anti-inflammatoires auraient des effets antidépresseurs [80,81].
Traitements psychothérapeutiques
Les thérapies cognitivo-comportementales sont des psychothérapies utilisées dans le traitement des troubles anxieux et de la dépression. Leur efficacité est comparable à celles des antidépresseurs, mais elles présentent l’avantage d’induire moins d’effets secondaires [19]. Il s’agit de thérapies fondées sur l’exposition répétée aux sources d’anxiété, en commençant par des situations exposant à un stress faible (partie comportementale). Par exemple, pour des personnes anxieuses à l’idée de prendre les transports en commun, il est possible de commencer par prendre des transports où il y a peu d’affluence, sur une courte durée, près du conducteur, puis, petit à petit, sur des distances plus grandes et dans des transports plus souvent sujets à des perturbations (trafic interrompu, forte affluence). Avant et après les expositions, un travail est également effectué sur les croyances et pensées négatives associées à l’anxiété (partie cognitive). Ces thérapies nécessitent du temps et de l’investissement des patients en dehors des séances et ne sont pas toujours accessibles financièrement. Quelques études suggèrent que des patients traités avec ces thérapies présentent une diminution des taux de molécules pro-inflammatoires dans le sang et que cela est associé à des améliorations cliniques dans le cas de la dépression [67,82]. Des interventions psychothérapeutiques de réduction du stress, telles que les thérapies cognitivo-comportementales, sont également associées à une meilleure cicatrisation (qui nécessite un système immunitaire efficace et bien régulé) suite à un challenge in vivo (induction d’une blessure chez des patients et suivi de la cicatrisation) chez l’Homme, suggérant une amélioration des fonctions immunitaires avec ces thérapies [83].
Peu d’études se sont intéressées aux liens entre hypnose (ou méditation) et anxiété et système immunitaire. Une étude suggère que ces thérapies réduisent la production d’une molécule pro-inflammatoire et sont associées à des améliorations des symptômes cliniques [84]. L’hypnose et la méditation seraient également efficaces contre l’anxiété et réduiraient l’inflammation chez des patients atteints de maladies intestinales inflammatoires, souvent sujets à des troubles anxieux [85,86].
Plusieurs études montrent que la combinaison de traitements pharmacologiques et psychothérapeutiques (par exemple antidépresseurs et thérapies cognitivo-comportementales ou antidépresseurs et anti-inflammatoires) est associée à une amélioration clinique plus importante qu’avec un traitement seul. Cela pourrait être lié à des effets synergiques sur le système neuro-immunitaire, d’autant plus qu’il a été montré qu’une inflammation très forte est associée à une moins bonne réponse aux antidépresseurs seuls chez l’Homme [61,87].
Ainsi, il semble qu’une réduction de l’inflammation favorise des améliorations cliniques de symptômes anxio-dépressifs. Une régulation de l’activité des microglies pour éviter le développement d’un phénotype pro-inflammatoire pourrait ainsi avoir un intérêt. Une inhibition trop forte de l’activité des microglies ne semblerait cependant pas souhaitable car ces cellules ont des rôles multiples majeurs notamment d’immunorégulation et que leur absence à certains stades du développement augmente les troubles anxieux (effet qu’elles pourraient potentiellement avoir plus tardivement également) [48].
Toutes ces recherches soulèvent l’importance d’étudier et de mieux comprendre les interactions neuro-immunitaires et leurs implications dans le développement de troubles psychologiques et psychiatriques tels que les troubles anxieux. Cela pourrait notamment permettre de mieux prévenir ces troubles (via une surveillance des infections pendant la grossesse), d’envisager de nouveaux traitements (ciblant ou modulant le système immunitaire, en particulier les microglies [47]), d’améliorer les traitements actuels et de mieux anticiper de potentielles résistances à certaines thérapies.
Les interactions neuro-immunitaires sont également associées à d’autres pathologies psychiatriques ainsi qu’à des maladies neurodégénératives et neurodéveloppementales montrant le rôle majeur du système immunitaire sur le cerveau.
À l’avenir, la prise en compte de nombreux paramètres biologiques supplémentaires (systèmes du corps, endocrinien par exemple, et signaux systémiques) dans l’étude des troubles neurologiques et psychiatriques semble ainsi importante. En effet, l’étude de l’interaction de ces facteurs entre eux et avec des facteurs psychologiques et sociaux (pris en compte par le modèle bio-psycho-social) pourraient participer à une meilleure compréhension et à une prise en charge plus efficace des troubles psychologiques et psychiatriques [44].
Bibliographie
[1] M. Selten, H. van Bokhoven, et N. Nadif Kasri, « Inhibitory control of the excitatory/inhibitory balance in psychiatric disorders », F1000Research, vol. 7, p. 23, janv. 2018, doi: 10.12688/f1000research.12155.1.
[2] M. C. Deruelle, M. F. Wallois, M. B. Rossion, M. N. George, M. J. Dubois, et M. G. Dehaene-Lambertz, « Anatomo-functional correlates of visual and auditory development: insights on the ontogeny of face and speech processing lateralization ».
[3] S. S. Ousman et P. Kubes, « Immune surveillance in the central nervous system », Nat. Neurosci., vol. 15, no 8, p. 1096‑1101, août 2012, doi: 10.1038/nn.3161.
[4] A. Silvin et F. Ginhoux, « Microglia heterogeneity along a spatio-temporal axis: More questions than answers », Glia, vol. 66, no 10, p. 2045‑2057, oct. 2018, doi: 10.1002/glia.23458.
[5] M. S. Thion, F. Ginhoux, et S. Garel, « Microglia and early brain development: An intimate journey », Science, vol. 362, no 6411, p. 185‑189, oct. 2018, doi: 10.1126/science.aat0474.
[6] T. Croese, G. Castellani, et M. Schwartz, « Immune cell compartmentalization for brain surveillance and protection », Nat. Immunol., vol. 22, no 9, p. 1083‑1092, sept. 2021, doi: 10.1038/s41590-021-00994-2.
[7] J. L. Pappalardo et al., « Transcriptomic and clonal characterization of T cells in the human central nervous system », Sci. Immunol., sept. 2020, doi: 10.1126/sciimmunol.abb8786.
[8] K. Haruwaka et al., « Dual microglia effects on blood brain barrier permeability induced by systemic inflammation », Nat. Commun., vol. 10, no 1, p. 5816, déc. 2019, doi: 10.1038/s41467-019-13812-z.
[9] C. M. Henstridge, M. Tzioras, et R. C. Paolicelli, « Glial Contribution to Excitatory and Inhibitory Synapse Loss in Neurodegeneration », Front. Cell. Neurosci., vol. 13, p. 63, févr. 2019, doi: 10.3389/fncel.2019.00063.
[10] D. P. Schafer et B. Stevens, « Microglia Function in Central Nervous System Development and Plasticity », Cold Spring Harb. Perspect. Biol., vol. 7, no 10, p. a020545, oct. 2015, doi: 10.1101/cshperspect.a020545.
[11] « https://www.psychiatrictimes.com/view/microglial-involvement-psychiatric-diseases ».
[12] L. Bruno, S. Karagil, A. Mahmood, A. Elbediwy, M. Stolinski, et F. E. Mackenzie, « Mechanosensing and the Hippo Pathway in Microglia: A Potential Link to Alzheimer’s Disease Pathogenesis? », Cells, vol. 10, no 11, p. 3144, nov. 2021, doi: 10.3390/cells10113144.
[13] L. M. Boulanger, « Immune Proteins in Brain Development and Synaptic Plasticity », Neuron, vol. 64, no 1, p. 93‑109, oct. 2009, doi: 10.1016/j.neuron.2009.09.001.
[14] K. Morimoto et K. Nakajima, « Role of the Immune System in the Development of the Central Nervous System », Front. Neurosci., vol. 13, p. 916, sept. 2019, doi: 10.3389/fnins.2019.00916.
[15] S. Da Mesquita et al., « Functional aspects of meningeal lymphatics in ageing and Alzheimer’s disease », Nature, vol. 560, no 7717, p. 185‑191, août 2018, doi: 10.1038/s41586-018-0368-8.
[16] L. Tian, L. Ma, T. Kaarela, et Z. Li, « Neuroimmune crosstalk in the central nervous system and its significance for neurological diseases », J. Neuroinflammation, vol. 9, no 1, p. 594, déc. 2012, doi: 10.1186/1742-2094-9-155.
[17] E. Moyse et al., « Neuroinflammation: A Possible Link Between Chronic Vascular Disorders and Neurodegenerative Diseases », Front. Aging Neurosci., vol. 14, p. 827263, mai 2022, doi: 10.3389/fnagi.2022.827263.
[18] S. Lu, F. Wei, et G. Li, « The evolution of the concept of stress and the framework of the stress system », Cell Stress, vol. 5, no 6, p. 76‑85, juin 2021, doi: 10.15698/cst2021.06.250.
[19] J.-M. Manus, « DSM-5 - Manuel diagnostique et statistique des troubles mentaux », Rev. Francoph. Lab., vol. 2019, no 513, p. 14, juin 2019, doi: 10.1016/S1773-035X(19)30277-1.
[20] « https://www.healthline.com/health/anxiety-diagnosis#outlook ».
[21] « https://www.nimh.nih.gov/health/topics/anxiety-disorders ».
[22] A. Sharma et W. J. M. I. Verbeke, « Understanding importance of clinical biomarkers for diagnosis of anxiety disorders using machine learning models », PLOS ONE, vol. 16, no 5, p. e0251365, mai 2021, doi: 10.1371/journal.pone.0251365.
[23] « Anxiety disorders - The Lancet ». https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(21)00359-7/fulltext (consulté le 22 mai 2022).
[24] C. P. McLean, A. Asnaani, B. T. Litz, et S. G. Hofmann, « Gender differences in anxiety disorders: Prevalence, course of illness, comorbidity and burden of illness », J. Psychiatr. Res., vol. 45, no 8, p. 1027‑1035, août 2011, doi: 10.1016/j.jpsychires.2011.03.006.
[25] F. Thibaut, « Anxiety disorders: a review of current literature », Dialogues Clin. Neurosci., vol. 19, no 2, p. 87‑88, juin 2017, doi: 10.31887/DCNS.2017.19.2/fthibaut.
[26] B. Bandelow et al., « Biological markers for anxiety disorders, OCD and PTSD: A consensus statement. Part II: Neurochemistry, neurophysiology and neurocognition », World J. Biol. Psychiatry, vol. 18, no 3, p. 162‑214, avr. 2017, doi: 10.1080/15622975.2016.1190867.
[27] B. Li, T. Gao, et J. Du, « Neuroimmune Imbalance: The Key for the Treatment of Anxiety? », J. Immunol. Sci., vol. 3, no 3, p. 14‑16, juin 2019, doi: 10.29245/2578-3009/2019/3.1175.
[28] D. Madonna, G. Delvecchio, J. C. Soares, et P. Brambilla, « Structural and functional neuroimaging studies in generalized anxiety disorder: a systematic review », Braz. J. Psychiatry, vol. 41, no 4, p. 336‑362, août 2019, doi: 10.1590/1516-4446-2018-0108.
[29] « https://www.scielo.br/j/rbp/a/TSyQ9BS8chRgNDK88xmJ4Jp/?lang=en ».
[30] D. Neueder, M. Andreatta, et P. Pauli, « Contextual Fear Conditioning and Fear Generalization in Individuals With Panic Attacks », Front. Behav. Neurosci., vol. 13, 2019, Consulté le: 25 mai 2022. [En ligne]. Disponible sur: https://www.frontiersin.org/article/10.3389/fnbeh.2019.00152
[31] K. R. Lezak, G. Missig, et W. A. Carlezon Jr, « Behavioral methods to study anxiety in rodents », Dialogues Clin. Neurosci., vol. 19, no 2, p. 181‑191, juin 2017, Consulté le: 25 mai 2022. [En ligne]. Disponible sur: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5573562/
[32] K. J. Hiam-Galvez, B. M. Allen, et M. H. Spitzer, « Systemic immunity in cancer », Nat. Rev. Cancer, vol. 21, no 6, p. 345‑359, juin 2021, doi: 10.1038/s41568-021-00347-z.
[33] J. M. Cicchese et al., « Dynamic balance of pro‐ and anti‐inflammatory signals controls disease and limits pathology », Immunol. Rev., vol. 285, no 1, p. 147‑167, sept. 2018, doi: 10.1111/imr.12671.
[34] « Autoimmune Diseases », in Primer to the Immune Response, Elsevier, 2014, p. 517‑552. doi: 10.1016/B978-0-12-385245-8.00019-4.
[35] A. Markovics, K. S. Rosenthal, K. Mikecz, R. E. Carambula, J. C. Ciemielewski, et D. H. Zimmerman, « Restoring the Balance between Pro-Inflammatory and Anti-Inflammatory Cytokines in the Treatment of Rheumatoid Arthritis: New Insights from Animal Models », Biomedicines, vol. 10, no 1, p. 44, déc. 2021, doi: 10.3390/biomedicines10010044.
[36] J.-F. Bach, « The Effect of Infections on Susceptibility to Autoimmune and Allergic Diseases », N. Engl. J. Med., vol. 347, no 12, p. 911‑920, sept. 2002, doi: 10.1056/NEJMra020100.
[37] A. Christ, S. Bekkering, E. Latz, et N. P. Riksen, « Long-term activation of the innate immune system in atherosclerosis », Semin. Immunol., vol. 28, no 4, p. 384‑393, août 2016, doi: 10.1016/j.smim.2016.04.004.
[38] Y.-K. Kim, H.-G. Jung, A.-M. Myint, H. Kim, et S.-H. Park, « Imbalance between pro-inflammatory and anti-inflammatory cytokines in bipolar disorder », J. Affect. Disord., vol. 104, no 1‑3, p. 91‑95, déc. 2007, doi: 10.1016/j.jad.2007.02.018.
[39] D. J. DiSabato, N. Quan, et J. P. Godbout, « Neuroinflammation: the devil is in the details », J. Neurochem., vol. 139, p. 136‑153, oct. 2016, doi: 10.1111/jnc.13607.
[40] G. Singhal et B. T. Baune, « Inflammatory Abnormalities in Major Depressive Disorder », in Major Depressive Disorder, Elsevier, 2020, p. 75‑89. doi: 10.1016/B978-0-323-58131-8.00006-9.
[41] C. Smith et al., « Anxiolytic effects of NLRP3 inflammasome inhibition in a model of chronic sleep deprivation », Transl. Psychiatry, vol. 11, no 1, p. 52, juin 2021, doi: 10.1038/s41398-020-01189-3.
[42] A. A. Madison, M. R. Shrout, M. E. Renna, et J. K. Kiecolt-Glaser, « Psychological and Behavioral Predictors of Vaccine Efficacy: Considerations for », p. 13.
[43] G. N. Pandey, H. S. Rizavi, R. Bhaumik, et X. Ren, « Innate immunity in the postmortem brain of depressed and suicide subjects: Role of Toll-like receptors », Brain. Behav. Immun., vol. 75, p. 101‑111, janv. 2019, doi: 10.1016/j.bbi.2018.09.024.
[44] S. Sugama et Y. Kakinuma, « Stress and brain immunity: Microglial homeostasis through hypothalamus-pituitary-adrenal gland axis and sympathetic nervous system », Brain Behav. Immun. - Health, vol. 7, p. 100111, août 2020, doi: 10.1016/j.bbih.2020.100111.
[45] D. J. Stein, M. F. Vasconcelos, L. Albrechet-Souza, K. M. M. Ceresér, et R. M. M. de Almeida, « Microglial Over-Activation by Social Defeat Stress Contributes to Anxiety- and Depressive-Like Behaviors », Front. Behav. Neurosci., vol. 11, p. 207, oct. 2017, doi: 10.3389/fnbeh.2017.00207.
[46] E. S. Wohleb, D. B. McKim, J. F. Sheridan, et J. P. Godbout, « Monocyte trafficking to the brain with stress and inflammation: a novel axis of immune-to-brain communication that influences mood and behavior », Front. Neurosci., vol. 8, janv. 2015, doi: 10.3389/fnins.2014.00447.
[47] L. Zhang, J. Zhang, et Z. You, « Switching of the Microglial Activation Phenotype Is a Possible Treatment for Depression Disorder », Front. Cell. Neurosci., vol. 12, p. 306, oct. 2018, doi: 10.3389/fncel.2018.00306.
[48] B. T. Casali et E. G. Reed-Geaghan, « Microglial Function and Regulation during Development, Homeostasis and Alzheimer’s Disease », Cells, vol. 10, no 4, p. 957, avr. 2021, doi: 10.3390/cells10040957.
[49] A. León-Rodríguez, M. del M. Fernández-Arjona, J. M. Grondona, C. Pedraza, et M. D. López-Ávalos, « Anxiety-like behavior and microglial activation in the amygdala after acute neuroinflammation induced by microbial neuraminidase », Sci. Rep., vol. 12, no 1, p. 11581, juill. 2022, doi: 10.1038/s41598-022-15617-5.
[50] S. Li et al., « Microglial deletion and inhibition alleviate behavior of post-traumatic stress disorder in mice », J. Neuroinflammation, vol. 18, no 1, p. 7, déc. 2021, doi: 10.1186/s12974-020-02069-9.
[51] E. Schramm et A. Waisman, « Microglia as Central Protagonists in the Chronic Stress Response », Neurol. - Neuroimmunol. Neuroinflammation, vol. 9, no 6, p. e200023, nov. 2022, doi: 10.1212/NXI.0000000000200023.
[52] S. Rooney et al., « Neuroinflammatory alterations in trait anxiety: modulatory effects of minocycline », Transl. Psychiatry, vol. 10, no 1, Art. no 1, juill. 2020, doi: 10.1038/s41398-020-00942-y.
[53] L. R. Frick, K. Williams, et C. Pittenger, « Microglial Dysregulation in Psychiatric Disease », Clin. Dev. Immunol., vol. 2013, p. 1‑10, 2013, doi: 10.1155/2013/608654.
[54] K. M. Lenz et L. H. Nelson, « Microglia and Beyond: Innate Immune Cells As Regulators of Brain Development and Behavioral Function », Front. Immunol., vol. 9, p. 698, avr. 2018, doi: 10.3389/fimmu.2018.00698.
[55] K. Alves de Lima et al., « Meningeal γδ T cells regulate anxiety-like behavior via IL-17a signaling in neurons », Nat. Immunol., vol. 21, no 11, Art. no 11, nov. 2020, doi: 10.1038/s41590-020-0776-4.
[56] K. Fan et al., « Stress-Induced Metabolic Disorder in Peripheral CD4+ T Cells Leads to Anxiety-like Behavior », Cell, vol. 179, no 4, p. 864-879.e19, oct. 2019, doi: 10.1016/j.cell.2019.10.001.
[57] I. C. M. Hoogland, C. Houbolt, D. J. van Westerloo, W. A. van Gool, et D. van de Beek, « Systemic inflammation and microglial activation: systematic review of animal experiments », J. Neuroinflammation, vol. 12, no 1, p. 114, déc. 2015, doi: 10.1186/s12974-015-0332-6.
[58] F. Zipp, C. Thalman, D. Sams, N. Vlassenko, J. Kipnis, et C. F. Vogelaar, « IL-4 Receptor Signaling is Relevant for Brain Homeostasis (P1.2-091) », Neurology, vol. 92, no 15 Supplement, avr. 2019, Consulté le: 25 mai 2022. [En ligne]. Disponible sur: https://n.neurology.org/content/92/15_Supplement/P1.2-091
[59] MRC ImmunoPsychiatry Consortium et al., « Effects of immunomodulatory drugs on depressive symptoms: A mega-analysis of randomized, placebo-controlled clinical trials in inflammatory disorders », Mol. Psychiatry, vol. 25, no 6, p. 1275‑1285, juin 2020, doi: 10.1038/s41380-019-0471-8.
[60] K. Hu et al., « Aspirin and other non-steroidal anti-inflammatory drugs and depression, anxiety, and stress-related disorders following a cancer diagnosis: a nationwide register-based cohort study », BMC Med., vol. 18, no 1, p. 238, déc. 2020, doi: 10.1186/s12916-020-01709-4.
[61] S. Bai et al., « Efficacy and safety of anti-inflammatory agents for the treatment of major depressive disorder: a systematic review and meta-analysis of randomised controlled trials », J. Neurol. Neurosurg. Psychiatry, vol. 91, no 1, p. 21‑32, janv. 2020, doi: 10.1136/jnnp-2019-320912.
[62] V. X. Han, S. Patel, H. F. Jones, et R. C. Dale, « Maternal immune activation and neuroinflammation in human neurodevelopmental disorders », Nat. Rev. Neurol., vol. 17, no 9, p. 564‑579, sept. 2021, doi: 10.1038/s41582-021-00530-8.
[63] L. Cao-Lei, F. Veru, G. Elgbeili, M. Szyf, D. P. Laplante, et S. King, « DNA methylation mediates the effect of exposure to prenatal maternal stress on cytokine production in children at age 13½ years: Project Ice Storm », Clin. Epigenetics, vol. 8, no 1, p. 54, déc. 2016, doi: 10.1186/s13148-016-0219-0.
[64] A. A. Lussier, T. S. Bodnar, et J. Weinberg, « Intersection of Epigenetic and Immune Alterations: Implications for Fetal Alcohol Spectrum Disorder and Mental Health », Front. Neurosci., vol. 15, p. 788630, déc. 2021, doi: 10.3389/fnins.2021.788630.
[65] C. A. Martinez, I. Marteinsdottir, A. Josefsson, G. Sydsjö, E. Theodorsson, et H. Rodriguez-Martinez, « Prenatal stress, anxiety and depression alter transcripts, proteins and pathways associated with immune responses at the maternal-fetal interface », Biol. Reprod., vol. 106, no 3, p. 449‑462, mars 2022, doi: 10.1093/biolre/ioab232.
[66] C. Catale, S. Gironda, L. Lo Iacono, et V. Carola, « Microglial Function in the Effects of Early-Life Stress on Brain and Behavioral Development », J. Clin. Med., vol. 9, no 2, p. 468, févr. 2020, doi: 10.3390/jcm9020468.
[67] A. L. Lopresti, « Cognitive behaviour therapy and inflammation: A systematic review of its relationship and the potential implications for the treatment of depression », p. 18.
[68] R. Hou et D. S. Baldwin, « A neuroimmunological perspective on anxiety disorders », Hum. Psychopharmacol. Clin. Exp., vol. 27, no 1, p. 6‑14, 2012, doi: 10.1002/hup.1259.
[69] « https://www.medicalnewstoday.com/articles/303618#Depression-and-the-immune-response ».
[70] J. Savitz et al., « Reduction of kynurenic acid to quinolinic acid ratio in both the depressed and remitted phases of major depressive disorder », Brain. Behav. Immun., vol. 46, p. 55‑59, mai 2015, doi: 10.1016/j.bbi.2015.02.007.
[71] P. K. Arora, E. E. Hanna, S. M. Paul, et P. Skolnick, « Suppression of the immune response by benzodiazepine receptor inverse agonists », J. Neuroimmunol., vol. 15, no 1, p. 1‑9, mai 1987, doi: 10.1016/0165-5728(87)90002-6.
[72] E. Obiora, R. Hubbard, R. D. Sanders, et P. R. Myles, « The impact of benzodiazepines on occurrence of pneumonia and mortality from pneumonia: a nested case-control and survival analysis in a population-based cohort », Thorax, vol. 68, no 2, p. 163‑170, févr. 2013, doi: 10.1136/thoraxjnl-2012-202374.
[73] E. Skicki, M. Morgan, C. Brown, E. Bradburn, et F. Rogers, « Benzodiazepines increase the likelihood of both infectious and thrombotic complications », J. Trauma Acute Care Surg., vol. 91, no 1, p. 206‑211, juill. 2021, doi: 10.1097/TA.0000000000003134.
[74] M. Schlumpf et al., « Nervous and Immune Systems asTargets for DevelopmentalEffects of Benzodiazepines », Dev. Pharmacol. Ther., vol. 18, no 3‑4, p. 145‑158, 1992, doi: 10.1159/000480614.
[75] L. Yang et al., « Deep rTMS Mitigates Behavioral and Neuropathologic Anomalies in Cuprizone-Exposed Mice Through Reducing Microglial Proinflammatory Cytokines », Front. Integr. Neurosci., vol. 14, p. 556839, nov. 2020, doi: 10.3389/fnint.2020.556839.
[76] A.-K. Brem et S. M. Lehto, « Stuck between Bench and Bedside: Why Non-invasive Brain Stimulation Is Not Accessible to Depressed Patients in Europe », Front. Hum. Neurosci., vol. 11, févr. 2017, doi: 10.3389/fnhum.2017.00039.
[77] « Repetitive transcranial magnetic stimulation exerts anti-inflammatory effects via modulating glial activation in mice with chronic unpredictable mild stress-induced depression - ScienceDirect ». https://www.sciencedirect.com/science/article/pii/S1567576922002727?via%3Dihub (consulté le 25 mai 2022).
[78] A. J. Perrin et C. M. Pariante, « Endocrine and immune effects of non-convulsive neurostimulation in depression: A systematic review », Brain. Behav. Immun., vol. 87, p. 910‑920, juill. 2020, doi: 10.1016/j.bbi.2020.02.016.
[79] F. Leblhuber et al., « Repetitive transcranial magnetic stimulation in the treatment of resistant depression: changes of specific neurotransmitter precursor amino acids », J. Neural Transm., vol. 128, no 8, p. 1225‑1231, août 2021, doi: 10.1007/s00702-021-02363-7.
[80] C. Phillips et A. Fahimi, « Immune and Neuroprotective Effects of Physical Activity on the Brain in Depression », Front. Neurosci., vol. 12, 2018, Consulté le: 25 mai 2022. [En ligne]. Disponible sur: https://www.frontiersin.org/article/10.3389/fnins.2018.00498
[81] E. M. Medina-Rodriguez, J. A. Lowell, R. J. Worthen, S. A. Syed, et E. Beurel, « Involvement of Innate and Adaptive Immune Systems Alterations in the Pathophysiology and Treatment of Depression », Front. Neurosci., vol. 12, 2018, Consulté le: 25 mai 2022. [En ligne]. Disponible sur: https://www.frontiersin.org/article/10.3389/fnins.2018.00547
[82] « Role of IL-8, CRP and epidermal growth factor in depression and anxiety patients treated with mindfulness-based therapy or cognitive behavioral therapy in primary health care - ScienceDirect ». https://www.sciencedirect.com/science/article/abs/pii/S0165178117302172?via%3Dihub (consulté le 25 mai 2022).
[83] L. Schakel et al., « Effectiveness of Stress-Reducing Interventions on the Response to Challenges to the Immune System: A Meta-Analytic Review », Psychother. Psychosom., vol. 88, no 5, p. 274‑286, 2019, doi: 10.1159/000501645.
[84] M. Schoen et K. Nowack, « Reconditioning the stress response with hypnosis CD reduces the inflammatory cytokine IL-6 and influences resilience: A pilot study », Complement. Ther. Clin. Pract., vol. 19, no 2, p. 83‑88, mai 2013, doi: 10.1016/j.ctcp.2012.12.004.
[85] R. Shaoul, I. Sukhotnik, et J. Mogilner, « Hypnosis as an Adjuvant Treatment for Children With Inflammatory Bowel Disease », J. Dev. Behav. Pediatr., vol. 30, no 3, p. 268, juin 2009, doi: 10.1097/DBP.0b013e3181a7eeb0.
[86] G. Moser, « The role of hypnotherapy for the treatment of inflammatory bowel diseases », Expert Rev. Gastroenterol. Hepatol., vol. 8, no 6, p. 601‑606, août 2014, doi: 10.1586/17474124.2014.917955.
[87] P. Cuijpers, H. Noma, E. Karyotaki, C. H. Vinkers, A. Cipriani, et T. A. Furukawa, « A network meta‐analysis of the effects of psychotherapies, pharmacotherapies and their combination in the treatment of adult depression », World Psychiatry, vol. 19, no 1, p. 92‑107, févr. 2020, doi: 10.1002/wps.20701.