L’assemblée Nobel a décerné son prix de physiologie ou médecine 2025 à deux chercheurs américains, Mary Brunkow et Fred Ramsdell, ainsi qu’à un chercheur japonais, Shimon Sakaguchi, « pour leurs découvertes à propos de la tolérance immunitaire périphérique », en particulier concernant le rôle des lymphocytes T régulateurs (Trég).
Les lymphocytes T sont capables de reconnaître une grande diversité d’antigènes exposés par des cellules présentatrices grâce à la formidable diversité de leurs TCR (T-cell receptors, récepteurs des cellules T). Si cette diversité permet de reconnaître potentiellement n’importe quelle molécule du non soi, et ainsi de détruire les cellules infectées ou tumorales, elle s’accompagne aussi du risque d’une reconnaissance des molécules du soi et donc d’une réaction auto-immune, au cours de laquelle l’organisme détruit ses propres cellules, alors même qu’elles ne sont ni infectées, ni cancéreuses. Des mécanismes de tolérance centrale et de tolérance périphérique permettent d’éviter les réactions auto-immunes.
La tolérance centrale correspond à la destruction des lymphocytes T reconnaissant des antigènes du soi, avant qu’ils ne puissent devenir effecteurs. Cette sélection se déroule dans le thymus, où les cellules thymiques exposent à leur surface une grande variété d’antigènes du soi. Les lymphocytes T reconnaissant ces antigènes entrent en apoptose. Cette sélection négative n’est cependant pas parfaite et des lymphocytes T potentiellement autoréactifs peuvent quitter le thymus. C’est alors qu’entrent en jeu les mécanismes de tolérance périphérique, dont certains ont été mis au jour par Shimon Sakaguchi, Mary Brunkow et Fred Ramsdell, récompensés cette année par le prix Nobel de physiologie ou médecine.
Durant les années 90, Shimon Sakaguchi et ses collaborateurs mènent des recherches sur des souris mutantes nude, qui n’ont pas de thymus et donc pas de lymphocytes T endogènes. Quand ces souris reçoivent des lymphocytes T CD4+ dépourvus de la molécule de surface CD25 (lymphocytes CD4+CD25−) provenant de souris normales, elles développent des manifestations auto-immunes. Par contre, si l’on injecte également des cellules T CD4+CD25+, alors les souris ne présentent pas de réactions auto-immunes 1. Sakaguchi identifie ainsi une sous-population de lymphocytes T CD4+, les lymphocytes T CD4+CD25+, capables de freiner l’activité du système immunitaire et qui sont donc appelés lymphocytes T régulateurs (Trég).
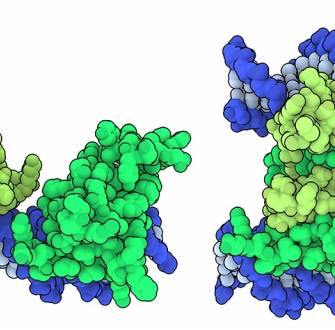
Toujours dans les années 90, deux chercheurs américains, Mary Brunkow et Fred Ramsdell, s’intéressent quant à eux à l’origine du phénotype des souris scurfy. Chez ces souris, les mâles ont une peau squameuse, des ganglions lymphatiques et une rate hypertrophiés, et meurent quelques semaines après la naissance. Seule la moitié des mâles descendant de souris femelles portant la mutation sont touchés. Les chercheurs en déduisent que la mutation à l’origine du phénotype scurfy est portée par le chromosome X. Des années de clonage et de séquençage seront nécessaires pour localiser et identifier le gène porteur de la mutation, le gène Foxp3 (Forkhead box P3) 2. Ce gène code un facteur de transcription impliqué dans l’expression de gènes spécifiques des lymphocytes T régulateurs. Des mutations de ce gène sont responsables, chez l’être humain du syndrome IPEX3, caractérisé notamment par un dérèglement du système immunitaire 4.
Au final, les lymphocytes T régulateurs se caractérisent donc par l’expression, au niveau nucléaire, du facteur de transcription Foxp3 et, en surface, des molécules CD4 et CD25. D’autres études permettront de mieux comprendre le fonctionnement des lymphocytes T régulateurs, qui exercent leur fonction immunosuppressive par plusieurs mécanismes complémentaires 5 :
- en sécrétant des cytokines anti-inflammatoires (telles que IL-10, IL-35 et TGFβ) ;
- en séquestrant l’interleukine 2, un facteur de croissance indispensable à la prolifération des lymphocytes T. Cette séquestration se réalise grâce à une expression accrue de leur molécule CD25, qui est un récepteur de haute affinité pour l’interleukine 2 ;
- en modulant la maturation ou le fonctionnement des cellules dendritiques, qui sont des cellules présentatrices d’antigènes ;
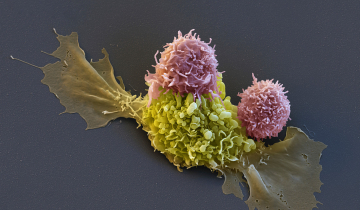
- également, de manière minoritaire, en détruisant les lymphocytes effecteurs par cytolyse, par l’intermédiaire des granzymes A ou B et de la perforine.
La compréhension des mécanismes d’activation et d’action des lymphocytes T régulateurs présente un intérêt médical. En effet, accentuer l’action des lymphocytes T régulateurs pourrait s’avérer utile pour traiter les maladies auto-immunes, les allergies ou encore pour éviter les rejets de greffe. À l’inverse, inhiber le fonctionnement des lymphocytes T régulateurs aurait des applications dans les cas de cancers où les cellules tumorales attirent ces lymphocytes qui les protègent alors de l’action des cellules effectrices. Des essais cliniques fondés sur l’injection de lymphocytes T régulateurs ex vivo sont aujourd’hui en cours, concrétisant les découvertes récompensées par le prix Nobel 2025.