Les hormones stéroïdes contrôlent de nombreuses transitions dans le cycle de vie des animaux à symétrie bilatérale. Jusqu’à présent, l’évolution de la signalisation par les hormones stéroïdes chez les vertébrés a été étudiée surtout du point de vue de leurs récepteurs. L’utilisation, en supplément, de méthodes issues de l’anatomie comparée, a permis d’ordonner certaines des étapes-clés dans la synthèse des hormones, de dresser le portrait-robot d’un stéroïde ancestral, et de tester expérimentalement sa capacité à se fixer sur un récepteur ancestral.
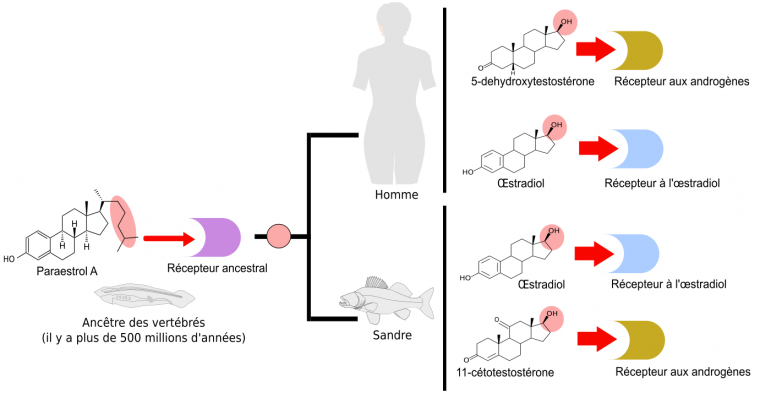
Le développement de la plupart des animaux est modulé par des hormones stéroïdes qui contrôlent précisément certaines transitions durant le cycle de vie. Par exemple chez les mammifères, dont l’Homme, la maturation sexuelle est contrôlée par des œstrogènes (comme le 17β-œstradiol) ou des androgènes (comme le 5-déhydrotestostérone) alors que pour les téléostéens (poissons osseux à nageoire caudale symétrique), il s’agit de la 11-cétotestostérone (voir Figure 2). Concernant les insectes, les accumulations de réserves nutritives dans les œufs et durant la mue sont deux phénomènes contrôlés par l’ecdysone. Enfin, chez les nématodes, des stéroïdes appelés acides dafachroniques permettent d’enclencher un développement rapide, tandis que leur absence, lorsque la nourriture est insuffisante, provoque l’entrée en diapause (vie ralentie). Toutes ces hormones stéroïdes possèdent deux points communs importants. Premièrement, elles sont toutes synthétisées à partir du cholestérol. De plus, leur action implique une fixation sur des récepteurs nucléaires, qui sont des facteurs de transcription activant ou réprimant l’expression de gènes différents en fonction de la présence ou de l’absence de ces hormones.
Dès les années 90, les points communs entre les mécanismes de signalisation chez les différents animaux ont suscité l’intérêt des biologistes de l’évolution, qui ont d’abord cherché à clarifier les relations de parenté entre ces récepteurs nucléaires aux hormones stéroïdes (Escriva et al. 1997). Ils ont ainsi montré que ces récepteurs constituent une famille multigénique qui comprend d’autres récepteurs hormonaux (aux hormones thyroïdiennes, aux acides rétinoïques et aux prostaglandines), mais aussi des membres qui, soit ne fixent aucune molécule connue, soit fixent de multiples molécules avec une faible spécificité (Laudet et Stéhelin, 1993). Au sein de cette famille, les récepteurs aux hormones stéroïdes de vertébrés étant particulièrement bien étudiés, ils ont fait l’objet d’études d’évolution expérimentale dans lesquelles les séquences de récepteurs ancestraux ont été inférées sur la base des séquences décrites. L’équipe de Joseph Thornton, notamment, de l’université de l’Oregon (puis université de Chicago) a produit de nombreuses contributions dans ce domaine, qui ont permis une description très fine de la succession des mutations accumulées par les récepteurs et de leurs effets sur la structure tertiaire des protéines et leur capacité à fixer les hormones (voir Science et Vie numéros 1069 et 1108).
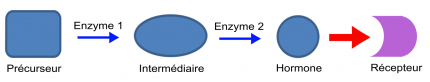
Jusqu’à présent, ces travaux d’évolution expérimentale ont testé comment des récepteurs anciens répondaient à des hormones modernes. Implicitement, cela revient à considérer que seuls les récepteurs protéiques évoluent, tandis que l’évolution des hormones se limiterait à l’apparition successive de celles qui sont connues dans la nature actuelle (actualisme moléculaire). Cette approche anachronique provenait de la difficulté d’appréhender les voies de synthèse hormonales, qui consistent en une succession d’étapes. Prenons un exemple théorique minimaliste (Figure 1).
La première étape est la transformation d’un précurseur initial en intermédiaire par une enzyme 1. La seconde étape est une transformation de l’intermédiaire en hormone active par une enzyme 2. La flèche rouge représente la fixation de l’hormone sur son récepteur.
Dans ce modèle, pour comprendre l’origine du récepteur il suffit d’étudier l’histoire de la famille protéique à laquelle il appartient pour établir dans quelle lignée animale il est apparu, et quels sont les récepteurs les plus proches. Pour comprendre l’origine de l’hormone, il faut étudier l’histoire évolutive des différentes enzymes de la voie métabolique, qui n’appartiennent pas nécessairement à la même famille. Par exemple, cinq familles protéiques différentes sont impliquées dans la synthèse des hormones stéroïdes chez les animaux, et chacune de ces familles comporte plusieurs membres. Par ailleurs, l’étude de l’apparition successive des enzymes impliquées dans une voie de signalisation peut très vite soulever des questions complexes. Par exemple, s’il s’avère que l’enzyme 2 est apparue avant l’enzyme 1, que peut-on en déduire concernant la présence de l’hormone ? Pour que l’hormone soit présente malgré tout à cette période ancienne, il n’existe que deux solutions. La première est que la réaction initiale (précurseur à intermédiaire) soit catalysée par une autre enzyme déjà présente à cette époque. La seconde solution est que l’organisme utilisant cette hormone passe outre la première étape en récupérant directement le composé intermédiaire dans son alimentation. La complexité du scénario augmente pour des voies métaboliques contenant un nombre d’étapes plus important. En outre, toutes les enzymes impliquées dans une voie de synthèse donnée ne sont pas toujours connues au moment où apparaît le besoin de comparer ces voies. Tel est le cas chez les insectes et les nématodes où l’identification des enzymes responsables de certaines étapes est encore l’objet de recherches actives.
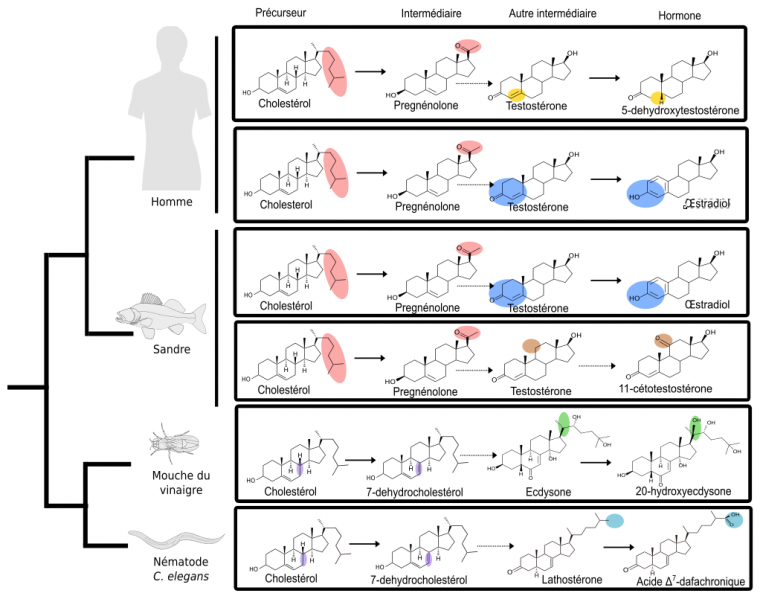
Cependant, il est possible de s’affranchir du problème des connaissances incomplètes sur les enzymes en comparant des voies métaboliques de la même façon que les anatomistes comparent des squelettes d’animaux. En définissant un nouveau type de caractères, les réactions enzymatiques, et un nouveau type de taxon (unité de classification), les voies métaboliques, on peut construire un arbre décrivant le partage des caractères entre ces voies, ce qui peut ensuite être interprété dans une perspective évolutive (Cunchillos et Lecointre, 2007 & 2011) : l’arbre (non présenté ici) ordonne alors dans le temps la disponibilité de certaines enzymes ou de certains types de réactions enzymatiques. Illustrons l’aboutissement de cette approche sur un échantillonnage simplifié, limité aux voies de synthèse des quelques hormones évoquées précédemment (voir Figure 2).
Chaque voie (boîte rectangulaire) part du cholestérol et mène, en plusieurs étapes successives, à une hormone qui se fixera ensuite sur son récepteur. Les ellipses colorées soulignent les transformations subies par chacune des molécules lors d’une réaction chimique, symbolisée par une flèche. Les flèches pointillées symbolisent un ensemble d’étapes non détaillées. L’arbre de gauche n’est pas celui des voies métaboliques, mais celui des espèces.
Grâce à ces résultats nous avons cherché à reconstituer le portrait-robot de l’hormone ancestrale synthétisée chez l’ancêtre commun des chordés, ainsi que la voie de synthèse de cette hormone. Rappelons que le taxon des chordés comprend les vertébrés ainsi que les céphalochordés, tels que l’amphioxus, et les urochordés, comme les ascidies.
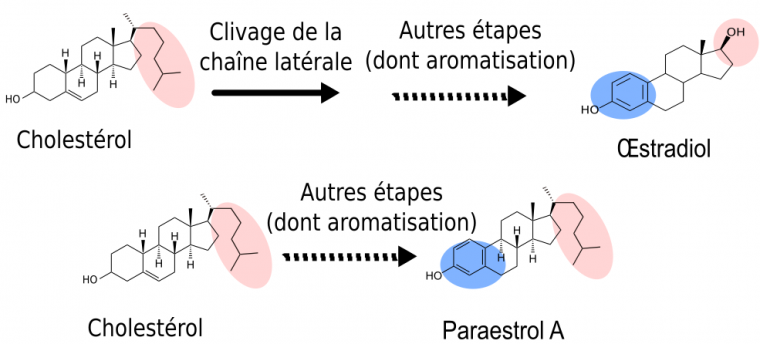
Tout d’abord, nous savons que la première étape de coupure de la chaîne latérale de la molécule de cholestérol (en rose), ne se produit que chez les vertébrés. En effet, des études de génomique comparative (Markov et al., 2009) ont montré que l’enzyme responsable du clivage de la chaîne latérale du cholestérol (Figure 2, étape rose) est apparue spécifiquement chez les vertébrés. L’analyse comparative des voies métaboliques a précisé que cette étape de clivage de la chaîne latérale représentait un des caractères dérivés partagés par toutes les voies de synthèse des hormones de vertébrés (représentées sur la Figure 2 par les voies de synthèse de l’œstradiol, de la 5-déhydroxytestostérone et de la 11-cétotestostérone). Cela signifie donc que, chez l’ancêtre commun des chordés, l’hormone produite possédait cette chaîne latérale (Figure 3).
Les mêmes études de génomique montrent que l’enzyme responsable de l’aromatisation (étape bleue : transformation de la testostérone en œstradiol) était déjà présente chez certains cousins des vertébrés, tels que les amphioxus. Comme le clivage de la chaîne latérale n’était pas encore apparu, cette enzyme devait catalyser la réaction d’aromatisation non pas sur la testostérone, mais sur un substrat présentant une chaîne latérale. L’hormone ancestrale produite était donc chimiquement proche de l’œstradiol. Pour cette raison, nous l’avons nommé paraestrol A (Figure 3). Le préfixe « para » qui signifie « à côté de » est souvent utilisé en systématique pour désigner le genre frère d’un genre déjà décrit. Par analogie, nous l’utilisons ici pour indiquer la parenté entre les voies de synthèse du paraestrol A et de l’œstradiol. La lettre A indique que nous nous attendons à trouver d’autres paraestrols dans la nature, qui porteront en plus une ou plusieurs hydroxylations (groupes –OH) sur le squelette carboné. En effet, l’étude de l’arbre des voies métaboliques indique que les réactions d’hydroxylation sur des noyaux stérols sont apparues avant la divergence entre les voies de synthèse des stéroïdes de vertébrés et les voies de synthèse des stéroïdes d’insectes et de nématodes. On peut constater cela sur la figure 2, où des groupes hydroxyles sont visibles sur l’ecdysone (en vert) et sur l’acide dafachronique (en bleu clair).
En bleu, la portion modifiée par l’aromatisation. En rose, la position de la chaîne latérale, clivée pour l’œstradiol mais pas pour le paraestrol A.
À partir de cette hormone ancestrale des chordés, le paraestrol A, quel scénario peut-on imaginer pour les vertébrés ? D’après les données de la figure 2, on constate qu’il y a eu d’une part apparition de l’enzyme responsable du clivage de la chaîne latérale (étape rose) et également apparition d’enzymes permettant de synthétiser diverses formes de testostérone (5-déhydroxytestostérone et 11-cétotestostérone, étapes jaune et marron, respectivement).
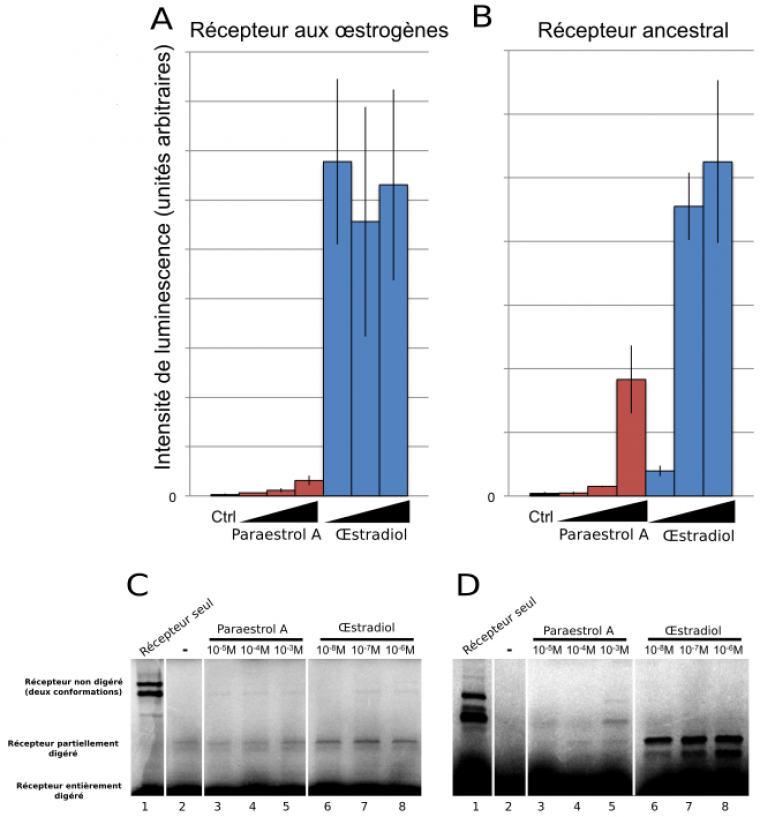
Une fois formulée cette hypothèse concernant la structure et l’origine évolutive du paraestrol A, il devenait très tentant de la mettre à l’épreuve de l’expérimentation. Le paraestrol A serait-il capable de se fixer sur le récepteur ancestral aux stéroïdes de vertébrés ? Pour tester cela, encore fallait-il pouvoir disposer de cette hormone, qui ne figure pas dans les catalogues proposés par les fournisseurs de produits chimiques pour les laboratoires. Par chance, il se trouve que le paraestrol A avait déjà été synthétisé (sous un autre nom) en 1950 par le groupe du chimiste Carl Djerassi, dans le cadre de recherches exploratoires portant sur des stéroïdes artificiels, qui allaient conduire peu de temps après à la synthèse de la noréthystérone, l’un des composants majeurs de la pilule œstro-progestative (Djerassi, 1995). En adaptant légèrement ce protocole ancien, Delphine Pitrat et Jens Hasserodt, du laboratoire de chimie de l’ENS de Lyon, ont réussi à synthétiser de nouveau le paraestrol A en quantité suffisante pour rendre possible les expérimentations biochimiques. Il a alors été possible de tester la capacité du paraestrol A à se fixer sur le récepteur ancestral aux stéroïdes de vertébrés, lui aussi reconstitué artificiellement et exprimé dans des cultures de cellules humaines (Figure 4). Ces tests ont permis de montrer que le paraestrol A peut se fixer au récepteur stéroïde ancestral et l’activer, comme attendu pour l’hormone ancestrale. Néanmoins, cette fixation est moins forte que celle observée avec l’œstradiol, une hormone actuelle sans chaîne latérale.
Un premier test (A-B) a consisté à tester la capacité du paraestrol A à activer l’expression d’un gène rapporteur, codant la luciférase, en présence soit du récepteur aux œstrogènes, soit du récepteur ancestral, exprimés dans les deux cas dans des cellules embryonnaires de rein humain. L’intensité de luminescence mesurée reflète l’intensité d’expression de la luciférase, qui dépend de l’activation du récepteur par le ligand. Un second test (C-D) vise à confirmer plus directement l’interaction physique entre le ligand et le récepteur par une expérience de protéolyse ménagée, dans laquelle la fixation du ligand empêche en partie la digestion du récepteur par la trypsine. Ceci se traduit par la présence d’une bande sur le gel de migration dont l’intensité reflète l’affinité entre le récepteur et le ligand.
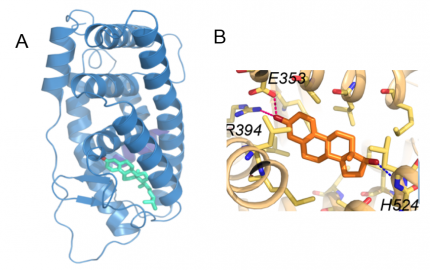
A. En bleu, structure du récepteur ancestral aux stéroïdes fondée sur le modèle par homologie du récepteur aux œstrogènes (ici : ERα). En vert, le paraestrol A, un stéroïde possédant des caractères présents séparément chez le cholestérol et chez les œstrogènes (chaîne latérale et instauration du premier cycle carboné des œstrogènes) est capable de se fixer dans la poche du récepteur et de l’activer. En rouge, la liaison hydrogène entre le paraestrol A et le récepteur. Voir aussi la vidéo. B. Structure de la poche du récepteur aux œstrogènes (ERα, en beige) en présence de 17β-œstradiol (en orange), d’après le fichier PDB 1ERE. La liaison avec les résidus R394 et E353 est partagée avec le couple ancestral, tandis que la liaison avec le résidu H524, lié au groupement hydroxyle spécifique du 17β-œstradiol, est propre au couple 17β-œstradiol/ERα, ce qui explique la plus grande affinité de l’interaction.
Quelle pouvait être la cause mécanistique de cette différence d’affinité ? La réponse a été apportée par une analyse structurale. En effet, la modélisation de la position du paraestrol A dans la poche du récepteur ancestral (Figure 5), a montré que cette molécule ne peut se fixer à la poche du récepteur qu’en un seul point (indiqué en rouge) correspondant au groupe hydroxyle (–OH) unique porté par la molécule de paraestrol A. Par contre, l’œstradiol qui possède un second groupe hydroxyle (celui en rouge sur la figure 3) peut établir deux liaisons hydrogène avec le récepteur, ce qui renforce son affinité.
Vidéo - Le couple ancestral hormone-récepteur ressuscité. Auteur : Isabelle Billas
En bleu, structure du récepteur ancestral aux stéroïdes fondée sur le modèle par homologie du récepteur aux œstrogènes (ici : ERα). La partie terminale en rouge du récepteur correspond à l’hélice H12, dont le mouvement assure la fermeture de la poche de fixation à l’hormone. En vert, le paraestrol A, un stéroïde possédant des caractères présents séparément chez le cholestérol et chez les œstrogènes, est capable de se fixer dans la poche du récepteur et de l’activer. En rouge, la liaison hydrogène entre le paraestrol A et les chaînes latérales de deux acides aminés du récepteur, une arginine et un acide glutamique. La chaîne latérale d’un troisième acide aminé, une histidine, est représentée. Ce troisième acide aminé est impliqué dans une liaison hydrogène supplémentaire avec l’œstradiol, qui assure sa plus grande affinité pour le récepteur par rapport au paraestrol A.
Le clivage de la chaîne latérale, remplacée par un groupe hydroxyle, a donc permis l’apparition d’une nouvelle classe de molécules capables de se fixer avec une forte affinité et une forte spécificité sur différents récepteurs. À ce moment, il existait déjà chez l’ancêtre des vertébrés toute une gamme d’enzymes impliquées dans le catabolisme du cholestérol, qui permettaient de récupérer de l’énergie lors de sa dégradation. Le clivage de la chaîne latérale a fourni à toutes ces enzymes de nouveaux substrats, qui ont pu ainsi générer de nouvelles voies métaboliques aboutissant à la production de molécules dont la spécificité de fixation les rendait aptes à participer à la signalisation hormonale (Figure 6). En quelque sorte, le recyclage en hormones stéroïdes des produits de dégradation du cholestérol représente une sorte de « domestication » moléculaire. Le terme de domestication désigne ici l’acquisition de la capacité à synthétiser de façon endogène un composant moléculaire jusqu’à présent produit dans le milieu. De tels phénomènes ont été clairement établis dans le cas des éléments transposables (Sinzelle et al., 2009).
L’acquisition d’une enzyme capable de cliver la chaîne latérale du cholestérol (en rose) chez l’ancêtre des vertébrés a permis une augmentation de l’affinité pour les récepteurs, symbolisée par les flèches rouges d’épaisseur différente entre l’ancêtre et les espèces actuelles. Le schéma de l’ancêtre des vertébrés est modifié d’après un dessin de Piotr Michał Jaworski (CC BY-SA 3.0, Wikimedia).
Les stéroïdes sont encore loin d’avoir livré tous leurs secrets. Mais le fait d’avoir dressé le portrait-robot d’une nouvelle classe de molécules et posé les jalons de leur caractérisation fonctionnelle devrait permettre de rechercher d’autres paraestrols dans la nature. Notamment chez les plus proches cousins des vertébrés, tels que les ascidies ou l’amphioxus, afin de préciser les conditions de l’apparition de ces hormones disparues, ainsi que leur contribution à la mise en place des mécanismes de couplage entre nutrition et reproduction.
Références
- Gènes du passé : la biologie paléomoléculaire reconstitue des gènes d’espèces préhistoriques. Inédit ! Science et Vie n°1069 , p72 et suivantes. [à propos de l’article « Evolution of Hormone-Receptor Complexity by Molecular Exploitation par Bridgham, Carroll et Thornton, Science 312, 7 avril 2006]
- Evolution : on sait pourquoi elle ne fait pas machine arrière . Science et Vie n°1108, janvier 2010, p102. [à propos de l’article « An epistatic ratchet constrains the direction of glucorticoid receptor evolution » par Bridgham, Orltund et Thornton, Nature 461, septembre 2009]
- Chomin Cunchillos & Guillaume Lecointre. Ordering events of biochemical evolution. Biochimie 89 : 555-573 (2007).
- Carl Djerassi, De la chimie des hormones à la pilule, éd. Belin, coll. Un savant, une époque, 1995, 415 p.
- Hector Escriva, Ricardo Mendonca, Marie-Claire Langlois, Jean-Marc Vanacker, Ray Pierce & Vincent Laudet Systématique et évolution des récepteurs nucléaires d’hormones, Biosystema n°15, 1997, p79-98.
- Vincent Laudet et Dominique Stéhelin, Les Récepteurs Nucléaires, Pour la Science n°183, janvier 1993.
- René Lafont, « Système Endocrinien ». In Universalis éducation [en ligne]. Encyclopædia Universalis, consulté le 20 février 2017. Disponible sur http://www.universalis-edu.com/encyclopedie/systeme-endocrinien/
- Guillaume Lecointre et Chomin Cunchillos « L’exportation de la pensée phylogénétique en biochimie », Chapitre 28 (p 981-1018) du livre Les mondes darwiniens. L’évolution de l’évolution (Paris, Editions Matériologiques, 2011, sous la direction de Thomas Heams, Philippe Huneman, Guillaume Lecointre, Marc Silberstein. Deuxième édition revue et augmentée.
- Gabriel V. Markov, Raquel Tavares, Chantal Dauphin-Villemant, Barbara A. Demeneix, Michael E. Baker, et Vincent Laudet. Independant elaboration of steroid hormone signalin pathways in metazoans. Procedings of the National Academy of Science U.S.A., 106, 11913-11918 (2009).
- Gabriel V. Markov, Juliana Gutierrez-Mazariegos, Delphine Pitrat, Isabelle M. L. Billas, François Bonneton, Dino Moras, Jens Hasserodt, Guillaume Lecointre & Vincent Laudet. Origin of an Ancient Hormone / Receptor Couple Revealed by Resurrection of an Ancestral Estrogen Science Advances, 3, e1601778 (2017). doi : 10.1126/sciadv.1601778
- Ludivine Sinzelle, Zsuzsanna Izsvák, Zoltán Ivics. Molecular domestication of transposable elements : From detrimental parasites to useful host genes. Cellular and Molecular Life Sciences, 66, 1073-1093 (2009).
Voir aussi
Communiqué de presse du CNRS
Reportage vidéo sur Télé Lyon Métropole
Les auteurs remercient Séverine Viala (IGFL) et Isabelle Billas (IGBMC) pour leurs relectures.