Comprendre comment les LDL sont absorbés depuis la circulation sanguine.
Les lipoprotéines sont des particules constituées de protéines et de lipides qui se déplacent dans la circulation sanguine et assurent le transport de différents lipides, notamment les triglycérides, le cholestérol et les phospholipides. Les tissus de l’ensemble de l’organisme utilisent ces graisses dans des fonctions essentielles, comme la synthèse et le maintien des bicouches lipidiques. Cependant, les concentrations de ces lipoprotéines dans la circulation sont soigneusement régulées et différents problèmes de santé peuvent survenir si les lipoprotéines s’accumulent.
Un système de distribution des graisses
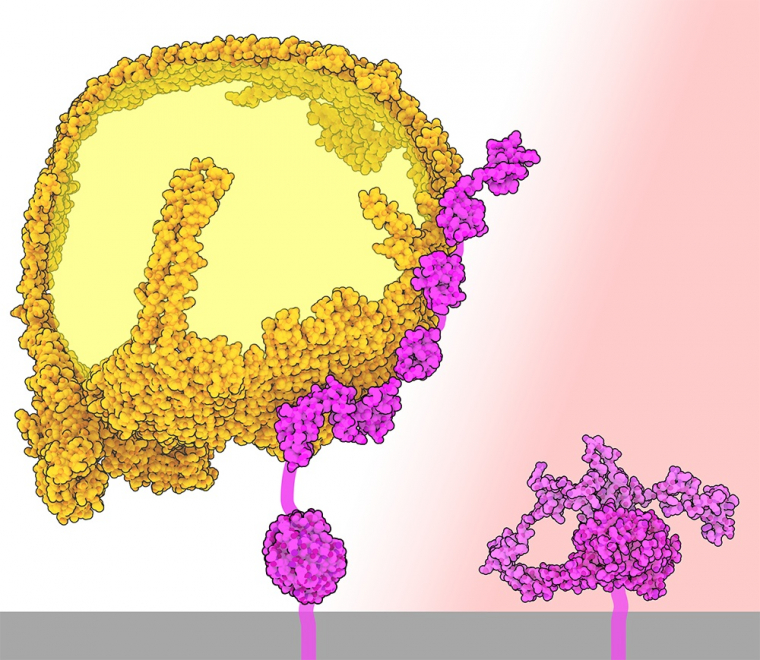
Le parcours de la plupart des lipoprotéines commence dans le foie, où des cellules spécialisées produisent et libèrent des particules appelées lipoprotéines de très basse densité (VLDL) qui contiennent des triglycérides, du cholestérol (et des dérivés du cholestérol), des phospholipides, ainsi que de protéines appelées apolipoprotéines. Lorsque les VLDL circulent dans le sang, les cellules des différents tissus prélèvent les triglycérides, qui sont alors stockés ou utilisés comme source d’énergie, ce qui réduit progressivement la taille de ces particules et modifie leur composition. Ce processus transforme finalement les VLDL en lipoprotéines de faible densité (LDL), qui sont plus riches en cholestérol que les VLDL. La composition protéique de la lipoprotéine change également, car différentes apolipoprotéines sont échangées ou éliminées de la particule au cours de la circulation. Toutefois, l’apolipoprotéine B-100 (ou ApoB100), qui est une grande protéine amphipathique formant une structure en forme de ceinture, représentée en orange sur la figure 1 (entrée de la banque de données sur les protéines (PDB) 9BDT), reste étroitement liée à la particule tout au long de son parcours de VLDL à LDL.
Les LDL qui circulent finissent par retourner dans le foie, où elles sont absorbées et décomposées par les cellules hépatiques. Ces cellules expriment des récepteurs LDL spécialisés (représentés en violet et rose sur la figure 1) qui reconnaissent et se lient à l’apolipoprotéine B-100 1. Une fois liée, la particule de LDL est absorbée par endocytose par la cellule.
Les récepteurs des LDL (représentés en rose et en violet) se lient à plusieurs endroits sur l’apolipoprotéine B-100 (entrée PDB 9BDT).
La libération des LDL
L’environnement acide à l’intérieur de l’endosome1 déclenche la libération de la particule de LDL. Ce processus se produirait par protonation du récepteur des LDL, ce qui diminuerait son affinité pour la particule de LDL et augmenterait son affinité pour lui-même 2. Le récepteur des LDL se replie sur lui-même, comme le montre la figure 2 (entrée PDB 1N7D), et libère la particule LDL dans la lumière de l’endosome. La particule de LDL est ensuite acheminée vers le lysosome ou d’autres compartiments cellulaires, tandis que le récepteur des LDL est recyclé vers la membrane plasmique.
Une adaptation à la taille
Lorsqu'une particule de VLDL est libérée pour la première fois par les cellules hépatiques, elle mesure environ 30 à 60 nm de diamètre et est remplie de triglycérides. Lorsqu’elle est transformée en LDL et absorbée par endocytose, sa taille est réduite à environ 20 nm. De manière surprenante, tout au long de ce parcours, l’apolipoprotéine B-100 reste étroitement enroulée autour de la lipoprotéine, s’adaptant à la taille changeante de la particule. Des découvertes récentes, grâce à une approche de modélisation intégrative – combinant des données de cryomicroscopie électronique, des prédictions structurales et des simulations de dynamique moléculaire – révèlent l’origine de cette flexibilité. L’apolipoprotéine B-100 est notamment formée d’une ceinture β1 qui peut s’ajuster en se resserrant ou en se relâchant, ses extrémités glissant l’une sur l’autre et s’adaptant à la particule lorsque la taille de celle-ci diminue 2. Des régions flexibles, situées entre les brins β qui constituent la ceinture β, peuvent se plier et interagir avec d’autres segments de la protéine lorsque la particule est petite. Ces interactions sont réversibles et leur rupture déplie la structure globale de la protéine, ce qui lui permet de s’adapter à des particules plus grandes. Cette flexibilité structurale permet à l’apolipoprotéine B-100 de rester enroulée autour de la lipoprotéine lorsque celle-ci change de taille et de composition.
Des mutations à l’origine de l’hypercholestérolémie familiale
Les interactions entre l’apolipoprotéine B-100 (représentée en orange) et le récepteur des LDL (représenté en magenta). Les mutations dans l’apolipoprotéine B-100 à l’origine de l’hypercholestérolémie familiale sont représentées en jaune, tandis que celles affectant le récepteur aux LDL sont représentées en rouge.
Si du cholestérol en excès circule dans le sang pendant une période prolongée, des plaques riches en cholestérol peuvent se former dans et sur les parois des artères, ce qui est à l’origine d’une maladie connue sous le nom d’athérosclérose. Avec le temps, les artères peuvent se rétrécir ou se boucher, provoquant des accidents vasculaires cérébraux ou des crises cardiaques. L’hypercholestérolémie familiale est une maladie héréditaire caractérisée par des niveaux élevés de LDL dans la circulation sanguine. Dans de nombreux cas, cette maladie est causée par des mutations dans les gènes codant l’apolipoprotéine B-100 ou les récepteurs des LDL. Vous pouvez examiner de plus près les mutations qui ont été localisées à l’interface de liaison entre l’apolipoprotéine B-100 et le récepteur des LDL en utilisant par exemple le logiciel de visualisation de molécules disponible sur le site PDB-101.
Pour aller plus loin
- Les apolipoprotéines ont inspiré l’ingénierie des nanodisques, qui constituent un outil clé pour l’étude structurale des protéines membranaires. Vous pouvez retrouver un article à ce sujet : Molecule of the month : Nanodiscs and HDL.
- Vous pouvez observer une représentation de la manière dont les lipides sont stockés dans les gouttelettes lipidiques des cellules sur cette illustration de David S. Goodsell.
Ce texte correspond à la traduction par Cédric Bordi de l’article Molecule of the Month : Apolipoprotein B-100 and LDL Receptor 1 écrit par Janet Iwasa et paru en avril 2025 sur le site PDB-101, le portail éducatif de la base de données sur les protéines (PDB). Les notes de bas de page correspondent à des ajouts du traducteur.