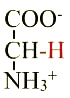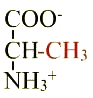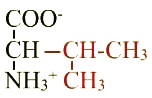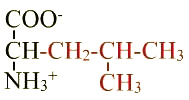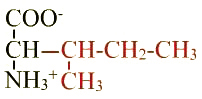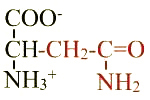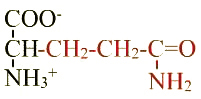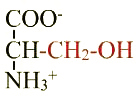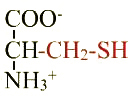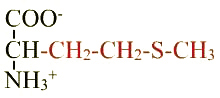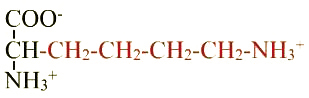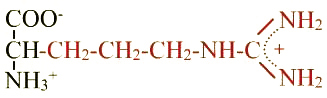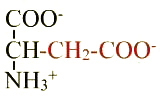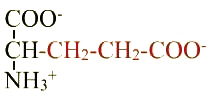Cet article présente la structure et les propriétés des principaux acides aminés.
Introduction
Les acides aminés sont à la base de la constitution des protéines et autres peptides, même s’ils n’en sont pas les uniques constituants (voir par exemple l’hème, groupement prosthétique de l’hémoglobine). Cet article se propose de passer en revue les principales caractéristiques communes à tous les acides aminés, ainsi que les propriétés particulières des principaux acides aminés retrouvés dans les molécules du vivant.
Structure générale d’un acide aminé
Composition chimique
Un acide aminé est une molécule qui est le plus souvent de la forme 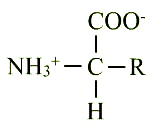 c’est en particulier le cas à pH physiologique.
c’est en particulier le cas à pH physiologique.
On a donc une molécule possédant deux groupements ionisables : l’un acide (COOH <—> COO – + H+), l’autre basique (NH 2 + H+ <—> NH3+). L’atome de carbone sur lequel est fixé le groupement amine – NH2 et le groupement acide carboxylique – COOH est appelé par convention carbone alpha.
Le groupement R correspond à un radical variable selon l’acide aminé considéré. C’est donc lui qui détermine la nature de l’acide aminé puisque le reste est invariant.
Notons que la forme totalement non-ionisée 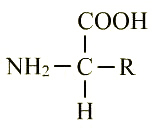 n’existe pratiquement pas car aux pH acides pour lesquels la fonction COOH n’est pas ionisée, la fonction NH2 l’est toujours, et inversement aux pH basiques pour lesquels la fonction NH2 n’est pas ionisée, la fonction COOH l’est toujours.
n’existe pratiquement pas car aux pH acides pour lesquels la fonction COOH n’est pas ionisée, la fonction NH2 l’est toujours, et inversement aux pH basiques pour lesquels la fonction NH2 n’est pas ionisée, la fonction COOH l’est toujours.
Stéréochimie
Le carbone alpha portant quatre groupements différents, ce carbone est asymétrique. Les acides aminés sont donc des molécules chirales. On a deux isomères possibles : l’un de la série D, l’autre de la série L. Il existe une exception : la glycine (voir plus loin).
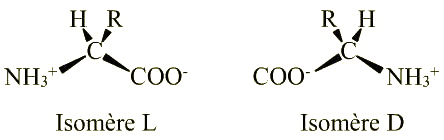
Il se trouve que tous les acides aminés naturels trouvés dans les molécules du vivant sont de la série L.
Pour aller plus loin : A quoi est due cette asymétrie moléculaire ?
Les différents acides aminés intégrés lors de la synthèse des protéines
Nomenclature
Les acides aminés se différencient les uns des autres par leur radical. On peut donc théoriquement faire une infinité d’acides aminés. Cependant, on constate que chez l’Homme, comme chez de nombreuses espèces, seuls vingt acides aminés différents sont incorporés dans les protéines lors de la traduction. Leur masse molaire moléculaire moyenne est de 110 Da.
Pour plus de commodité, un code international de correspondance à une et trois lettres peut être utilisé pour désigner chacun de ces vingt acides aminés.
Pour avoir le détail des caractéristiques d’un acide aminé particulier, cliquez sur son nom.
|
Nom complet de l’acide aminé |
Code à une lettre |
Code à trois lettres |
|
A |
Ala |
|
|
R |
Arg |
|
|
N |
Asn |
|
|
D |
Asp |
|
|
C |
Cys |
|
|
E |
Glu |
|
|
Q |
Gln |
|
|
G |
Gly |
|
|
H |
His |
|
|
I |
Ile |
|
|
L |
Leu |
|
|
K |
Lys |
|
|
M |
Met |
|
|
F |
Phe |
|
|
P |
Pro |
|
|
S |
Ser |
|
|
T |
Thr |
|
|
W |
Trp |
|
|
Y |
Tyr |
|
|
V |
Val |
Caractéristiques chimiques
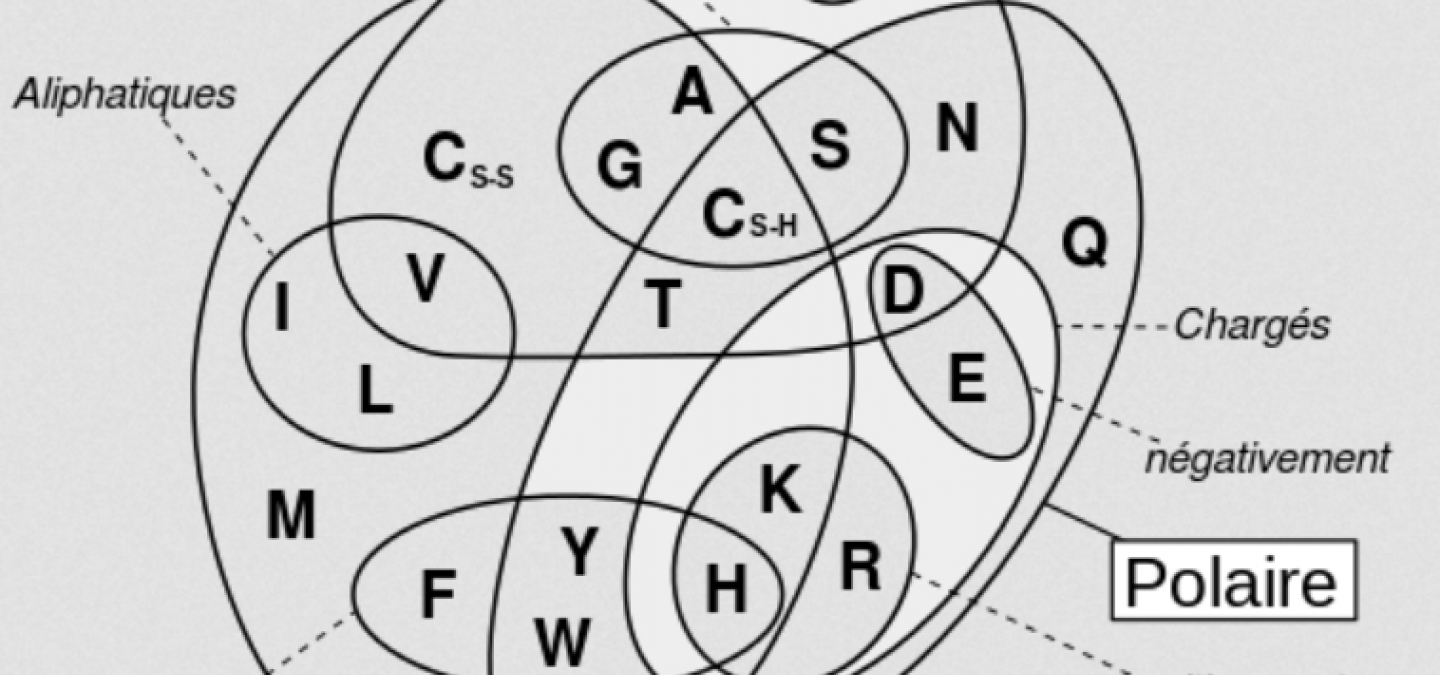
Dans la liste ci-dessous sont rassemblés quelques informations sur chacun des vingt acides aminés incorporés dans les protéines : nature du radical et quelques remarques sur les propriétés associées. Classiquement, on regroupe ces vingt acides aminés par familles, en fonction des propriétés chimiques du radical. Plusieurs types de classement sont possibles puisque certains acides aminés peuvent entrer dans plusieurs catégories.
Remarque : l’état d’ionisation des acides aminés étant dépendant des conditions de pH, il a été choisi dans cette présentation de donner les formules présentant l’état d’ionisation qui prévaut à pH physiologique (pH 7,4).
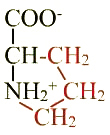
Les acides aminés aliphatiques hydrophobes
|
Glycine (Gly ; G) |
|
|
Radical |
|
|
Remarques |
|
|
Alanine (Ala ; A) |
|
|
Radical |
|
|
Remarques |
|
|
Valine (Val ; V) |
|
|
Radical |
|
|
Remarques |
|
|
Leucine (Leu ; L) |
|
|
Radical |
|
|
Remarques |
|
|
Isoleucine (Ile ; I) |
|
|
Radical |
|
|
Remarques |
|
|
Proline (Pro ; P) |
|
|
Radical |
|
|
Remarques |
|
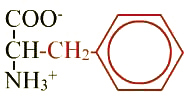
Les acides aminés aromatiques hydrophobes
|
Phénylalanine (Phe ; F) |
|
|
Radical |
|
|
Remarques |
|
|
Tryptophane (Trp ; W) |
|
|
Radical |
|
|
Remarques |
|
Les acides aminés amidés
|
Asparagine (Asn ; N) |
|
|
Radical |
|
|
Remarques |
|
|
Glutamine (Gln ; Q) |
|
|
Radical |
|
|
Remarques |
|
Les acides aminés aromatiques hydroxylés
|
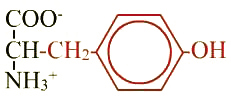
Tyrosine (Tyr ; Y) |
|
|
Radical |
|
|
Remarques |
|
Les acides aminés hydrophiles hydroxylés
|
Sérine (Ser ; S) |
|
|
Radical |
|
|
Remarques |
|
|
Thréonine (Thr ; T) |
|
|
Radical |
|
|
Remarques |
|
Les acides aminés soufrés
|
Cystéine (Cys ; C) |
|
|
Radical |
|
|
Remarques |
|
|
Méthionine (Met ; M) |
|
|
Radical |
|
|
Remarques |
|
Les acides aminés dibasiques
|
Lysine (Lys ; K) |
|
|
Radical |
|
|
Remarques |
|
|
Arginine (Arg ; R) |
|
|
Radical |
|
|
Remarques |
|
|
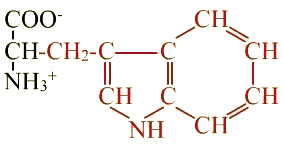
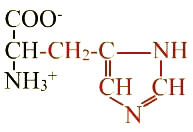
Histidine (His ; H) |
|
|
Radical |
|
|
Remarques |
|
Les acides aminés diacides
|
Aspartate ou acide aspartique (Asp ; D) |
|
|
Radical |
|
|
Remarques |
|
|
Glutamate ou acide glutamique (Glu ; E) |
|
|
Radical |
|
|
Remarques |
|
Conclusion
La connaissance des acides aminés est importante, car ils sont à la base de la construction des protéines, classe majeure parmi les macromolécules du vivant. Cependant, les propriétés individuelles peuvent être plus ou moins fortement modifiées en fonction de leur environnement. A l’extrême, les fonctions acide carboxylique et amine portées par le carbone alpha sont presque toutes mobilisées par les liaisons peptidiques. D’une façon plus subtile, l’histidine peut voir sa charge varier en fonction de son micro environnement, son pHi étant proche du pH physiologique, d’où son utilisation au niveau du site actif de certaines enzymes. Il existe également de nombreux exemple de modification chimique se déroulant après la traduction et modifiant de fait les propriétés décrites. S’il est donc essentiel de connaître le répertoire en acides aminés pour comprendre la biochimie, cette connaissance ne saurait dispenser de l’étude des nombreux cas particuliers que constituent les polymères de ces molécules, à savoir les peptides et les protéines.