Dans les spermatozoïdes, les histones sont remplacées par des protamines, qui permettent une condensation extrême de la chromatine. Une étude réalisée chez la drosophile montre que le retrait des histones lors de la spermatogenèse est un préalable nécessaire au bon déroulement des étapes suivant la fécondation.
Ce texte a été initialement publié à cette adresse le 22 novembre 2023 sur Actualités scientifiques Prépas, le blog d'actualités de Patrick Pla, maître de conférences à l'université Paris Saclay. La version proposée ici a été adaptée pour Planet-Vie.
Durant la différenciation des spermatozoïdes, le noyau prend une forme aplatie et effilée et la chromatine se condense. La plupart des histones (90 % chez l’être humain et 95 % chez la souris) sont alors remplacées par des protamines. Riches en arginine et en cystéine, les protamines sont capables d’établir entre elles des ponts disulfures et contribuent ainsi à une forte condensation de la chromatine, ce qui bloque complètement la transcription.
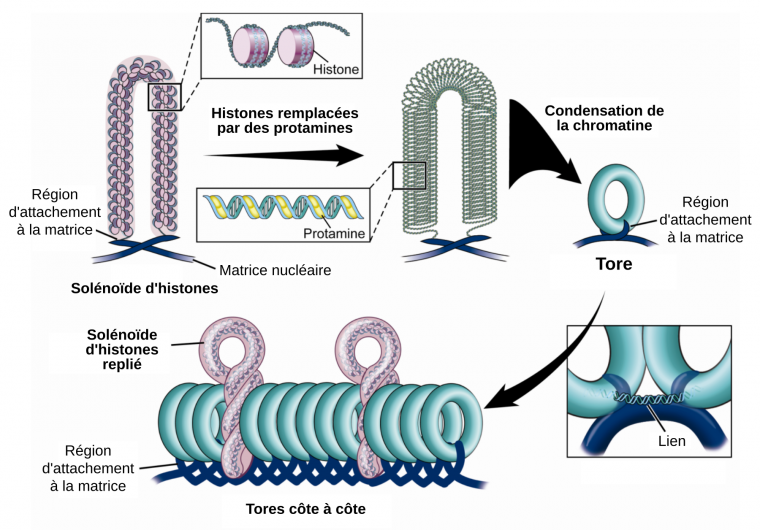
L’ADN des spermatozoïdes est organisé de trois façons. La majorité de l’ADN est enroulé dans des structures toriques dont l’empilement permet de minimiser l’encombrement. Cette structure en tore est stabilisée par des protamines qui neutralisent la répulsion qui se produirait sinon entre les groupements phosphates chargés négativement du squelette de l’ADN. Une petite fraction de l’ADN est associé à des histones dans des solénoïdes. Le reste de l’ADN est associé à la matrice nucléaire au niveau de zones appelées régions d’attachement à la matrice.
Une équipe de l’École normale supérieure de Lyon a pu montrer toute l’importance de cette structure particulière de la chromatine dans un article publié dans Science 1. Les chercheurs et chercheuses ont pris pour modèle la drosophile et étudié un mutant appelé paternal loss (pal), isolé dans un crible génétique des années 1970, mais qui n’avait pas été analysé à l’échelle moléculaire à l’époque. L’étude de ce mutant a permis de montrer que la protéine Pal est nécessaire pour enlever les histones H3 et H4 dans la chromatine des spermatozoïdes. En absence d’une Pal fonctionnelle, des histones H3 et H4 restent présentes en abondance, sans que cela n’empêche pour autant la fusion des deux gamètes.
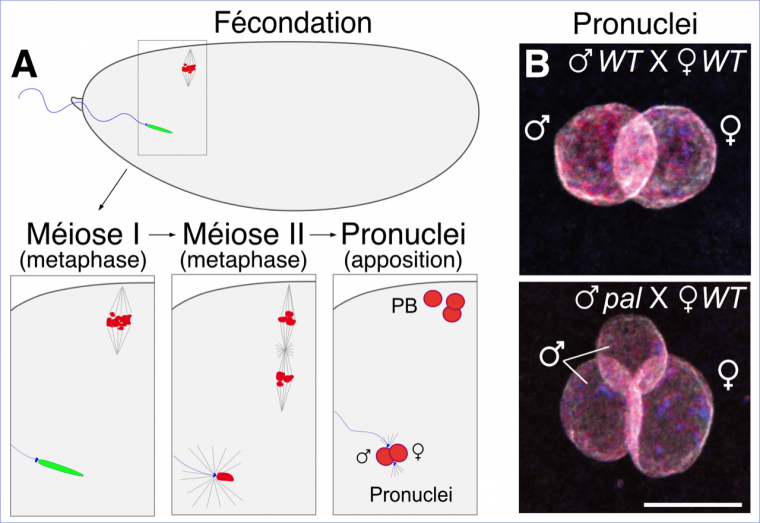
En revanche, les chromosomes paternels des mutants pal sont anormalement reconnus par les protéines de l’ovocyte qui permettent de terminer la méiose. Il faut en effet se souvenir que la fécondation se réalise entre un spermatozoïde et un ovocyte qui n’a pas terminé sa méiose. Chez la drosophile, l’ovocyte est ainsi bloqué en métaphase I2. Chez le mutant pal, après la fécondation, les chromosomes paternels sont reconnus par erreur comme des chromosomes maternels et subissent une division méiotique aberrante qui entraîne la fragmentation du pronucléus paternel et la perte de chromosomes au début du développement de l’embryon.
A. À la fécondation, la méiose se poursuit dans l’ovocyte et produit un pronucleus femelle et trois globules polaires (notés PB, pour polar bodies). Le pronucleus femelle migre et s’appose au pronucleus mâle sans fusionner. Les deux noyaux se divisent ensuite et fusionneront en télophase de la première mitose zygotique.
B. Observation des pronuclei apposés en microscopie à fluorescence (bleu : ADN, rouge : histone, blanc : lamine). Dans la situation témoin, les deux pronuclei sont correctement apposés. Chez le mutant pal, le pronucleus mâle est scindé en deux à l’issue d’une division méiotique aberrante. WT : wild type, type sauvage.
Jusqu’à présent, le remplacement des histones par les protamines avait surtout été interprété comme un moyen de condenser fortement l’ADN dans les spermatozoïdes qui se doivent d’être les plus petits et effilés possible pour gagner en mobilité. Cette étude montre que le retrait des histones est indispensable au déroulement correct des étapes suivant la fécondation.