L’expérience historique de la banane de Hausser et Von Oehmcke en 1933 est un moyen très visuel de mettre en évidence les mutations induites par les rayonnements ultraviolets, leurs conséquences, et surtout les systèmes de réparation de ces mutations par les photolyases. Cet article détaillera le protocole à réaliser pour reproduire l’expérience, les utilisations potentielles en classe et les notions théoriques relatives à ces mutations et à leurs réparations.
Introduction historique
L’effet nocif des rayonnements ultraviolets (UV) a été étudié dès le début du XXᵉ siècle sur des micro-organismes. En 1933, Hausser et Von Oehmcke découvrent l’effet de la photoréactivation 1. Ils s’aperçoivent qu’une banane exposée aux UV noircit rapidement, sauf si elle est exposée à de la lumière blanche immédiatement après. Par la suite, les mécanismes de la photoréactivation ont surtout été étudiés sur des virus (bactériophages), des bactéries (E. coli) et des levures (Saccharomyces spp.). En 1958, la présence d’une enzyme photoréactivatrice est identifiée dans des extraits de E. coli et de S. cerevisiae. À partir de cette même année, les mécanismes de formation des dimères de thymine par exposition aux UV commencent à être étudiés. La photolyase est isolée puis purifiée pour la première fois en 1971 à partir d’extraits de levures et en 1984 le gène PHR1, codant une photolyase, est cloné et sa position dans le génome de S. cerevisiae est déterminée. À l’heure actuelle, le mécanisme exact de la photoréactivation est mieux compris, mais fait toujours l’objet d’études 23.
Protocole
Matériel
- Une banane, ni trop mûre, ni trop verte
- Papier aluminium
- Boîte à UV (La boite à UV utilisée était réglée sur une longueur d’onde de 254 nm)
- Feutre
- Gants et lunettes le temps de la manipulation de la boîte à UV
Déroulé
- Emballer les extrémités de la banane de papier aluminium.
- Placer la banane dans la boîte à UV éteinte et la refermer.
- Allumer la boîte à UV pendant 2 minutes puis l’éteindre avant d’en sortir la banane. Attention, les UV peuvent provoquer des brûlures ; il ne faut donc exposer ni la peau ni les yeux au rayonnement ultraviolet.
- Exposer la banane au soleil et emballer immédiatement avec du papier aluminium la zone « 0 » (Figure 1), puis progressivement après 10, 20, 30, 40 et 50 minutes les zones indiquées sur la banane. Utiliser un feutre pour noter les différentes durées d’exposition.
- Garder à l’obscurité à température ambiante pendant environ une semaine.
Conseils
La banane peut être exposée au soleil derrière une fenêtre. Par temps nuageux, l’effet est plus faible, mais toujours visible. Les lampes de bureau classiques ne peuvent remplacer le soleil, car elles n’émettent pas suffisamment dans le proche UV. En revanche les rampes LED d’aquarium fonctionnent et des lampes utilisées pour la croissance des plantes devraient aussi permettre d’obtenir de bons résultats.
Des élèves et des collègues ont proposé d’utiliser une banane par condition expérimentale (par durée d’exposition au soleil) plutôt qu’une même banane avec un gradient de durée d’exposition au soleil. Ce protocole est effectivement plus simple à mettre en place, mais on se retrouve alors à comparer la teinte de la peau de bananes différentes avec des stades de maturité différents… Les résultats peuvent alors être décevants, car le protocole est moins rigoureux.
Les résultats
Description
Les extrémités de la banane, protégées des UV, ne montrent pas de signes de brunissement, autres que ceux liés au mûrissement. La partie centrale, exposée aux UV, a bruni. Cependant, l’intensité du brunissement est d’autant plus faible que la banane a été, suite à son exposition aux UV, placée longtemps à la lumière du soleil.
Résultat après une semaine.
Interprétation
Les UV altèrent le mûrissement normal de la banane. Les effets des UV peuvent être neutralisés par une exposition subséquente à la lumière du soleil.
Compléments scientifiques
Les ultraviolets induisent la formation de dimères de pyrimidines, et en particulier de dimères de thymines, dans l’ADN (Figure 2). Exposée aux UV puis mise immédiatement à l’obscurité, la banane noircit du fait de la mort cellulaire. Exposée aux UV puis à la lumière du soleil, la photolyase est activée. Cette enzyme supprime les dimères de thymine et corrige donc les mutations : les cellules ne meurent pas et l’épiderme reste jaune 12.
La lumière du soleil émet également des rayonnements dans le spectre des UV, mais l’énergie des UV est plus importante dans la boite à UV du laboratoire. Au soleil, il y a moins d’UV, et la lumière proche-UV (350 – 450 nm) active la photolyase : la réparation de l’ADN prend le dessus sur la destruction.
Les mutations dues aux UV
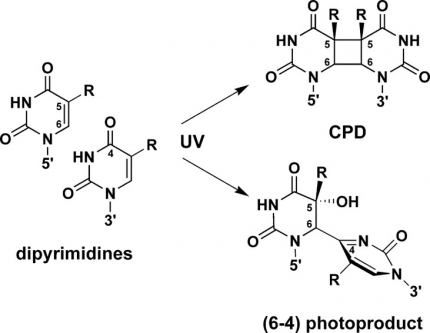
L’absorption des UV par l’ADN peut induire la formation de dimères de nucléotides sur l’ADN. Il existe deux catégories de dimères : les dimères de pyrimidine cyclobutane (Cyclobutan Pyrimidin Dimer, CPD), et les photoproduits (6-4) (Figure 2). Dans le cas des CPD, deux liaisons covalentes se forment entre les cycles pyrimidiques des deux thymines. Chez les photoproduits (6-4), une seule liaison covalente relie le carbone 6’ du cycle d’une thymine avec le carbone 4’ du cycle de la thymine adjacente.
La formation de dimères incluant une ou deux cytosines est possible, mais ces pyrimidines (bases azotées à un cycle) sont environ dix fois moins réactives que les thymines sur la double hélice d’ADN. Les produits en (6-4) sont moins courants (25 % des photoproduits) que les produits CPD (75 %) et il se forme environ une dizaine de dimères CPD par million de bases pour chaque irradiation à des UV de longueur d’onde 254 nm et d’énergie 1 J/m² 1. Ces mutations en dimères de thymines provoquent une déformation de l’ADN au niveau de laquelle se fixent les photolyases.
Les photolyases : systèmes de réparation des dimères de thymines
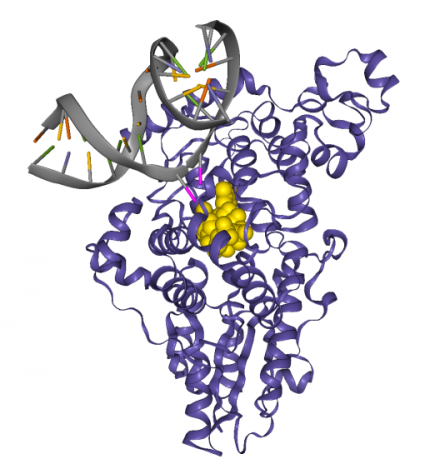
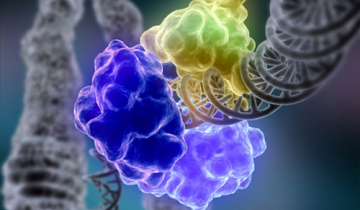
Les deux thymines sont représentées en rose. La protéine est en bleu et le cofacteur FADH− est en jaune. On remarque que les deux thymines sont tournées vers l’extérieur de l’hélice d’ADN, en direction de la photolyase et plus précisément du cofacteur. Cette conformation est induite par la photolyase 1. Cet exemple permet également d’illustrer les notions de cofacteur et de site actif. Source : structure 3CVU.
Les photolyases sont des enzymes de 55 à 65 kDa qui contiennent une flavine adénine dinucléotide réduite de deux électrons1 (FADH−) comme cofacteur et qui réparent les lésions de l’ADN induites par les UV grâce à l’énergie lumineuse proche-UV (350-450 nm) 23. Les photolyases peuvent être divisées en deux grands groupes fonctionnels : celles qui réparent les dimères CPD, et celles qui réparent les photoproduits de type (6-4). Les photolyases sont très conservées dans le monde vivant : on en trouve chez les virus, les Bactéries (dont Bacillus firmus), les Archées (Methanobacterium thermoautotrophicum), les levures, les Mammifères non placentaires (Monotrèmes et Marsupiaux)… avec des exceptions dans tous les clades (absentes chez Bacillus subtilis, la levure Schizosaccharomyces pombe, l’archée Methanococcus vannielii, Homo sapiens…) 4. Les photolyases de type (6-4) ne sont retrouvées que chez les Eucaryotes et sont probablement apparues à partir des photolyases de type CPD qui sont présentes dans tous les domaines du vivant. Les photolyases ont vraisemblablement joué un rôle important dans le maintien de l’intégrité de l’ADN avant la formation de la couche d’ozone, quand les organismes étaient particulièrement vulnérables aux UV. Elles sont considérées comme étant les premières enzymes de réparation de l’ADN et comme étant apparues très tôt au cours de l’évolution. La mise en place de la couche d’ozone a probablement permis la relaxation des contraintes sur les photolyases, ce qui pourrait expliquer la perte de ces gènes chez de nombreuses espèces de tous les domaines du vivant 5.
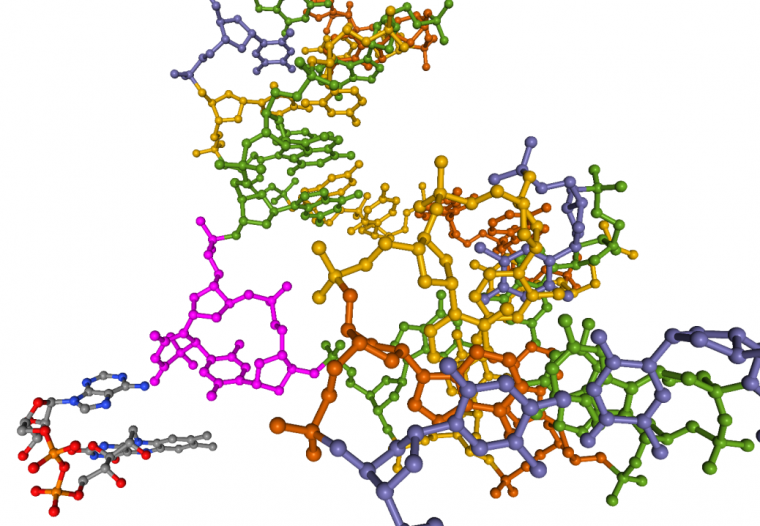
Ici, la protéine a été cachée. Les deux thymines apparaissent en rose. On voit que les deux cycles sont reliés par une seule liaison covalente. Il s’agit donc d’un dimère de type (6-4). Le cofacteur FADH− est présent juste à côté du dimère et possède une conformation en U typique des FADH− de photolyases [10]. Source : structure 3CVU.
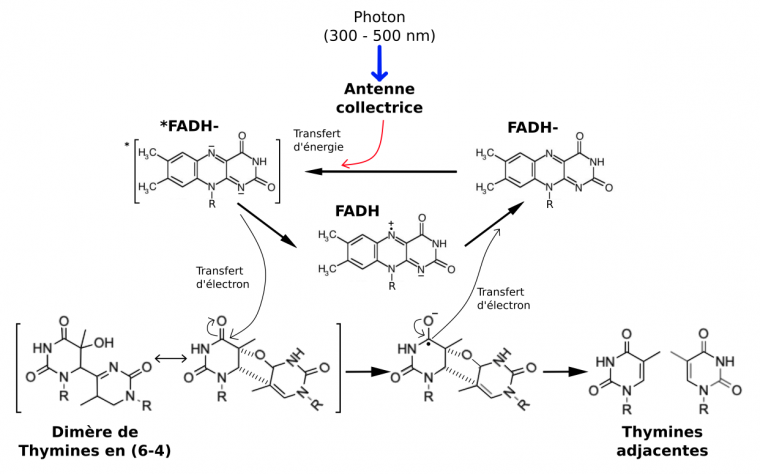
La réparation des dimères par les photolyases implique l’absorption de lumière bleue (350 – 450 nm) captée par une photoantenne collectrice, dont l’énergie est transmise au cofacteur FADH−.
Le mécanisme est centré sur le cofacteur FADH−. Une antenne collectrice (un chromophore, par exemple l'acide 5,10-méthylènetétrahydrofolique) augmente l’efficacité d’absorption des photons par la photolyase. La réparation des dimères CPD fonctionne sur le même principe. D'après 1.
Compléments pédagogiques
En classe, une seule banane peut être exposée aux UV puis utilisée comme illustration ou document d’accroche pour étudier les mutations liées aux UV et leur réparation. Les élèves peuvent aussi réaliser l’expérience en groupe, avec découverte et analyse des résultats la semaine suivante. Pour faciliter les manipulations, on peut aussi envisager d’exposer chaque banane au soleil pendant une durée différente. Mais il faut alors faire attention à ce que les bananes soient à un stade de maturation identique pour que les résultats soient comparables.
L’amorce peut être purement historique, ou présenter le rôle des UV dans les cancers de la peau, ou plus précisément les cas de Xeroderma pigmentosum. On pourra alors proposer d’étudier l’action des UV avec un substitut de la peau : des bananes.
Les conséquences des UV pourront être mises en lien avec l’effet protecteur de la couche d’ozone et avec les contraintes de l’apparition de la vie avant sa formation.
La structure et le mécanisme d’action des photolyases peuvent être étudiés en classe grâce à des fichiers de la ProteinDataBank. Le fichier 3CVU est particulièrement utile 12 : il contient une photolyase de Drosophila melanogaster fixée à un fragment d’ADN au niveau d’un dimère de thymines. La structure a été résolue par diffraction aux rayons X. Le fichier peut être ouvert avec RasTop ou sur libmol.org.
Conclusion et remerciements
J’espère que cet article aidera à traiter les notions de mutations et de réparation de manière visuelle, expérimentale, pratique et intéressante. Je remercie Romain Berardozzi pour m’avoir fait découvrir l’expérience de Hausser et Von Oehmcke. Merci à Estelle Renaud pour sa relecture et ses conseils. La réflexion autour de cet article, la réalisation et l’utilisation pratique de cette expérience en classe ont été enrichies par les contributions de nombreux collègues. Merci à eux.
Cet article est une version adaptée pour Planet-Vie d'un document initialement publié dans le bulletin n° 4-2019 de l'Association des professeurs de biologie et géologie (APBG).