Les minuscules animaux connus sous le nom de tardigrades utilisent une combinaison de mécanismes de réparation de l’ADN ainsi qu’une protéine jusqu’ici inconnue pour réparer leur génome après une irradiation ionisante intense.
Lorsque l’on pense à l’animal le plus résistant au monde, on peut penser à un lion ou à un tigre. Mais un prétendant moins connu à ce titre est un minuscule animal connu sous le nom de tardigrade, réputé pour survivre à des conditions extrêmes. Il peut être congelé, chauffé au-delà du point d’ébullition de l’eau, complètement desséché, exposé au vide de l’espace et même bombardé par des niveaux extrêmement élevés de rayonnements ionisants 12.
La façon dont les tardigrades supportent ces conditions extrêmes est l’un des principaux mystères de la physiologie. Aujourd’hui, dans eLife, Jean-Paul Concordet et Anne de Cian, du Muséum national d’Histoire naturelle, ainsi que leurs collègues – dont Marwan Anoud, Emmanuelle Delagoutte et Quentin Helleu en tant que premiers auteurs – communiquent de nouvelles informations sur la façon dont les tardigrades survivent à l’exposition aux rayonnements ionisants 3.
Les rayonnements ionisants endommagent généralement les cellules en provoquant la fragmentation de leur ADN 4. On pensait autrefois que les organismes capables de survivre à des doses extrêmes de radiations, comme les tardigrades, pouvaient le faire en bloquant et en empêchant les radiations d’endommager leur ADN. Une publication antérieure suggère que les tardigrades utilisent une protéine connue sous le nom de Dsup pour éviter les dommages à l’ADN pendant l’exposition aux radiations 5. Cependant, Anoud et coll. ont constaté que les tardigrades accumulent la même quantité de dommages à l’ADN que les organismes et les cellules qui ne tolèrent pas les radiations, comme les cellules humaines en culture 6. Si les tardigrades ne survivent pas aux rayonnements ionisants en bloquant directement les lésions de l’ADN, comment supportent-ils une telle agression ?
Pour répondre à cette question, l’équipe (basée dans différents instituts en France et en Italie) a examiné trois espèces de tardigrades, en utilisant une technique connue sous le nom de séquençage de l’ARN, pour voir quels gènes sont activés lorsqu’ils sont exposés à des rayonnements ionisants. Ils ont également exposé des tardigrades à la bléomycine, un médicament qui imite les effets des radiations en créant des cassures double brin dans l’ADN.
Les chercheurs ont constaté que les tardigrades surexprimaient des gènes impliqués dans la machinerie de réparation de l’ADN, qui est commune à de nombreuses formes de vie, des organismes unicellulaires à l’être humain. Les auteurs ont également noté que les dommages à l’ADN initialement accumulés par les tardigrades à la suite de radiations ou d’un traitement à la bléomycine disparaissaient progressivement après l’exposition. Dans l’ensemble, ces résultats suggèrent fortement que, pour faire face à la fragmentation de l’ADN causée par les rayonnements ionisants, les tardigrades mettent en place un ensemble robuste de mécanismes de réparation de leur génome.
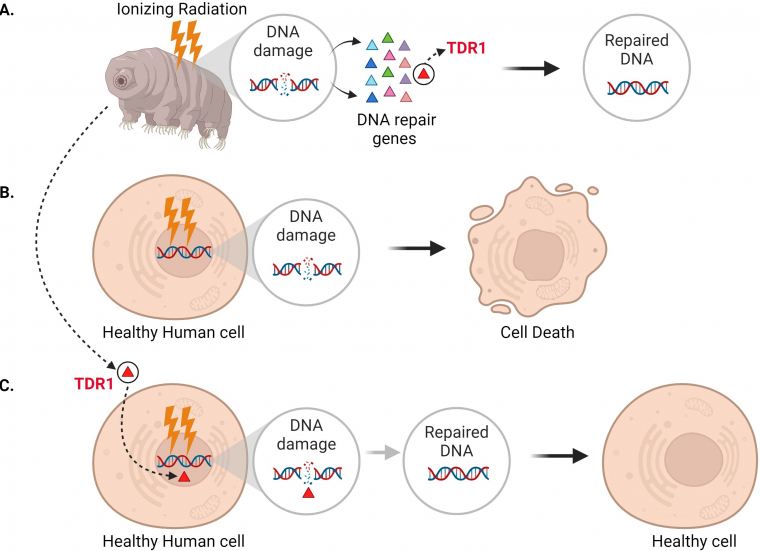
En plus de constater que la machinerie de réparation de l’ADN est suractivée à la suite de radiations ionisantes, Anoud et coll. ont identifié un nouveau gène présent uniquement chez les tardigrades, qui code une protéine qu’ils ont nommée TDR1 (abréviation de Tardigrade DNA Repair Protein 1). Des expériences complémentaires ont révélé que TDR1 peut pénétrer dans le noyau de la cellule et se lier à l’ADN. Cela pourrait être dû à des parties conservées de TDR1, qui sont en grande partie chargées positivement, et qui interagiraient électrostatiquement avec l’ADN chargé négativement. De plus, à des concentrations élevées, TDR1 ne fait pas que se lier à l’ADN, il forme également des agrégats de manière dose-dépendante. Enfin, Anoud et coll. ont montré que l’introduction du gène TDR1 dans des cellules humaines saines réduisait la quantité de dommages causés à l’ADN par la bléomycine, ce qui indique que la protéine TDR1 contribue à la réparation de l’ADN (Figure 1).
(A) Chez les tardigrades, l’exposition aux rayonnements ionisants ou à la bléomycine provoque des lésions de l’ADN, telles que des cassures double brin. Cela active divers gènes (triangles) qui réparent le génome, dont le gène qui code la protéine TDR1 (triangle rouge). (B) Le traitement à la bléomycine (représenté par des éclairs) provoque également des cassures double brin de l’ADN dans les cellules humaines. Cependant, ces cassures ne peuvent pas être réparées efficacement, ce qui entraîne la mort de la cellule. (C) Anoud et coll. ont découvert que l’introduction du gène TDR1 dans le génome des cellules humaines augmente leur capacité à réparer les lésions de l’ADN et leurs chances de survie.
Bien que l’on ne sache pas encore exactement comment les tardigrades réparent les dommages à l’ADN, cette étude suggère que leur capacité à survivre à des radiations extrêmes est liée à leur forte capacité de réparation de l’ADN, dans laquelle TDR1 joue probablement un rôle crucial. Anoud et coll. ont constaté qu’à l’inverse d’autres protéines de réparation 1, TDR1 ne s’accumulait pas sur les sites de dommages à l’ADN. Ils proposent plutôt que la protéine répare l’ADN en se liant à lui et en formant des agrégats qui condensent l’ADN fragmenté et aident à maintenir l’organisation du génome endommagé.
Cependant, d’autres recherches sont nécessaires pour bien comprendre le mécanisme impliquant TDR1 et d’autres protéines et permettant aux tardigrades de survivre aux rayonnements ionisants. À terme, savoir comment ces minuscules organismes réparent efficacement leur ADN pourrait conduire à de nouvelles stratégies de protection des cellules humaines contre les dommages causés par les radiations, ce qui pourrait être bénéfique pour le traitement des cancers et l’exploration spatiale.
Ce texte correspond à la traduction par Valérie Boutin de l’article intitulé Tardigrades: Surviving extreme radiation, écrit par Chaitra Shree Udugere Shivakumara Swamy et Thomas C. Boothby et paru en 2024 dans la revue eLife 1. La relecture de la traduction a été assurée par Jean-Paul Concordet, chercheur au laboratoire Structure et instabilité des génomes, au Muséum national d'Histoire naturelle, et coauteur de l'étude présentée ici.