En fonction des conditions environnementales et des pressions anthropiques, la biomasse globale des forêts peut augmenter ou diminuer au cours du temps. En modélisant les effets de différents facteurs sur l'évolution de la biomasse forestière, et en recoupant les résultats obtenus avec les données d'observation des stocks de carbone forestiers entre 1990 et 2020, notre étude montre que la déforestation entraîne une diminution du stock global de carbone de la biomasse des forêts. Cette diminution n'est que partiellement compensée par l'augmentation du taux de croissance des arbres.
Contexte et lacunes scientifiques
Les forêts offrent un grand potentiel de solutions fondées sur la nature pour atténuer le changement climatique. En effet, à l’échelle globale, les forêts absorbent le CO2 atmosphérique et l’intensité de ce flux de carbone croît depuis plusieurs dizaines d’années. Ceci est dû à une accélération de la croissance des forêts qui résulte d’un ensemble de mécanismes : fertilisation de la croissance des arbres par l’augmentation des concentrations atmosphérique en CO2, allongement de la période de croissance – surtout dans les zones boréales et tempérées – due à l’élévation des températures printanières et automnales, fertilisation en azote par les retombés atmosphériques d’ammoniaque1–6. Toutefois, l’importance relative de l’accélération de la croissance des forêts par rapport à d’autres mécanismes dans l’absorption du carbone par la biomasse restait peu quantifiée avant notre étude publiée en 2021 dans Nature Communications 7.
Méthode
Un modèle parcimonieux de croissance forestière
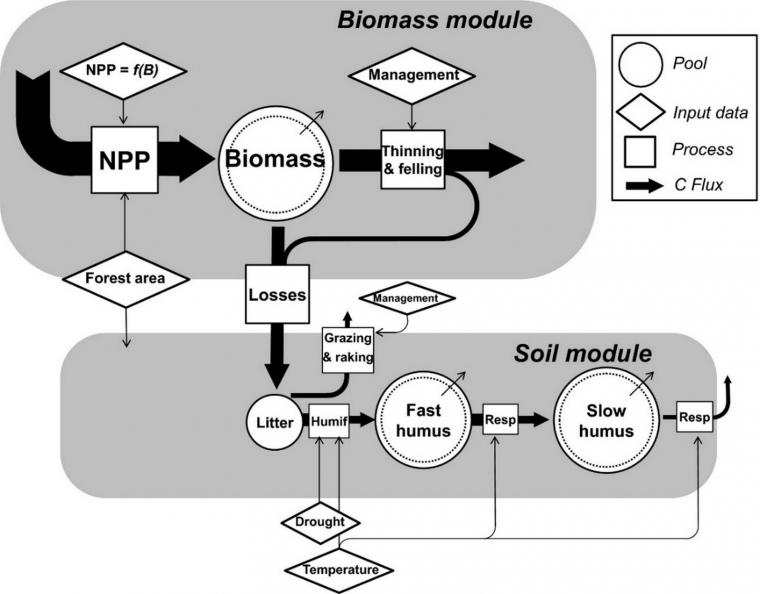
Avec mes collègues de l’Institut d’écologie sociale de Vienne, nous avons élaboré un modèle parcimonieux de la croissance de la végétation dans les forêts, nommé CRAFT8 (CaRbon Accumulation in ForesT, Figure 1). Ce modèle a été conçu avec pour objectif de pouvoir déterminer l’importance relative de différents phénomènes (déforestation, incendies, taux de croissance et exploitation du bois) dans le flux net de carbone entre la biomasse des forêts et l’atmosphère.
Le module de dynamique de la biomasse repose sur une relation parabolique entre la production primaire nette et la biomasse sur pied. Le module de biomasse est lié au module de sol par les pertes de biomasse vers la litière entraînées par la mortalité naturelle et la récolte. Le module sol – non utilisé dans le cadre de cette étude – est basé sur le modèle FORCLIM-D [9,10].
Ce modèle simule la croissance annuelle des forêts (productivité primaire nette, $NPP$) comme une fonction parabolique de la biomasse sur pied (aérienne et souterraine, $B$). Cette fonction dépend de trois paramètres clés : le taux de croissance annuel $r$ en 1990 qui correspond au rapport entre la production primaire nette annuelle et la biomasse sur pied (an-1), la variation $α$ du paramètre $r$ entre 1990 et 2020 (%.an-1), et la capacité de portance théorique $K$ qui correspond à la biomasse maximum que pourrait théoriquement atteindre un hectare de forêt en l’absence de mortalité (tC.ha-1). Nous avons utilisé les données d’observation de la biomasse des forêts mises à disposition par la FAO à un niveau de résolution spatiale nationale pour calibrer la valeur de ces trois paramètres.
$$\mathit{NPP}=\mathit{\alpha rB}\left(1-\frac B K\right)$$
Une fois cette calibration des paramètres réalisée, la dynamique temporelle est calculée par une fonction de récurrence : la biomasse à un instant t+1 est calculée comme la différence entre d’une part la somme de la biomasse à l’instant t et la production primaire annuelle et d’autre part la somme des pertes annuelles de biomasse par la récolte, la mortalité, la déforestation et les incendies.
$$B_{n+1}=\left[B_n+\mathit{NPP}_n-\left(1+\mathit{PR}\right)R_{n+1}-\mathit{PF}_{n+1}-mB_n\right]\times \mathit{MIN}\left(1,S_n/S_{n+1}\right)$$
Avec $n$ le pas de temps (an) ; $NPP$ la production primaire nette (tC ha-1) ; $B$ la densité de la biomasse (tC ha-1) ; $PR$ les pertes à la récolte (%) ; $R$ le taux de récolte (tC ha-1) ; $PF$ les pertes par le feu (tC ha-1) ; $m$ le taux de mortalité (%) et ; $S$ les surfaces forestières (ha).
Ce modèle nous a permis de reproduire très précisément les données d’observation à l’échelle nationale de la FAO sur la période 1990-2020, ce qui est une manière d’évaluer la performance du modèle. Nous avons choisi cette période car il s’agit de celle où les données de la FAO sont disponibles de manière homogène pour tous les pays du monde. Les données ont ensuite été sommées pour obtenir des résultats à l’échelle mondiale.
Une approche contrefactuelle
Pour isoler et quantifier l’influence des différentes causes des émissions de la biomasse forestière, nous avons développé une approche contrefactuelle. Ce type d’approche consiste à « faire comme si ». Nous nous sommes posés plusieurs questions : quels auraient été les stocks de carbone dans la biomasse forestière si les surfaces des forêts étaient restées constantes depuis 1990 ? Si le taux de croissance annuel (le paramètre $r$) était resté constant depuis 1990 ? Si la récolte annuelle était restée constante depuis 1990 ? Si les surfaces incendiées étaient restées constantes depuis 1990 ? En l’absence de toute récolte depuis 1990 ? En l’absence de tout feu de forêt depuis 1990 ? Notre modèle CRAFT permet de simuler cette dynamique pour chacun des scénarios contrefactuels testés. La comparaison entre les stocks de carbone réel (données de la FAO) et ceux simulés par notre modèle dans chacune des analyses contrefactuelles en 2020 permet ensuite d’évaluer les effets de chacune des variables.
Principaux résultats de notre étude
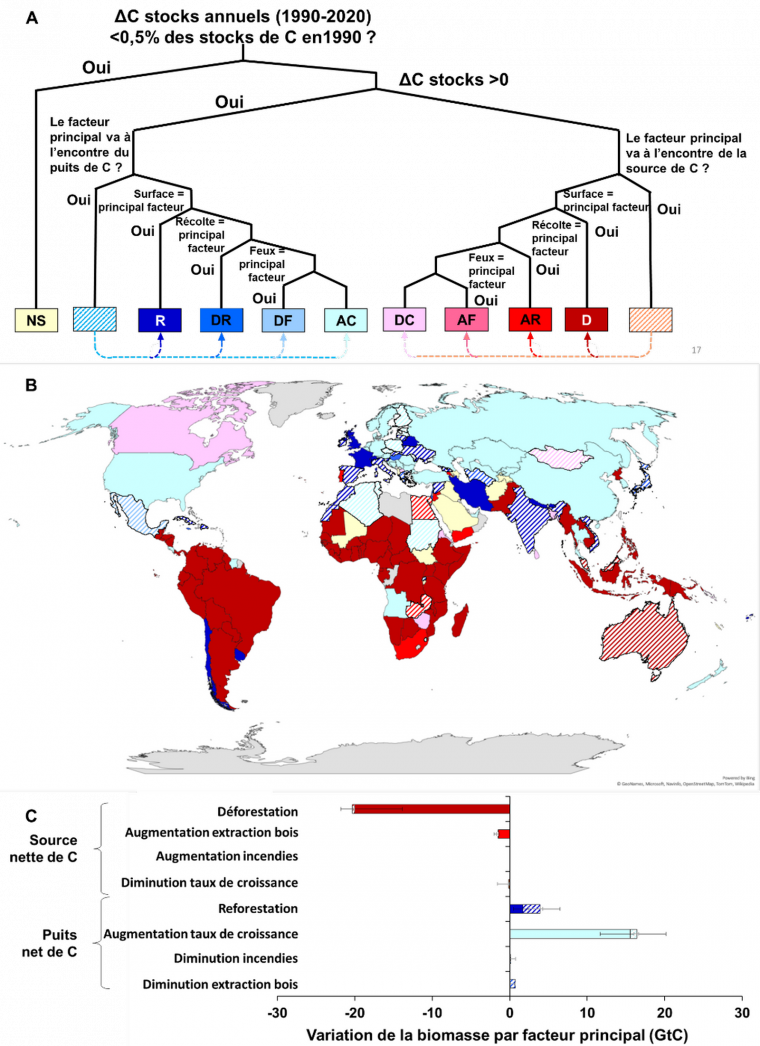
Grâce à notre modèle, nous avons pu déterminer l’importance relative de l’accélération de la croissance des forêts dans l’absorption de carbone atmosphérique par rapport à trois autres facteurs : les changements de surface forestière, les changements d’intensité de la récolte du bois et les changements de surfaces forestières affectées par des incendies. Nos résultats sont clairs : c’est bien l’accélération du rythme de croissance des forêts qui, durant la période 1990-2020, a partiellement compensé les émissions de carbone par les forêts mondiales, principalement causées par la déforestation dans les tropiques (Figure 2).
A. Pour chaque pays, les données de la FAO permettent de déterminer si la variation de son stock de carbone entre 1990 et 2020 est significative ou non (NS). Les pays peuvent présenter des variations de stock soit positives (cas des puits de carbone, couleurs bleues), soit négatives (cas des sources de carbone, couleurs rouges). Pour chaque pays, l’utilisation du modèle CRAFT pour établir des analyses contrefactuelles permet de déterminer la cause principale de la variation du stock de carbone. En bleu, les puits de carbone résultant principalement de R : la reforestation (expansion des surfaces de forêts) ; DR : la diminution de la récolte de bois ; DF : la diminution des feux de forêts ; AC : l’accélération de la croissance. En rouge, les sources de carbone résultant principalement de D : la déforestation ; AR : l’augmentation de la récolte de bois ; AF : l’augmentation des feux de forêts ; DC : la diminution de la croissance.
B. Prenons l’exemple d’un pays puits de carbone sur la période 1990-2020 : ce pays sera représenté en bleu sur la carte. Cependant, cela ne signifie pas pour autant que le principal mécanisme à l’origine de la variation du stock soit un processus captant du CO2. Dans ce cas, ce pays sera hachuré. Par exemple, l’Espagne est un puits de carbone, principalement grâce à l’expansion des surfaces de forêt : l’Espagne est donc représentée en bleu foncé. Néanmoins, cet effet puits de carbone aurait pu être bien plus important s’il n’avait pas été contrecarré par la diminution du taux de croissance. Le pays est donc hachuré. En effet, en Espagne, le puits net de carbone sur la période 1990-2020 a été principalement induit par une augmentation des surfaces de forêts (sans laquelle les stocks de carbone dans la biomasse forestière n’auraient atteint que 95 % de leur niveau réel en 2020 – données non montrées). Cependant l’analyse contrefactuelle révèle que l’effet de la diminution du taux de croissance en Espagne est un phénomène encore plus important pour expliquer la variation du stock de carbone observée puisqu’il a contribué à atténuer la force du puits (sans la diminution du taux de croissance des forêts, les stocks de carbone dans la biomasse forestière auraient atteint 123 % de leur valeur réelle en 2020 – données non montrées).
C. Somme des puits et des sources nettes de carbone pour chaque type de trajectoires identifiées grâce à la typologie boolénne (sous-figure A). Les barres d’erreur indiquent la gamme des puits et des sources de carbone estimée par cinq analyses de sensibilité.
Ce résultat est alarmant car cette accélération de la croissance est un effet des perturbations environnementales et climatiques mentionnées ci-dessus. Or, la pérennité de cet effet est très incertaine. D’autres études montrent ainsi que les effets du changement climatique sur la croissance des arbres pourraient s’inverser dans un futur très proche11–14. Notre étude insiste donc sur l’urgence à mettre en œuvre des stratégies plus sûres pour préserver le puits de carbone constitué par l’ensemble des forêts de la planète, à commencer par la fin de la déforestation et l’abaissement du niveau des récoltes de bois.
Notre modèle nous a également permis d’estimer que si la superficie des forêts n’avait pas été réduite entre 1990 et 2020, au lieu d’une émission de 0,74 GtC, il y aurait eu un puits de carbone de 26,9 GtC dans les forêts mondiales. Sans une augmentation de la récolte de bois depuis 1990, il y aurait eu un puits de 4,9 GtC, et dans l’hypothèse où il n’y aurait pas eu de récolte du tout, le puits aurait même été de 49,1 GtC. Seule l’augmentation du taux de croissance des forêts a permis de compenser partiellement les émissions de carbone depuis la biomasse forestière. Sans cette augmentation, les émissions cumulées auraient été de 7,4 GtC sur la période 1990-2020, soit dix fois plus que les émissions réelles.
Les forêts : des sources ou des puits de carbone ?
Les forêts agissent-elles comme des sources ou bien comme des puits de carbone ? Pour répondre à cette question, il est nécessaire de bien définir ce que l’on appelle « forêt ». Si l’on considère l’ensemble de l’écosystème forestier (biomasse vivante, bois mort, litière, sols), celui-ci agit bien comme un puits de carbone, piégeant environ 1,8 GtC/an. Par contre, si l’on s’en tient uniquement à la biomasse vivante, alors les forêts sont, sur la période 1990-2020, des sources de carbone responsables de l’émission de 0,74 GtC. Par ailleurs, et comme le montre notre étude, ces émissions sont causées par les activités humaines via la déforestation et la récolte du bois.
Références
1. Friedlingstein, P. et al. Climate–Carbon Cycle Feedback Analysis : Results from the C4MIP Model Intercomparison. J. Clim.19, 3337–3353 (2006).
2. Hubau, W. et al. Asynchronous carbon sink saturation in African and Amazonian tropical forests. Nature579, 80–87 (2020).
3. Rossi, S. et al. Critical temperatures for xylogenesis in conifers of cold climates. Glob. Ecol. Biogeogr.17, 696–707 (2008).
4. Tagesson, T. et al. Recent divergence in the contributions of tropical and boreal forests to the terrestrial carbon sink. Nat. Ecol. Evol.4, 202–209 (2020).
5. Zhu, Z. et al. Greening of the Earth and its drivers. Nat. Clim. Change6, 791–795 (2016).
6. Hickler, T. et al. CO 2 fertilization in temperate FACE experiments not representative of boreal and tropical forests : GEOGRAPHIC VARIATIONS IN CO 2 FERTILIZATION. Glob. Change Biol.14, 1531–1542 (2008).
7. Le Noë, J. et al. Altered growth conditions more than reforestation counteracted forest biomass carbon emissions 1990–2020. Nat. Commun.12, 6075 (2021).
8. Le Noë, J. et al. Modeling and empirical validation of long‐term carbon sequestration in forests (France, 1850–2015). Glob. Change Biol.26, 2421–2434 (2020).
9. Liski, J., Perruchoud, D. & Karjalainen, T. Increasing carbon stocks in the forest soils of western Europe. For. Ecol. Manag.169, 159–175 (2002).
10. Perruchoud, D., Joos, F., Fischlin, A., Hajdas, I. & Bonani, G. Evaluating timescales of carbon turnover in temperate forest soils with radiocarbon data. Glob. Biogeochem. Cycles13, 555–573 (1999).
11. Duffy, K. A. et al. How close are we to the temperature tipping point of the terrestrial biosphere ? Sci. Adv.7, eaay1052 (2021).
12. McDowell, N. G. et al. Pervasive shifts in forest dynamics in a changing world. Science368, eaaz9463 (2020).
13. Senf, C., Buras, A., Zang, C. S., Rammig, A. & Seidl, R. Excess forest mortality is consistently linked to drought across Europe. Nat. Commun.11, 6200 (2020).
14. Pugh, T. A. M. et al. Understanding the uncertainty in global forest carbon turnover. Biogeosciences17, 3961–3989 (2020).