Comment certaines cellules mésodermiques pluripotentes finissent-elles par former des myofibres fonctionnelles ? Cet article présente les événements cellulaires et moléculaires à l'origine de cette transformation.
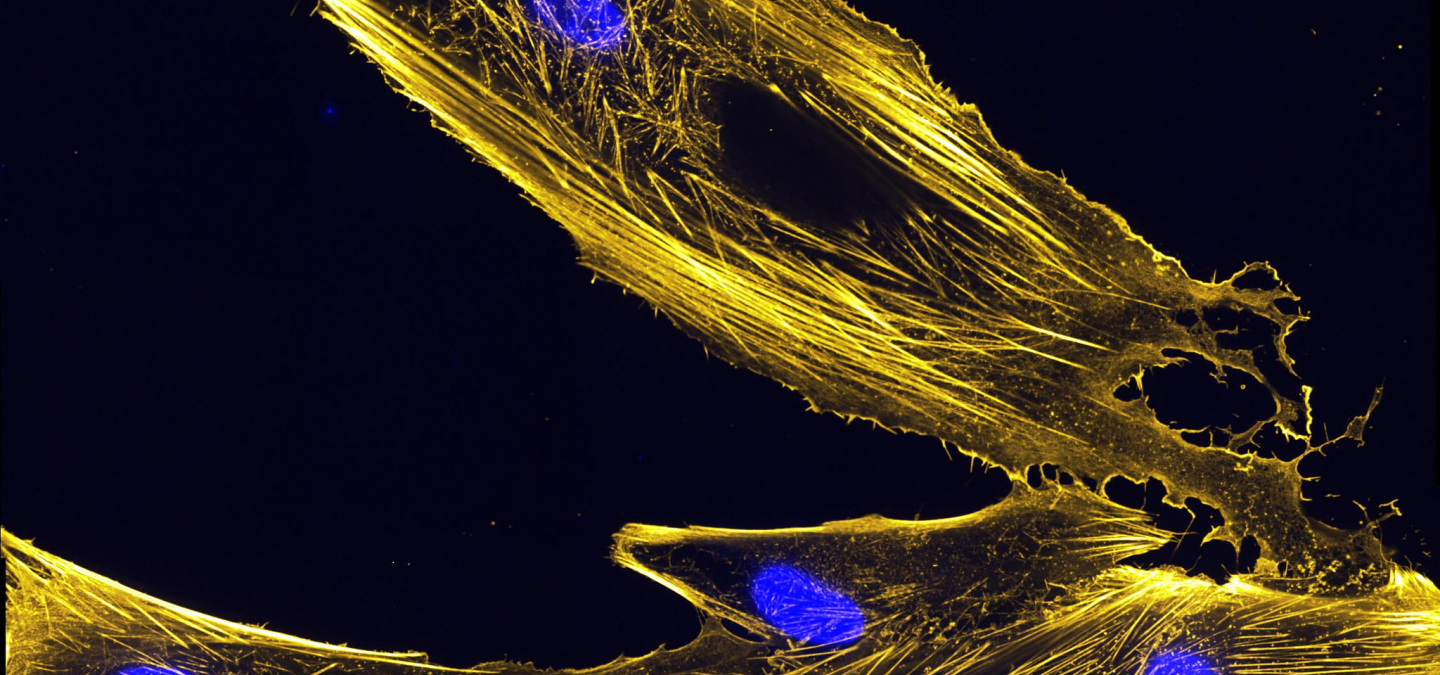
Les cellules musculaires squelettiques font partie des cellules les plus longues du corps humain et présentent la particularité de posséder plusieurs noyaux. Organisées en faisceaux et reliées aux os par les tendons, les cellules, ou fibres, musculaires sont indispensables à la locomotion, la ventilation et le maintien de la posture par leur action de contraction. Nous allons voir ici quels sont les changements structurels et génétiques nécessaires pour qu’une cellule myogénique mono-nucléée et proliférante atteigne l’état de fibre musculaire contractile (Figure 1).
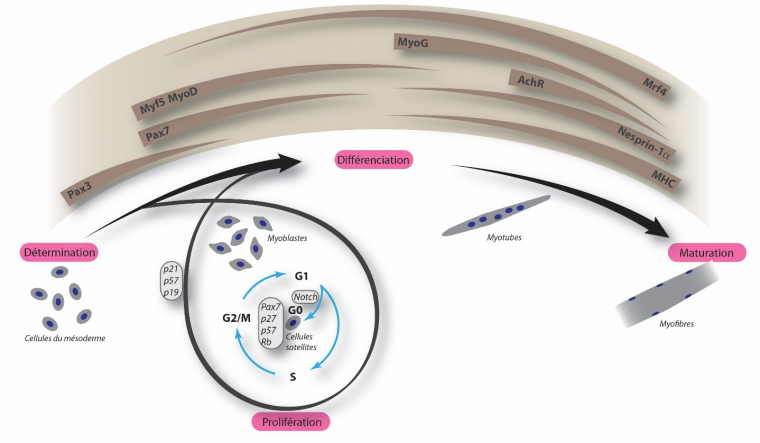
Évènements génétiques et cytologiques au cours de la formation des fibres musculaires. La durée et le niveau d’expression de gènes clés sont indiqués en marron. De la détermination des cellules du mésoderme à la maturation en myofibres, de nombreuses étapes sont nécessaires. L’expression de gènes clés, tels que Pax3, Myf5 et MyoD, est requise pour atteindre le stade de myoblaste. Les muscles ayant besoin de se régénérer au cours de la vie, une réserve de cellules souches musculaires est maintenue grâce au renouvellement des cellules satellites et l’expression de gènes clés, indiqués dans les petites cartouches. Les myoblastes et les cellules satellites constituent les cellules myogéniques. La différenciation et la maturation sont caractérisées par une expression, finement régulée dans le temps, d’autres gènes, tels que MyoG et MHC.
Détermination
Que ce soit in vivo ou in vitro, la différenciation musculaire est un processus complexe qui associe des modifications structurelles de la cellule et la modulation de l’expression de certains gènes. Au cours du développement, la première étape est la détermination des cellules du mésoderme en cellules myogéniques (myoblastes et cellules satellites), capables de former des muscles. Pour cela, l’expression et l’accumulation des facteurs de transcription MyoD et Myf5 seront décisifs [1]. Faisant partie des protéines bHLH (basic helix-loop-helix), ils sont caractéristiques des cellules myogéniques. Leur activation se fait grâce à un autre facteur de transcription, Pax3, normalement exprimé lors des premiers stades du développement embryonnaire par les cellules du mésoderme. L’absence de MyoD et Myf5 chez l’embryon de souris entraîne la mort à la naissance due à l’absence totale des muscles squelettiques. Ces deux gènes ont un double rôle : d’une part ils sont responsables de la propagation (c’est-à-dire de la prolifération et, potentiellement, de la migration) des cellules souches du muscle lors du développement et d’autre part ils permettent d’engager les cellules dans la différenciation terminale.
Prolifération
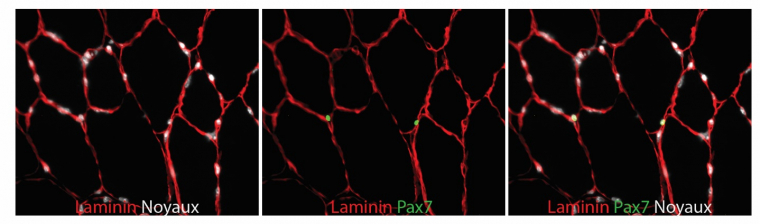
Au cours de la vie de l’organisme, les muscles subiront plusieurs cycles de régénération parce qu’ils doivent s’allonger, se renforcer, ou à la suite d’une blessure. Pour cela, une partie des cellules myogéniques issues du développement embryonnaire existe toujours chez l’adulte, sous la forme de cellules souches musculaires, capables de proliférer et de participer à la formation de fibres musculaires. Appelées cellules satellites, elles sont en temps normal à l’état quiescent et expriment le facteur de transcription Pax7. En l’absence de ce dernier, aucune cellule satellite ne sera présente. Celles-ci sont situées entre la lame basale et les fibres musculaires et le ratio est d’en moyenne une à deux cellules satellites pour une fibre musculaire (Figure 2). L’absence, la perte de fibres musculaires, ou des exercices musculaires prolongés et fréquents provoquent la sortie de quiescence des cellules satellites qui prolifèrent alors pour produire de nouvelles cellules musculaires. Cette transition est permise par une diminution de l’expression des gènes inhibiteurs du cycle cellulaire, tels p27, p57 et Rb [2,3] et une augmentation de l’expression des gènes activateurs [4], suivie par l’expression des gènes impliqués dans la différenciation comme MyoD ou Myf5 (Figure 1). Toutefois, il est nécessaire qu’une partie de ces cellules retourne à l’état quiescent pour être disponibles lorsqu’un besoin se représentera, et pour cela, p27 sera décisif ainsi que la voie moléculaire de Notch [5,6]. Une perturbation de ces deux régulateurs a pour conséquence le non-réapprovisionnement en cellules souches musculaires, et l’impossibilité de régénérer le muscle plusieurs fois. Lors du vieillissement par exemple, la quantité de cellules satellites diminue.
Sur cette coupe, seules deux cellules satellites marquées par Pax7 sont visibles sous la lame basale de deux fibres différentes.
Différenciation
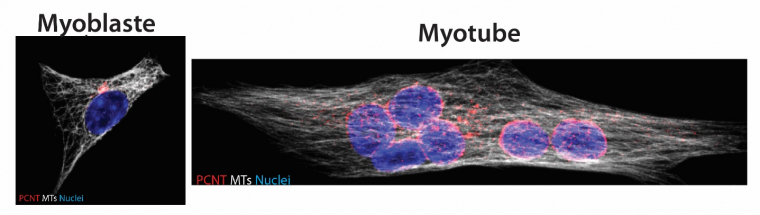
La première étape de la différenciation des cellules satellites, irréversible chez la plupart des organismes, est la sortie du cycle cellulaire due à l’expression concertée de p21, p57 et p19. In vitro, sur des cellules myogéniques en culture, la privation de sérum et une densité élevée des cellules (confluence) suffit à initier la différenciation. Des protéines caractéristiques sont alors exprimées, telles que la myogénine, ou la chaîne lourde de la myosine (MHC, myosin heavy chain). Les cellules vont réorganiser leur cytosquelette pour se préparer aux étapes suivantes : les filaments d’actine vont se placer parallèlement les uns par rapport aux autres tandis que les microtubules, qui normalement émanent du centrosome, vont maintenant avoir pour origine l’enveloppe nucléaire [7] (Figure 3). Cette relocalisation est causée par l’expression de l’isoforme α de la nesprine-1, qui ancrera certaines protéines du centrosome à l’enveloppe nucléaire, telle qu’Akap-450 [8]. Les cellules vont alors changer de forme et adopter une forme allongée.
Par la suite, plusieurs myoblastes vont fusionner pour former un myotube. La fusion des myoblastes est un processus complexe qui implique le remodelage des membranes plasmiques et l’action du cytosquelette d’actine. Récemment ont été découvertes deux protéines qui avaient échappées à l’étude informatique du génome en raison de leur taille inférieure à 100 acides aminés, Myomixer et Myomaker [9]. Exprimées au cours du développement et dans les premières étapes de la différenciation, leur absence empêche la fusion des cellules myogéniques tandis que leur expression dans des cellules non-myogéniques induit leur fusion, probablement en facilitant la fusion des membranes.
Relocalisation du centrosome (visualisé par la fluorescence rouge de la péricentrine, PCNT, une protéine du centrosome) à l’enveloppe nucléaire et réorganisation des microtubules (MTs) lors de la différenciation. Dans le myoblaste, les microtubules émanent du centrosome de manière radiale, tandis qu’ils ont une organisation majoritairement parallèle dans le myotube. Les noyaux apparaissent bleus.
La membrane plasmique des fibres musculaires, également appelée sarcolemme, présente des invaginations appelées tubules T qui entrent en contact avec le réticulum sarcoplasmique de la cellule pour former des structures appelées triades.
Maturation
Une caractéristique des fibres musculaires est la présence d’invaginations de la membrane plasmique autour des myofibrilles. Ces invaginations appelées tubules T sont nécessaires à la transmission du signal provenant du neurone sur toute la longueur de la fibre. Elles se forment lors de la maturation de la fibre grâce à l’action de protéines normalement impliquées dans l’endocytose, et du cytosquelette d’actine. Ces tubules T sont connectés par des canaux à calcium au réticulum sarcoplasmique situé à l’intérieur de la cellule. Chaque tubule T est pris en sandwich par deux structures de réticulum formant ainsi une triade.
Le relargage des neurotransmetteurs à la jonction neuromusculaire entraîne une dépolarisation de la membrane plasmique de la fibre, et une ouverture des canaux calciques du réticulum. Le calcium ainsi libéré va s’associer à la protéine troponine, provoquant son changement de conformation et permettant ainsi la contraction des myofibrilles (Figure 4). La présence des triades permet ainsi d’avoir une contraction homogène sur toute la longueur de la fibre musculaire. Des défauts dans la structure des triades entraînent des problèmes de contraction musculaire. Celle-ci est assurée par les sarcomères, des structures répétées composées principalement d’actine et de filaments de myosine. Ces derniers, sous l’effet de la présence de calcium et de l’hydrolyse d’ATP, vont glisser le long des filaments d’actine et ainsi réduire la longueur de chaque sarcomère (Figure 5).
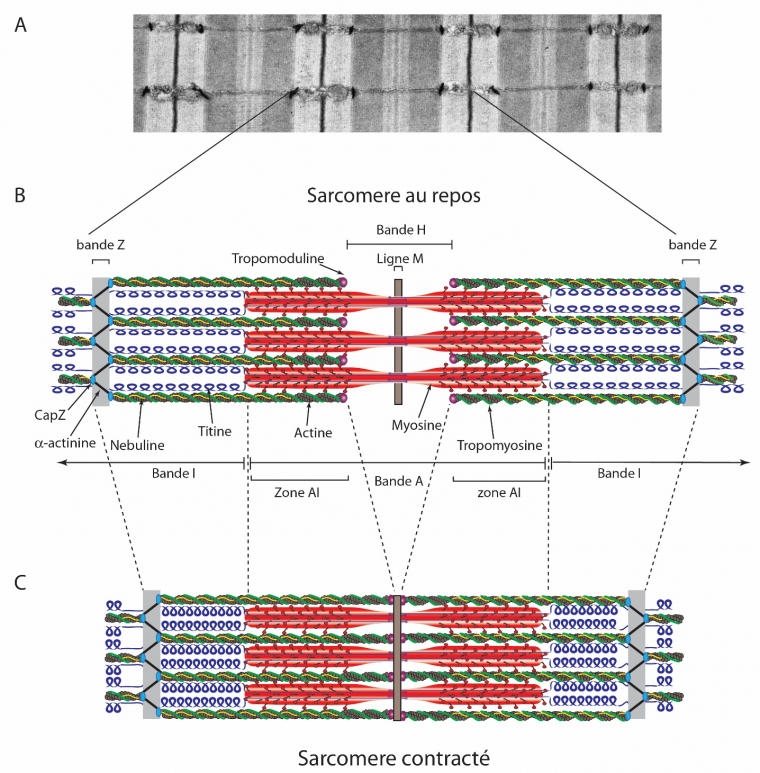
A : Section fine d’un muscle de souris observé au microscope électronique à transmission. B, C : Les sarcomères sont des répétitions de structures composées principalement d’actine (en gris) et de myosine (en rouge). La nébuline (en jaune) s’étend le long des filaments d’actine, tandis que la titine (en bleu) s’étire entre la bande Z et la ligne M. L’alpha-actinine et CapZ sont des composants de la bande Z. La tropomyosine (en vert) s’étend le long des filaments d’actine jusqu'à la tropomoduline (violet). Dans un sarcomère contracté, la longueur des filaments d’actine et de myosine ne varie pas. La contraction s’opère par un glissement des filaments d’actine sur les filaments de myosine.
Source de l’électronographie : Cell image library (CIL :10817) ; licence de l’électronographie : CC-BY-NC-ND
Source du schéma : Cadot B, Gomes ER. Skeletal muscle. Encyclopedia of Cell Biology (Elsevier). 2016, Pages 677–682 ; licence : reproduit avec autorisation
Mouvements nucléaires
La fusion de plusieurs myoblastes donne un myotube qui contient donc plusieurs noyaux. Dans la fibre mature, la majorité des noyaux sont placés de manière équidistante sous la membrane plasmique. Étant donné la taille de la cellule musculaire, cela implique que des mouvements nucléaires contrôlés aient lieu lors de la maturation. Ces mouvements successifs ont été identifiés et sont de quatre types : la centration, le déploiement, la dispersion et le regroupement [10] (Figure 6).
La centration a lieu lorsqu’un myoblaste fusionne avec un myotube ; le noyau du myoblaste va alors rapidement (0,75 µm/min) se déplacer vers le centre du myotube où se trouvent les autres noyaux. Ce mouvement est possible grâce à l’interaction des microtubules émanant des noyaux du myotube avec la dynéine, moteur moléculaire situé sur l’enveloppe nucléaire du noyau de myoblaste [11].
Le déploiement consiste en la répartition des nombreux noyaux sur la longueur du myotube. Pour cela, les microtubules émanant de l’enveloppe des noyaux interagissent entre eux par l’intermédiaire d’un autre moteur moléculaire, la kinésine 1, et d’une protéine associée à ceux-ci. En créant des ponts entre ces microtubules, les noyaux vont être repoussés les uns des autres et se répartir dans le myotube [12].
La dispersion, quant à elle, caractérise le mouvement des noyaux vers la périphérie des cellules musculaires. Ce mouvement transversal a lieu lors de la maturation en fibre musculaire, lorsque s’organisent les myofibrilles. En effet, sous l’effet de contraction de ces dernières, les noyaux vont être expulsés vers la membrane plasmique [13]. Ces derniers auront encore la possibilité de se déplacer longitudinalement en utilisant le mécanisme de déploiement mais ne pourront plus rejoindre le centre de la fibre, maintenant occupée par les myofibrilles.
Enfin, le regroupement permet à un petit groupe de noyaux de se retrouver sous la jonction neuro-musculaire. Ce mouvement n’a pas encore été caractérisé mais utilise probablement les mêmes mécanismes que le déploiement. Il a été proposé que cette répartition homogène des noyaux dans la fibre musculaire permet une distribution optimale des ARN messagers et des protéines exprimés par chaque noyau [14,15]. Le terme de domaine nucléaire, ou zone d’influence d’un noyau, a émergé en 1989 mais son rôle exact dans la fonction musculaire reste encore à définir. Toutefois, certains noyaux, tels ceux situés sous la jonction neuromusculaire ou ceux situés à la jonction myotendineuse (entre le muscle et le tendon), expriment des gènes que les autres noyaux n’expriment pas, supportant ainsi le concept de domaine nucléaire [16–18].
Lors de la centration, le noyau (violet) du myoblaste migre rapidement vers le centre du myotube (0,76 µm/min). Les nombreux noyaux sont ensuite répartis le long du myotube lors de la phase de déploiement (0,2 µm/min). La dispersion placera les noyaux en périphérie des fibres musculaires (0,04 µm/min) tandis que le regroupement positionnera quelques noyaux sous la jonction neuromusculaire.
Références
- Rudnicki MA, Schnegelsberg PNJ, Stead RH, Braun T, Arnold H-H, Jaenisch R. MyoD or Myf-5 is required for the formation of skeletal muscle. Cell 1993; 75:1351–9.
- Chakkalakal JV, Christensen J, Xiang W, Tierney MT, Boscolo FS, Sacco A, Brack AS. Early forming label-retaining muscle stem cells require p27kip1 for maintenance of the primitive state. Development 2014; 141:1649–59.
- Hosoyama T, Nishijo K, Prajapati SI, Li G, Keller C. Rb1 gene inactivation expands satellite cell and postnatal myoblast pools. J Biol Chem 2011; 286:19556–64.
- Fukada S, Uezumi A, Ikemoto M, Masuda S, Segawa M, Tanimura N, Yamamoto H, Miyagoe-Suzuki Y, Takeda S. Molecular Signature of Quiescent Satellite Cells in Adult Skeletal Muscle. STEM CELLS 2007; 25:2448–59.
- Kuang S, Kuroda K, Le Grand F, Rudnicki MA. Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell 2007; 129:999–1010.
- Wen Y, Bi P, Liu W, Asakura A, Keller C, Kuang S. Constitutive Notch Activation Upregulates Pax7 and Promotes the Self-Renewal of Skeletal Muscle Satellite Cells. Mol Cell Biol 2012; 32:2300–11.
- Tassin AM, Maro B, Bornens M. Fate of microtubule-organizing centers during myogenesis in vitro. J Cell Biol 1985; 100:35–46.
- Gimpel P, Lee YL, Sobota RM, Calvi A, Koullourou V, Patel R, Mamchaoui K, Nédélec F, Shackleton S, Schmoranzer J, et al. Nesprin-1α-Dependent Microtubule Nucleation from the Nuclear Envelope via Akap450 Is Necessary for Nuclear Positioning in Muscle Cells. Current Biology 2017; 27:2999-3009.e9.
- Bi P, Ramirez-Martinez A, Li H, Cannavino J, McAnally JR, Shelton JM, Sánchez-Ortiz E, Bassel-Duby R, Olson EN. Control of muscle formation by the fusogenic micropeptide myomixer. Science 2017; 356:323–7.
- Cadot B, Gache V, Gomes ER. Moving and positioning the nucleus in skeletal muscle – one step at a time. Nucleus 2015; 6:373–81.
- Cadot B, Gache V, Vasyutina E, Falcone S, Birchmeier C, Gomes ER. Nuclear movement during myotube formation is microtubule and dynein dependent and is regulated by Cdc42, Par6 and Par3. EMBO reports 2012; 13:741–9.
- Metzger T, Gache V, Xu M, Cadot B, Folker ES, Richardson BE, Gomes ER, Baylies MK. MAP and kinesin-dependent nuclear positioning is required for skeletal muscle function. Nature 2012; 484:120–4.
- Roman W, Martins JP, Carvalho FA, Voituriez R, Abella JVG, Santos NC, Cadot B, Way M, Gomes ER. Myofibril contraction and crosslinking drive nuclear movement to the periphery of skeletal muscle. Nature Cell Biology 2017; 19:1189–201.
- Pavlath GK, Rich K, Webster SG, Blau HM. Localization of muscle gene products in nuclear domains. Nature 1989; 337:570–3.
- Ralston E, Hall ZW. Transfer of a protein encoded by a single nucleus to nearby nuclei in multinucleated myotubes. Science 1989; 244:1066–9.
- Fischbach GD, Cohen SA. The distribution of acetylcholine sensitivity over uninnervated and innervated muscle fibers grown in cell culture. Developmental biology 1973; 31:147–162.
- Merlie JP, Sanes JR. Concentration of acetylcholine receptor mRNA in synaptic regions of adult muscle fibres. Nature 1985; 317:66–8.
- Dix DJ, Eisenberg BR. Myosin mRNA accumulation and myofibrillogenesis at the myotendinous junction of stretched muscle fibers. J Cell Biol 1990; 111:1885–94.