Les cellules de l'épididyme libèrent des exosomes, de petites vésicules extracellulaires contenant diverses molécules, dont des microARN. Ces exosomes sont internalisés par les spermatozoïdes qui reçoivent ainsi les microARN issus des cellules de l'épididyme et les transmettent à la cellule-œuf. Les microARN ainsi transmis au zygote influencent l'expression des gènes de l'embryon.
Ce texte a été initialement publié à cette adresse le 9 novembre 2024 sur Actualités scientifiques Prépas, le blog d'actualités de Patrick Pla, maître de conférences à l'université Paris Saclay. La version proposée ici a été adaptée pour Planet-Vie.
Depuis des décennies, nous savons que les spermatozoïdes apportent principalement du matériel génétique à la descendance. Depuis quelques années, nous savons qu’ils apportent également leur centriole qui prend le contrôle des microtubules ovocytaires ainsi que des protéines de signalisation telles que la phospholipase C zêta (PLCζ) qui induit une cascade aboutissant à l’activation de l’ovocyte. Des recherches encore plus récentes ont révélé que de petits ARN non codants, comme les ARN de transfert (ARNt), les ARN interagissants avec Piwi (ARNpi) et les microARN (miARN) contribuent également à l’hérédité paternelle 1. Les microARN sont des petits ARN (22 nucléotides en général) non traduits qui sont capables de bloquer la traduction d’un ARNm en se fixant sur une séquence cible, située généralement à l’extrémité 3’ non traduite (3’UTR). Des études ont montré que le stress, l’alimentation ou encore l’environnement d’une souris mâle peuvent modifier la composition en miARN de ses spermatozoïdes. Cela, à son tour, peut affecter le phénotype de la descendance. Même en l’absence de facteurs de stress externes, les miARN spermatiques jouent un rôle crucial dans la régulation de l’expression génétique au cours des premiers stades du développement embryonnaire.
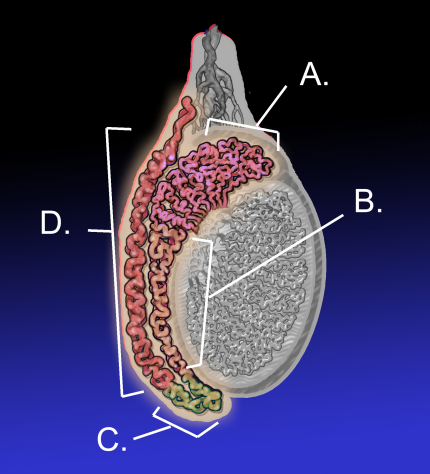
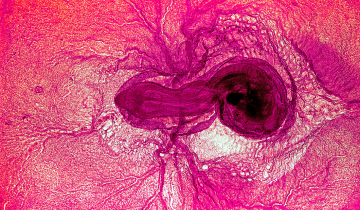
L’épididyme joue un rôle essentiel dans la maturation des spermatozoïdes des mammifères. Ils y passent 5 à 10 jours selon les espèces considérées. A : tête de l’épididyme, B : corps de l’épididyme, C : queue de l’épididyme, D : canal déférent.
Des chercheurs américains ont publié récemment un article dans Cell Reports montrant qu’au moment de leur passage dans l’épididyme (Figure 1), les spermatozoïdes acquièrent un sous-ensemble de miARN essentiels 1. Les auteurs ont bien prouvé que ces miARN n’étaient pas produits par les spermatozoïdes eux-mêmes (il n’y a plus de transcription dans leur noyau à ce stade), mais par l’épithélium de l’épididyme et qu’ils étaient ensuite transférés aux spermatozoïdes. Pour le démontrer, ils ont inactivé le gène DGCR8, nécessaire à la maturation des miARN. Grâce au système de knock-out conditionnel Cre-Lox, cette inactivation a été réalisée soit dans les cellules germinales (donc les spermatozoïdes) soit dans les cellules de l’épithélium de l’épididyme. Les chercheurs ont ainsi pu faire la part entre les miARN produits par les spermatozoïdes eux-mêmes à des stades plus précoces de leur développement dans les tubes séminifères et les miARN produits par les cellules de l’épididyme. Beaucoup des miARN sont produits par les deux sources mais certains sont produits seulement par l’une ou l’autre. Dans le premier cas, les miARN produits dans l’épididyme permettent un ajustement quantitatif.
Le mécanisme de transfert d’une cellule à l’autre implique très probablement des exosomes, de petites vésicules extracellulaires mesurant entre environ 30 et 150 nm de diamètre. Ces exosomes, appelés épididymosomes, sont secrétés spécifiquement par les cellules épithéliales de l’épididyme et récupérés par les spermatozoïdes. On sait par l’étude d’autres systèmes cellulaires que des exosomes sont capables de transporter des miARN d’une cellule à l’autre. Les chercheurs démontrent dans l’article que le profil des miARN des spermatozoïdes ayant traversé un épididyme déficient en miARN peut être restauré par une exposition à des exosomes produits par un épididyme normal.
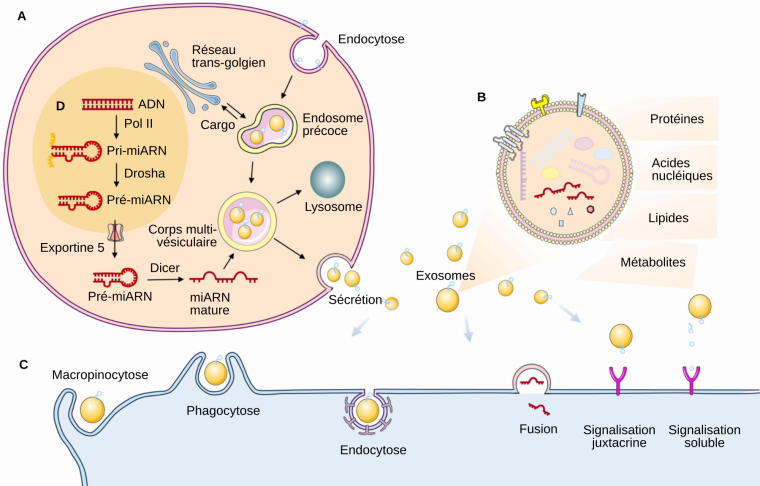
A. Biogenèse des exosomes. Les exosomes sont issus de la voie endocytique qui commence par la formation de l’endosome précoce par endocytose au niveau de la membrane plasmique. Les vésicules contenues dans les corps multivésiculaires formés à partir des endosomes peuvent soit être dégradées dans les lysosomes ou sécrétées sous forme d’exosomes.
B. Composition des exosomes. Les exosomes peuvent contenir différents types de molécules dans leur lumière : acides nucléiques, protéines, lipides et métabolites. Différents types de protéines peuvent également être enchâssées dans leur membrane.
C. Internalisation des exosomes. Les exosomes peuvent être internalisés par différents mécanismes, ce qui permet à leur contenu d’arriver dans une autre cellule et d’y déclencher potentiellement différents effets. Par exemple, les microARN libérés des exosomes peuvent empêcher la traduction de leurs ARNm cibles.
D. Synthèse des microARN dans la cellule émettant les exosomes.
Les miARN ajoutés par l’épididyme ont une influence sur le début du développement embryonnaire. En absence de ces miARN, 49 et 213 gènes voient leur expression modifiée dans des embryons respectivement au stade 4 cellules et au stade morula. L’expression d’une majorité de ces gènes peut être rétablie à la normale si on injecte directement les miARN manquants extraits des exosomes épididymaires dans les embryons. Les chercheurs n’ont pas étudié de manière plus approfondie les conséquences des dérégulations génétiques en absence des miARN épididymaires. Pour le moment, ils ont simplement montré que les embryons ont l’air « normaux » aux stades 4 cellules et morula.
Deux miARN parmi les 27 qui sont acquis dans l’épididyme et identifiés dans cette étude, miR-883 et miR-34c, présentent une altération significative de leur expression en cas de stress ou de régime alimentaire modifié. Ainsi, les miARN épididymaires participent très vraisemblablement aux mécanismes épigénétiques qui contrôlent, dans certaines conditions, la transmission de caractères acquis à la descendance.