Cet article présente les mécanismes à l’œuvre dans la mise en place de l’appareil génital, et notamment des gonades, lors du développement embryonnaire de l’être humain.
Il s'intéresse particulièrement au contrôle génétique du développement de cet appareil.
Introduction
L’appareil génital se met en place lors du développement embryonnaire. Ce phénomène est sous le contrôle de plusieurs gènes et hormones, en relation avec les chromosomes sexuels présents. Le début de ce développement est commun aux deux sexes. Les différentes étapes de ce développement permettent d’aboutir à un appareil génital différencié, masculin ou féminin.
Bases génétiques de la détermination du sexe
Premières hypothèses
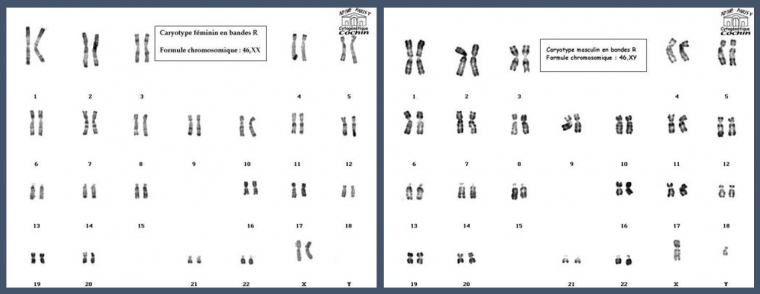
A gauche le caryotype d'une femme, présentant deux chromosomes X, et à droite le caryotype d'un homme, présentant un chromosome X et un Y.
Les cellules du corps humain contiennent, dans leur noyau, 23 paires de chromosomes, portant les gènes. Ce bagage génétique provient de la mère (23 chromosomes) et du père (23 chromosomes). La 23e paire est différente selon le sexe : les femmes héritent d’un chromosome X de chaque parent ; tandis que les hommes héritent d’un chromosome Y provenant de leur père et d’un chromosome X venant de leur mère. Les femmes sont donc XX et les hommes XY.
Or, on sait que chez certaines espèces animales (la drosophile, par exemple), le sexe est déterminé par le nombre de chromosomes X (plus précisément, par le rapport entre le nombre de chromosomes X et le nombre d’autosomes). Il est alors possible de supposer un tel mode de contrôle génétique du sexe : le nombre de chromosomes X déterminerait le sexe.
Toutefois, cette première hypothèse est contredite par l’observation d’anomalies chromosomiques touchant les chromosomes sexuels : les anomalies hétérosomales.
Les anomalies hétérosomales
On peut observer, chez certains rares individus de l’espèce humaine, des anomalies dans le nombre de chromosomes sexuels. Selon les cas, ces anomalies conduisent à des individus présentant un phénotype mâle, ou un phénotype femelle :
| Phénotype femelle | Phénotype mâle | |
| Stériles |
X0 : Absence d’un chromosome X. Le syndrome de Turner touche environ une naissance sur 2500 avec un avortement précoce dans 99 % des cas. |
Y0 : Absence du chromosome Y. Cette anomalie est létale. |
| Fertiles |
XXX : Présence d’un chromosome X surnuméraire. Fréquence de 1/500 naissances. Sujet normal. |
XXX : Présence d’un chromosome X surnuméraire. Fréquences de 1/500 naissances. Sujet normal. |
Ces observations montrent que le sexe phénotypique de l’individu ne semble pas lié au nombre de X mais plutôt à la présence ou l’absence du Y. La règle, chez l’Homme, est donc :
-
absence de Y : phénotype féminin ;
-
présence de Y : phénotype masculin.
Le chromosome Y a un rôle fondamental dans la détermination du sexe dans l’espèce humaine. On peut alors chercher à préciser les éléments génétiques portés par ce chromosome qui déterminent ce phénotype sexuel masculin.
Les inversions sexuelles
On observe parfois, dans l’espèce humaine, la naissance d’individus dont le phénotype sexuel (basé, à la naissance, sur l’observation des organes génitaux externes et, plus tard, sur celle des caractères sexuels secondaires) ne correspond pas aux chromosomes sexuels observables dans leurs caryotypes, ce sont des cas « d’inversion sexuelle ».
-
XX : mâle XX stérile ; fréquence 1/20 000 naissances ;
-
XY : femelle XY stérile ; fréquence 1/10 000 naissances.
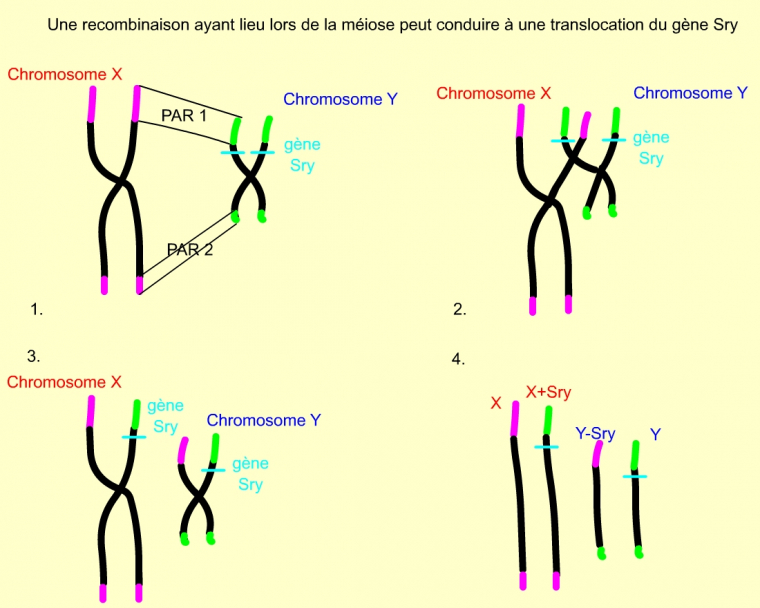
On explique ce phénomène par des évènements de mutation ou de translocation. En effet, les chromosomes X et Y présentent, aux extrémités de leur bras, des régions homologues : régions pseudo-autosomiques PAR 1 sur le bras court et PAR 2 sur le bras long. Les inversions sexuelles proviendraient donc, en fait, d’une translocation d’un facteur au niveau de la région PAR 1, lors de la méiose, par crossing-over entre les chromosomes X et Y. Ce facteur a été nommé « facteur de détermination testiculaire » (TDF/ Testis Determining Factor) et localisé juste en dessous de PAR1.
1 : Les chromosomes X et Y possèdent deux courtes régions identiques (régions pseudo-autosomales PAR 1 et PAR 2), représentées en vert (chromosome Y) et en mauve (chromosome X) sur ce schéma. Le gène SRY est situé à proximité de la région PAR 1 du chromosome Y.
2 : Evènement de crossing-over entre X et Y, lors de la prophase I de méiose chez l’homme, permis par l’appariement des régions PAR 1 et PAR 2.
3 : Chromosomes sexuels obtenus suite au crossing-over. La suite de la méiose permet la séparation des chromatides.
4 : Les quatre chromatides obtenues suite à la méiose. Chaque gamète formé hérite d’une de ces chromatides.
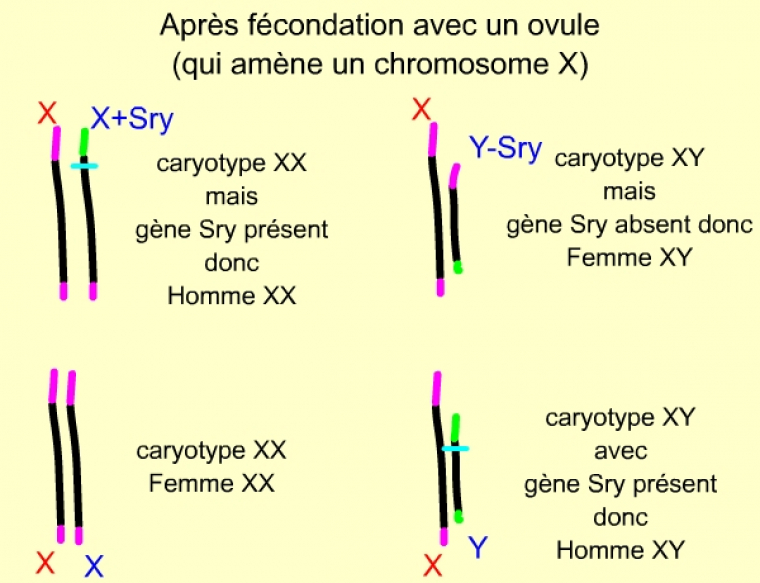
La fécondation avec un ovule (qui amène un chromosome X) aboutit à 4 zygotes diploïdes, de génotypes différents. La présence de SRY conduit à un phénotype masculin, quel que soit le caryotype : XX ou XY.
Par la suite, il a été possible de démontrer que le TDF était en réalité un seul gène, appelé SRY (Sex-determining Region of Y chromosome). Ce gène s’exprime lors du développement sexuel des gonades chez l’homme. Dans les cas de translocation, il serait donc absent sur le chromosome Y et présent sur le chromosome X. De même, des mutations dans le gène SRY (le rendant non fonctionnel) conduisent à l’obtention d’individus XY de phénotype féminin.
Le gène SRY et son domaine HMG
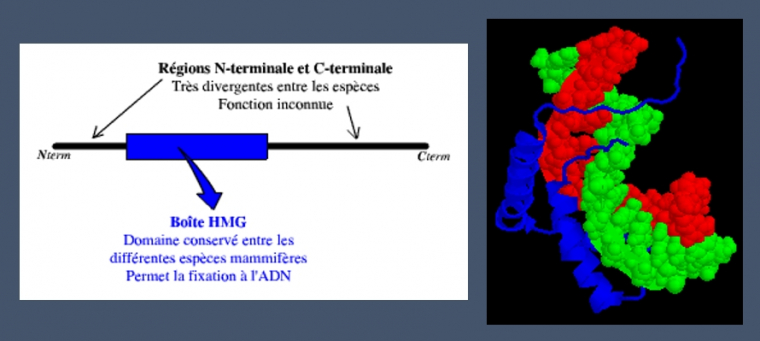
La détermination du sexe gonadique dépend donc de la présence du gène SRY. Chez les individus de sexe masculin, la protéine issue de l’expression du gène SRY agirait en déclenchant une cascade d’autres gènes. La protéine SRY possède un domaine HMG (High Mobility Group), permettant à cette protéine de se fixer sur l’ADN.
La protéine SRY est composée de 204 acides aminés. Sa fixation sur l’ADN bicaténaire induit une courbure de celui-ci de 70° à 80° :
A gauche : schéma des domaines de la protéine SRY
A droite : modélisation 3D de la fixation de la protéine SRY (en bleu) à l'ADN (brins rouge et vert)
Cette courbure de l’ADN, suite à la fixation de SRY, aurait pour conséquence de permettre le rapprochement et l’interaction des facteurs de transcription contrôlant la différenciation des gonades. Ceci permettrait donc de déclencher l’expression de gènes menant à la formation du testicule, et des autres structures génitales masculines.
Le gène SRY est retrouvé chez tous les Mammifères (placentaires et marsupiaux), où il semble toujours jouer ce rôle de déterminant masculin.
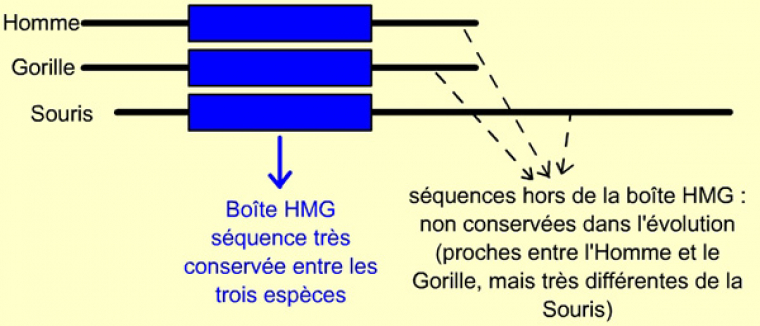
Malgré les nombreuses différences entre les trois séquences de l’homme, du gorille et de la souris, une partie du gène SRY présente une forte homologie entre les trois espèces. Elle correspond en fait à la séquence de la boîte HMG. Même s’il est plus ou moins long, tous les Mammifères possèdent ce gène SRY.
Différenciation morphologique de l’appareil génital
Bien que le sexe de l’embryon soit déterminé par la présence des chromosomes X et Y dès la fécondation, la gonade embryonnaire des Mammifères présente d’abord un stade indifférencié durant lequel elle ne possède aucun caractère mâle ni femelle. La différenciation se réalise dans un second temps.
Première étape : formation d’une ébauche de gonade indifférenciée
Crête génitale et cellules germinales
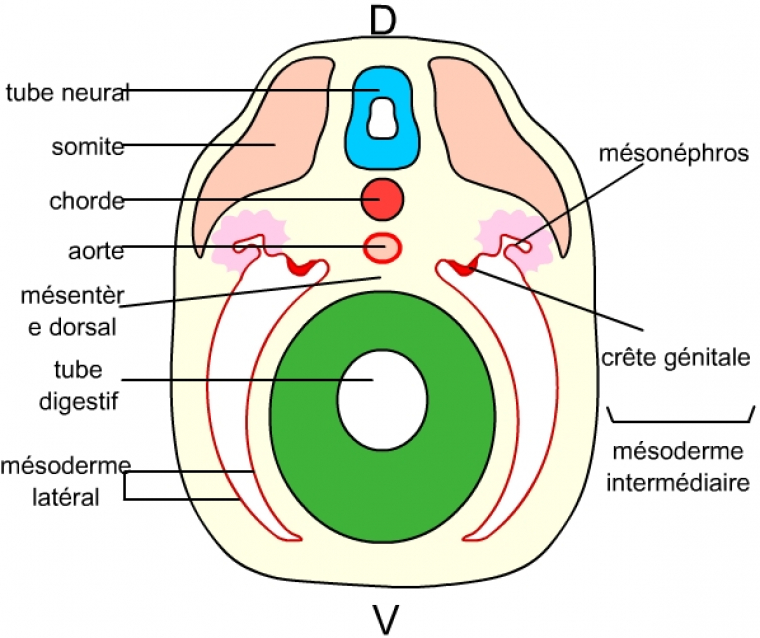
Au début de l’organogenèse, on observe la formation d’une crête génitale (voir figure ci-dessous) qui est ensuite colonisée par les cellules germinales. La crête génitale est issue (de même que les reins) du mésoderme intermédiaire, situé entre le mésoderme latéral et les somites.
Le mésoderme intermédiaire se forme entre les somites et le mésoderme latéral. Il comporte les crêtes génitales (futures gonades), et les tissus néphrotiques (mésonéphros, au niveau de ces crêtes génitales, qui donnera les conduits génitaux), ou encore métanéphros plus postérieurement (qui donnera les reins chez les Mammifères, non visible sur schéma).
D : face dorsale
V : face ventrale.
Chez les Mammifères les cellules germinales proviennent, quant à elles, d’une région mésodermique extracellulaire.
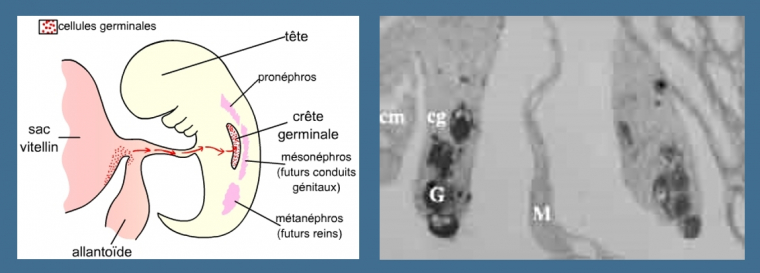
A gauche: Les cellules germinales migrent, chez tous les Vertébrés, pour aller coloniser la crête génitale. Chez les Mammifères, ces cellules sont originaires du mésoderme extra-embryonnaire. Elles accomplissent leur migration en passant par l’allantoïde.
A droite: Il est possible de marquer les cellules germinales, ce qui permet de suivre leur devenir dans l’embryon. Sur cette coupe d'embryon d'amphibien, on peut observer la présence de cellules germinales marquées dans la crête génitale. On observerait des images très semblables chez un Mammifère car c'est surtout le moment de la migration qui diffère entre Amphibiens et Mammifères : au cours du développement embryonnaire chez les Mammifères, au cours de la métamorphose chez les Amphibiens.
M : mésentère dorsal, G : cellules germinales, cg : crête génitale, cm : blastème (crête) mésonéphrotique
Photo : M. Delarue, Biologie et Multimédia
Développement de la crête génitale
L’ébauche de la gonade peut, au cours de son développement, se développer soit en ovaire soit en testicule, selon ses déterminants génétiques. Elle apparaît, chez l’Homme, dans le mésoderme intermédiaire pendant la quatrième semaine de développement, et se développe d’abord de la même manière chez les deux sexes jusqu’à la septième semaine (voir figure ci-dessous).
L’épithélium de la crête génitale se développe dans le tissu conjonctif ; il se forme alors des cordons sexuels primitifs qui s’entourent de cellules germinales. Ces cordons sexuels vont proliférer jusqu’à la huitième semaine dans le tissu conjonctif.
Deuxième étape : formation d’une gonade
Formation d’une gonade mâle
On observe, dans chacune des crêtes génitales des fœtus XY, la formation de deux types de cordons : les cordons testiculaires contenant les cellules germinales qui produiront les futurs spermatozoïdes ; et les cordons du rete testis, à l’extrémité des cordons testiculaires. Le canal de Wolff est relié aux cordons du rete testis par des restes de tubules mésonéphrotiques et se différencie en canal déférent qui permettra la sortie des spermatozoïdes.
Au cours de ce développement, les cellules des cordons testiculaires, autres que les cellules germinales, vont se différencier en cellules de Sertoli (nutrition des spermatozoïdes et sécrétion de l’hormone anti-Müllerienne qui favorise la dégénérescence du canal de Müller) et les cellules du mésenchyme interstitiel des testicules vont devenir les cellules de Leydig (production de la testostérone qui favorise le maintien du canal de Wolff).
Pendant la puberté, il y aura formation des tubes séminifères par creusement des cordons testiculaires, et les cellules germinales qui s’y trouvent produiront des spermatozoïdes.
Formation d’une gonade femelle
Chez les fœtus femelles XX, les cordons sexuels primitifs dégénèrent. L’épithélium de surface des crêtes génitales produit de nouveaux cordons qui ne pénètrent pas dans le tissu conjonctif mais restent en contact avec la surface corticale de la crête. Ces nouveaux cordons forment des amas cellulaires composés, chacun, de cellules d’origine somatiques (future granulosa) entourant une cellule germinale (futurs ovocytes). Les cellules des thèques (cellules périphériques et protectrices) se différencient ensuite autour de chaque ensemble (granulosa + cellule germinale), pour former les follicules. Ces follicules secrètent des hormones stéroïdes. La formation d’un follicule n’est possible que s’il entoure une cellule germinale, en l’absence il dégénère.
Pour les individus XX, on observe une dégénérescence du canal de Wolff, due à l’absence de testostérone et le canal de Müller se développe pour former l’appareil génital femelle (l’oviducte, l’utérus, le canal cervical et le vagin supérieur).
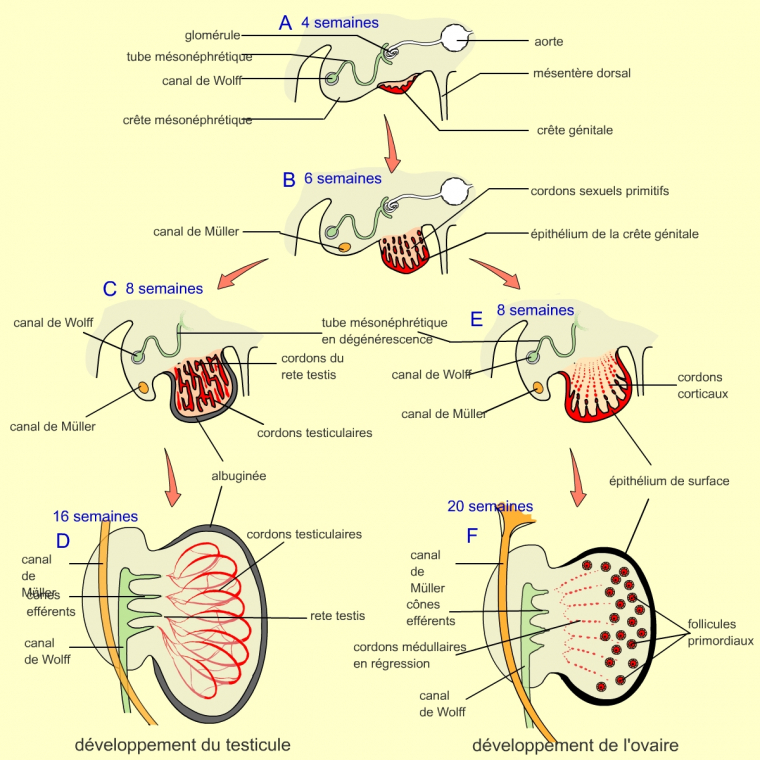
Première étape : développement identique chez l’homme et la femme
A. À 4 semaines de développement, la crête génitale est visible. Elle comporte les cellules germinales. Elle se développe à côté de la crête mésonéphrotique, qui comporte le futur canal de Wolff.
B. Après 6 semaines de développement, le canal de Müller est apparu dans la crête mésonéphrotique. Les cordons sexuels primitifs se développent à partir de l’épithélium de la crête génitale.
Deuxième étape : développement différent chez l’homme et la femme
C. Au stade 8 semaines, les cordons sexuels, pour les fœtus de type mâle, XY, vont se développer en pénétrant dans le tissu conjonctif et former un réseau relié au niveau interne par les cordons du rete testis. L’extrémité de l’ensemble des cordons sexuels va se détacher de l’épithélium de la crête génitale. Ces cordons seront séparés par une matrice extracellulaire, l’albuginée.
D. Au stade 16 semaines, les cordons sexuels ou testiculaires contenant des cellules germinales (précurseurs des gamètes) se développent, augmentant alors la taille du testicule. Le réseau formé par les cordons testiculaires et les cordons du rete testis est relié au canal déférent (tube dans lequel les spermatozoïdes passent dans l’urètre et sortent de l’organisme) par des restes de tubes mésonéphrotiques (canaux efférents).
E. Au stade 8 semaines, les cordons sexuels primitifs dégénèrent ; seul l’épithélium de surface persiste et produit des cordons corticaux.
F. Au stade 20 semaines, la folliculogenèse, c’est-à-dire la formation des follicules, démarre. On observe une migration des follicules mais il n’y a pas de connexions avec le canal de Müller.
Troisième étape : acquisition du sexe phénotypique
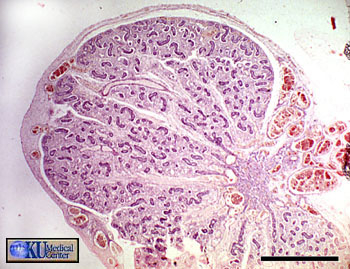
Sur cette coupe de testicule fœtal humain (5 mois 1/2), on peut voir l’albuginée (dense et fibreuse) contenant des vaisseaux sanguins en développement, ainsi que les tubes séminifères en formation, convergeant vers la droite de la photographie. Entre ces tubes de nombreuses cellules de Leydig sont visibles à partir de la 14eme semaine de développement. La barre noire mesure 1 mm.
Les gonades en développement secrètent un certain nombre d’hormones. En particulier, le testicule secrète de la testostérone (par les cellules de Leydig, situées entre les tubes séminifères) et de l’hormone anti-Müllerienne ou AMH (par les cellules de Sertoli, situées dans la paroi des tubes séminifères).
Ces hormones permettent le développement de l’ensemble de l’appareil génital vers un phénotype mâle. Cette acquisition du sexe phénotypique est visible en particulier au niveau des canaux de Wolff et de Müller :
-
Au stade indifférencié de l’appareil génital, les canaux de Wolff et de Müller sont présents.
-
Les canaux de Wolff constituent le spermiducte chez le mâle des Vertébrés. Ils sont en relation avec le mésonéphros mis en place au cours de la quatrième semaine du développement. L’extension du canal de Wolff jusqu’à l’urètre se fait pendant la cinquième semaine. Ces canaux dégénèrent chez la femelle par absence de testostérone.
-
Les canaux de Müller se développent en parallèle aux canaux de Wolff par une invagination de l’épithélium au niveau du pronéphros (région antérieure du mésonéphros) au cours de la sixième semaine. Ces canaux dégénèrent chez le mâle, sous l’action de l’AMH.
Chez les femelles ils deviennent les oviductes et débouchent dans l’utérus. L’implication d’hormones ovariennes dans le développement d’un tractus femelle n’a été montrée que chez quelques espèces de Mammifères mais pas dans l’espèce humaine.
Documents à télécharger
Animation Flash (format swf)
Contrôle génétique des différentes étapes
Rappel : le rôle central de SRY
L’étude de cas d’inversions sexuelles a permis de mettre en évidence le rôle fondamental du gène SRY dans le déterminisme sexuel. La présence et l’expression de ce gène déterminent une différenciation vers un phénotype masculin.
L’expression du gène SRY est brève (elle dure environ une journée chez la souris) et ce gène s’exprime spécifiquement dans les cellules somatiques de crêtes génitales mâles. L’implication de SRY dans la masculinisation a été démontré par plusieurs observations et expériences :
-
une mutation dans ce gène, rendant la protéine non fonctionnelle, conduit à une féminisation,
-
des souris de caryotype XX, ayant reçu une copie du gène SRY par transgenèse, sont masculinisées.
La séquence de fixation à l’ADN de SRY a été identifiée dans la région promotrice du gène SOX9, présent sur un autosome et responsable de la différenciation des cellules de Sertoli. Ces cellules jouent le rôle d’architecte de l’organisation du testicule et produisent de l’AMH, elles induisent également la différenciation des cellules de Leydig.
L’expression de SOX9 est inhibée chez les individus XX.
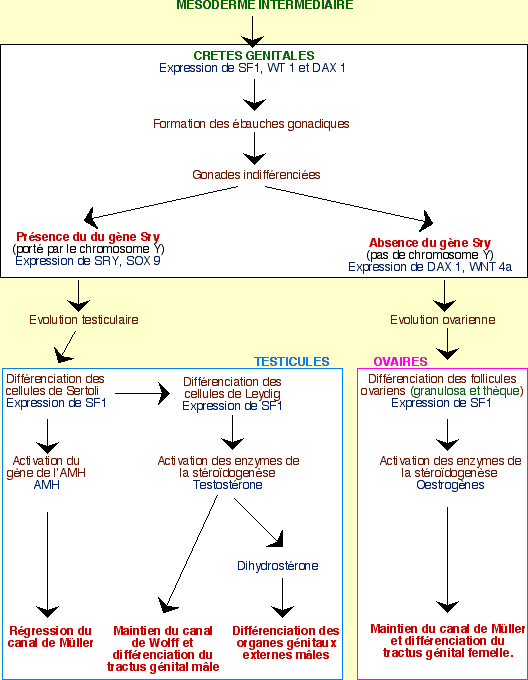
Les grandes étapes du contrôle génétique
L’expression de plusieurs gènes permet, dans un premier temps, le développement des crêtes génitales en gonades indifférenciées. Les évènements diffèrent ensuite selon le sexe :
Chez l’homme (XY)
Le gène SRY ne s’exprime que dans les crêtes génitales, au niveau des cellules de soutien. Ces cellules se différencient alors en cellules de Sertoli, dans les cordons testiculaires. Dans le même temps, d’autres cellules sont induites par ces cellules de Sertoli pour former les cellules de Leydig dans le mésenchyme qui se développe entre les cordons testiculaires. Les hormones stéroïdes sont ensuite synthétisées dans les cellules de Leydig pour continuer la différenciation en organes génitaux mâles, internes et externes, alors que la synthèse d’AMH (hormone anti-müllerienne) par les cellules de Sertoli permet la régression du canal de Müller.
Chez la femme (XX)
En l’absence de SRY, les cellules de soutien se différencient en cellules folliculeuses, entourant les cellules germinales. Au contraire de ce qui se passe chez l’homme, l’entrée en méiose de ces cellules germinales n’est pas inhibée : elles deviennent des ovogonies. Les cordons sexuels dégénèrent.
Cette différenciation ovarienne est permise par le gène DAX1 (dont l’expression persiste, au contraire des testicules) et le déterminant génique sexuel Wnt4a. DAX1 permet d’inhiber les gènes impliqués dans la masculinisation.
L’absence de testostérone induit la disparition du canal de Wolff. Le canal de Müller se maintient et se différencie en un utérus (sous l’action, chez certaines espèces de Mammifères, des œstrogènes des ovaires fœtaux). Chez la femme la formation des organes génitaux externes semble sous le contrôle d’hormones provenant du placenta et des ovaires fœtaux.
Les caractères sexuels secondaires, ainsi que l’apparence « homme » ou « femme » se réalise ensuite sous l’action des hormones produites par les gonades différenciées.
Schéma récapitulatif du contrôle génétique des étapes de la différenciation sexuelle
ADN : Acide désoxyribonucléique
AMH : Hormone anti-müllerienne
DAX1 : DNA Sequence Driving Adrenal Cortical Cell-Specific Expression
HMG : High Mobility Group
Œstrogènes : Hormones stéroïdes femelles
SF1 : Steroidogenic Factor 1
SOX9 : Facteur de transcription dont le gène est porté par le chromosome 17
SRY : Sex-determining Region of Y chromosome
TDF : Testis Determining Factor
Testostérone : Hormone stéroïde mâle
WT 1 : Wilms Tumor 1
Références
- Le déterminisme du sexe chez les Mammifères, plateforme Access.
- Le déterminisme génétique du sexe, conférence de Corinne Cotinot, 8 décembre 2013.
- La mise en place du phénotype sexuel, conférence de Solange Magre, 8 décembre 2013.
- A. Le Moigne, J. Foucrier. Biologie du développement (5e édition), Dunod (Paris), 2001.
- S. F. Gilbert. Developmental Biology (6e édition), Sinauer associates, 2000.
- K. L. Parker, A. Schedl, B. P. Schimmer. Gene Interactions in Gonadal Development, Ann. Rev. Physiol. (1999) Vol. 61 : 417-433.
Pour aller plus loin
- Les anomalies de la différenciation sexuelle, plateforme Access.
- Le développement des organes sexuels (Chapitre 7 du dossier Reproduction et environnement), Inserm 2011
Annexe : comparaison des protéines SRY d’être humain, de gorille et de souris
Les étoiles (*) indiquent les acides aminés conservés entre ces trois espèces, les points (.) une conservation entre l’Homme et le Gorille.
Noter la très grande conservation d’un domaine central (correspondant à la boîte HMG), alors que le reste de la séquence est très divergent.
humain MQSYASAMLSVFNSDDYSPAVQENIPALRRSSSFLCTESCNSKYQCETGENSKGNVQDRV
gorille MQSYASAMLSVFNSDDYSPAVQQTIPAHRRSSSFLCTESCNSKYQCETGENSKGSVQDRV
souris --------------------------------------------------------EGHV
...................... ... .......................... ....*
humain KRPMNAFIVWSRDQRRKMALENPRMRNSEISKQLGYQWKMLTEAEKWPFFQEAQKLQAMH
gorille KRPMNAFIVWSRDQRRKMALENPRMRNSEISKQLGYQWKMLTEAEKWPFFQEAQKLQAMH
souris KRPMNAFMVWSRGERHKLAQQNPSMQNTEISKQLGCRWKSLTEAEKRPFFQEAQRLKILH
*******.****..*.*.*..**.*.*.*******..**.******.*******.*...*
humain REKYPNYKYRPRRKAKMLPKNCSLLPADPASVLCSEVQLDNR----LYRDDCTKATHSRM
gorille REKYPNYKYRPRRKAKMLPKNCSLLPADPASVLCSEVQLDNR----LYRDDCTKATHSRM
souris REKYPNYKYQPHRRAKVSQRSGILQPAVASTKLYNLLQWDRNPHAITYRQDWSRAAHLYS
*********.*.*.**.......*.**.....*....*.*.. .**.*...*.*...
humain EHQ-----------LGHLPPINAASSPQQRDRYSHWTKL---------------------
gorille EHQ-----------LGHLPPINAASSPQQRDRYSHWTKL---------------------
souris KNQQSFYWQPVDIPTGHLQQQQQQQQQQQFHNHHQQQQQFYDHHQQQQQQQQQQQQFHDH
..* .***.........**..........
humain ------------------------------------------------------------
gorille ------------------------------------------------------------
souris HQQKQQFHDHHQQQQQFHDHHHHHQEQQFHDHHQQQQQFHDHQQQQQQQQQQQFHDHHQQ
humain ------------------------------------------------------------
gorille ------------------------------------------------------------
souris KQQFHDHHHHQQQQQFHDHQQQQQQFHDHQQQQHQFHDHPQQKQQFHDHPQQQQQFHDHH
humain ------------------------------------------------------------
gorille ------------------------------------------------------------
souris HQQQQKQQFHDHHQQKQQFHDHHQQKQQFHDHHQQQQQFHDHHQQQQQQQQQQQQQFHDQ
humain ------------------------------
gorille ------------------------------
souris QLTYLLTADITGEHTPYQEHLSTALWLAVS