Les énoyl-CoA carboxylases/réductases sont des enzymes capables de fixer rapidement et efficacement le carbone.
La fixation du carbone est un processus biologique crucial qui transforme le dioxyde de carbone (CO₂), une molécule très abondante mais biologiquement inaccessible, en matière organique comme les sucres. La majeure partie de la fixation du carbone est réalisée par les plantes et les algues grâce à l’enzyme Rubisco. Cependant, la Rubisco est une enzyme relativement lente et peu efficace. Cette faible efficacité a entraîné des adaptations évolutives chez les algues et les plantes, comme la production de grandes quantités de Rubisco et leur stockage dans des organites spécialisés (par exemple les pyrénoïdes dans les chloroplastes). Cette faible efficacité est en grande partie due à son affinité à la fois pour le dioxyde de carbone (CO₂) et le dioxygène (O₂), tous deux présents dans l’atmosphère terrestre. Malgré diverses tentatives en laboratoire pour augmenter l’efficacité de la Rubisco, des améliorations significatives restent difficiles à obtenir. La fixation du carbone n’est toutefois pas l’apanage des plantes et des algues. Certaines bactéries et archées ont développé des voies alternatives de fixation du carbone qui ne dépendent pas de la Rubisco. L’étude de ces systèmes peut fournir des connaissances sur la manière dont nous pourrions concevoir des systèmes synthétiques pour capturer et fixer le dioxyde de carbone de notre atmosphère 1.
Un moyen plus efficace de fixer le carbone
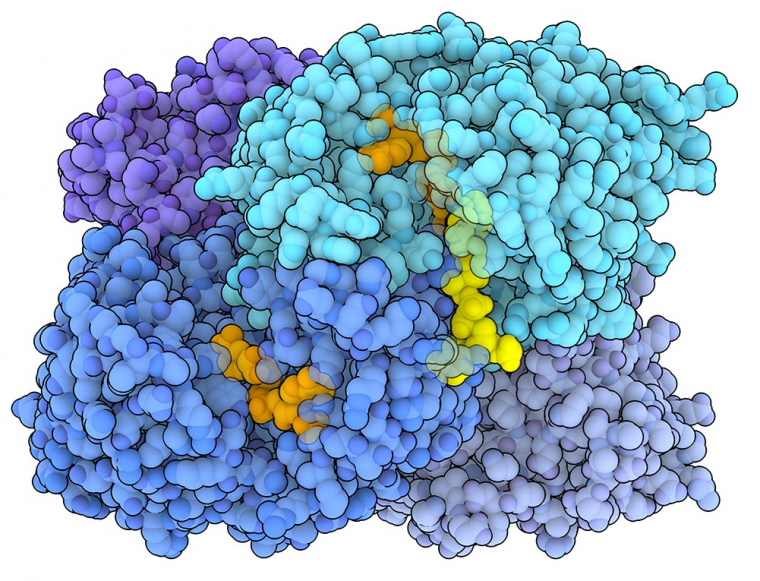
Une famille d’enzymes découverte récemment, les énoyl-CoA carboxylases/réductases, que l’on trouve chez certaines espèces de bactéries et d’archées, catalyse la fixation du carbone à des vitesses exceptionnellement rapides. Une énoyl-CoA carboxylase/réductase provenant d’une bactérie du sol appelée Kitasatospora setae (entrée de la banque de données sur les protéines (PDB) 6OWE) est représentée sur la figure 1 2. Contrairement à la Rubisco, les énoyl-CoA carboxylases/réductases ne reconnaissent pas l’O₂ comme substrat, évitant ainsi une éventuelle compétition avec le CO₂. Il est intéressant de constater que les énoyl-CoA carboxylases/réductases sont jusqu’à 10 fois plus rapides que la Rubisco dans la fixation du CO2. Des études structurales récentes ont montré que les énoyl-CoA carboxylases/réductases fonctionnent comme des homotétramères, chaque sous-unité pouvant se lier au CO₂, au NADPH (qui agit comme cofacteur et donneur d’électrons) et à une molécule de substrat (un énoyl-CoA3). Lors de la fixation du carbone, un ion hydrure (H−) est transféré du NADPH à la molécule de substrat. Cette étape rend le substrat très réactif, ce qui lui permet de réagir avec le dioxyde de carbone lié pour former un nouveau produit (un ester d’alkyle-CoA).
L’énoyl-CoA carboxylase/réductase de Kitasatospora setae (entrée PDB 6OWE) est un tétramère. Le NADPH, représenté en orange, agit comme donneur d’électrons, tandis que le substrat, une molécule d’énoyl-CoA, est représenté en jaune.
Une synchronisation des enzymes
Comment expliquer la vitesse et l’efficacité impressionnantes des énoyl-CoA carboxylases/réductases dans la fixation du carbone ? Des études récentes ont mis en évidence un mécanisme de synchronisation unique qui facilite cette catalyse rapide. L’énoyl-CoA carboxylase/réductase tétramérique adopte une configuration en « paire de dimères », dans laquelle chaque sous-unité forme un dimère avec une sous-unité voisine, et les deux dimères s’assemblent dans une géométrie en forme de X. Cette configuration particulière permet une action coordonnée pendant le cycle catalytique, comme le montre l’animation visible à la figure 2 1. À l’état initial, vide (entrée PDB 6NA3), l’enzyme est symétrique, mais lorsqu’elle se lie au NADPH (représenté en orange), le tétramère subit un changement de conformation (entrée PDB 6NA6). Une sous-unité de chaque dimère se ferme de manière coordonnée, positionnant précisément le substrat (en jaune), le NADPH et le dioxyde de carbone (qui n’apparaît pas dans l’animation) à proximité immédiate, entraînant la fixation du carbone (entrée PDB 6NA4). Une fois la réaction terminée, les sous-unités s’ouvrent et libèrent le produit. Cette libération déclenche la fermeture de la sous-unité partenaire au sein du dimère, ce qui déclenche le cycle de catalyse suivant. La commutation synchronisée entre les états ouvert et fermé est couplée à un mouvement de torsion du complexe enzymatique, qui pourrait améliorer la fixation du substrat et/ou la libération du produit. La synchronisation rapide et couplée des sous-unités de l’énoyl-CoA carboxylase/réductase est considérée comme un facteur clé à l’origine d’une performance supérieure à celle de la Rubisco.
Regarder de plus près la fixation du carbone
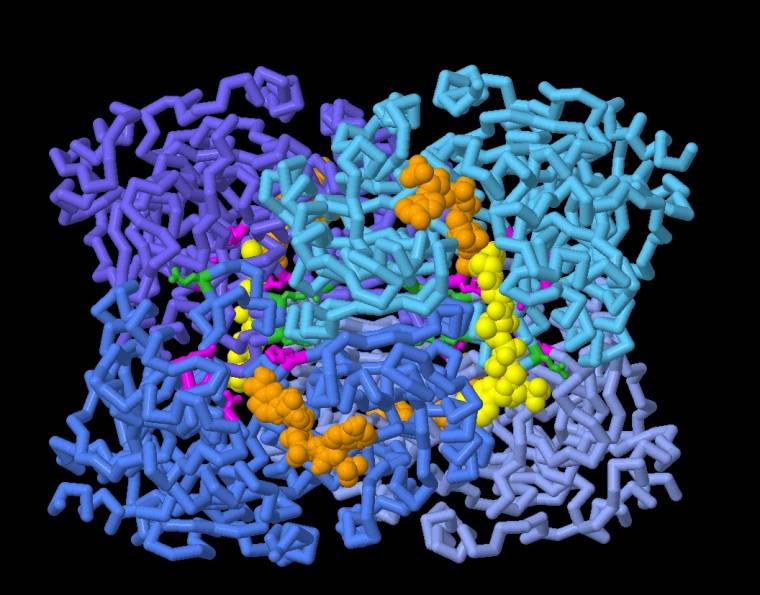
Vous pouvez utiliser par exemple le logiciel de visualisation de molécules disponible sur le site PDB-101 pour explorer les différentes conformations de l’énoyl-CoA carboxylase/réductase et examiner de plus près les résidus d’acides aminés possiblement impliqués dans la fixation du dioxyde de carbone (représentés en magenta sur la figure 3), ainsi que les résidus impliqués dans la coordination de la synchronisation enzymatique (représentés en vert sur la figure 3).
Le coenzyme NADPH donneur d’électrons est représenté en orange tandis que le substrat (l’énoyl-CoA) est représenté en jaune.
Pour aller plus loin
- La Rubisco est considérée comme l’une des enzymes les plus abondantes de la planète. Elle est utilisée par les plantes et les algues pour fixer le dioxyde de carbone. Pour en savoir plus, vous pouvez retrouver un article de la molécule du mois à ce sujet : Molecule of the Month : Rubisco.
- Les cyanobactéries utilisent également la Rubisco, en stockant plusieurs copies de l’enzyme dans un organite appelé carboxysome. Pour en savoir plus, vous pouvez retrouver un article traduit de la molécule du mois à ce sujet : La molécule du mois : les mécanismes de capture du carbone.
- Les études citées dans cet article ont tiré parti des techniques de cristallographie résolue en temps1, qui ont également été utilisées pour étudier d’autres enzymes qui catalysent rapidement des réactions, y compris des protéines activables par la lumière.
Ce texte correspond à la traduction par Cédric Bordi de l’article Molecule of the Month : énoyl-CoA Carboxylases/Reductases 1 écrit par Janet Iwasa et paru en mars 2025 sur le site PDB-101, le portail éducatif de la base de données sur les protéines (PDB). Les notes de bas de page correspondent à des ajouts du traducteur.