Avec le changement climatique, de nombreux facteurs environnementaux sont modifiés, ce qui affecte fortement la croissance des plantes ainsi que le rendement des plantes cultivées. Si l’augmentation de la concentration atmosphérique en CO2 favorise la photosynthèse et la création de biomasse, la hausse des températures et l'augmentation de la fréquence et de l'intensité des épisodes de sécheresse perturbent l’homéostasie cellulaire (en ayant des effets sur la composition, les concentrations et la structure des différents composants et compartiments de la cellule) et provoquent des réponses adaptatives chez les plantes. Ensemble, ces facteurs affectent la croissance des plantes qui, grâce à leur plasticité phénotypique, mettent en place des réponses à ces contraintes environnementales : c’est l’accommodation.
Les plantes représentent plus de 80 % de la biomasse terrestre [7] et, en influençant directement la concentration en CO2 atmosphérique, jouent un rôle fondamental dans le cycle du carbone [8]. Comme elles permettent à l’humanité de se nourrir, la question des conséquences du changement climatique sur la croissance des plantes se pose de manière pressante. Cet article donne un aperçu de la réponse d’une plante à trois paramètres qui évoluent avec le changement climatique : la concentration en CO2, la température et la sécheresse. Les interactions entre les différents facteurs ainsi que la réponse à l’échelle des écosystèmes seront également évoquées.
Les principaux effets du changement climatique sont connus. La concentration en CO2 s’est déjà élevée de 280 à 415 ppm depuis 1880 [9]. Les émissions de CO2 et d’autres gaz à effet de serre seront responsables d’une augmentation de la température moyenne pour le siècle à venir de 1 à 4 °C selon les scénarios [10]. À ceci, s’ajoute l’augmentation de la fréquence et de l’intensité des événements météorologiques extrêmes et en particulier des sécheresses, que l’on définira comme un manque d’eau inhabituel et suffisamment prononcé pour que la croissance de la plante soit visiblement affectée [10].
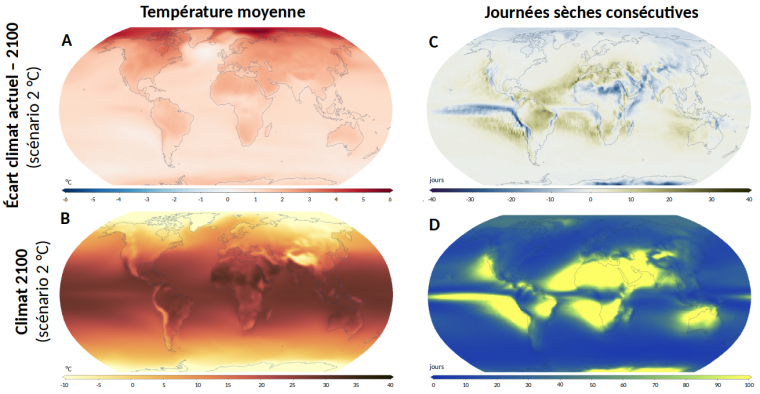
Si l’augmentation de la concentration en CO2 est uniforme sur l’ensemble du globe, il n'en sera pas de même pour les gammes de température et de précipitations, qui présenteront une variabilité importante selon les zones géographiques à l'horizon 2100 (Figure 1). Les effets sur les plantes dépendront à la fois du climat et des caractéristiques des espèces cultivées localement. Par exemple, le nord de l’Europe verra, du fait d’un réchauffement important, la surface des terres cultivables s’étendre et pourra introduire de nouvelles cultures, alors que les régions méditerranéennes seront principalement confrontées à des événements climatiques extrêmes et en particulier à des épisodes plus importants de sécheresse [11].
A. Différence entre la température moyenne actuelle et la température estimée en 2100.
B. Température moyenne estimée en 2100.
C. Différence du nombre de journées sèches consécutives (précipitation < 1 mm) entre le climat actuel et 2100.
D. Nombre de journées sèches consécutives en 2100.
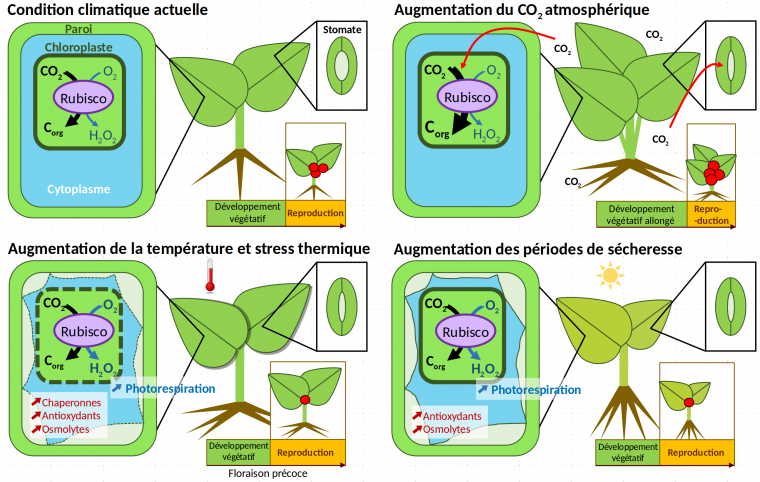
Les conséquences sur la croissance des plantes de ces trois facteurs – la concentration en CO2 atmosphérique, la température et la sécheresse – seront détaillées ici de manière indépendante, puisque la majorité des études considère l’effet d’un seul de ces paramètres, modifié en laboratoire. Ces études ont été réalisées principalement sur la plante modèle Arabidopsis thaliana (voir par exemple la Figure 3) et sur des plantes cultivées (en particulier le soja, le coton, le maïs, le riz et le blé, Figure 8 pour un exemple).
L’augmentation de la concentration en CO2 favorise le métabolisme carboné et la croissance
Conséquences métaboliques et moléculaires : l’assimilation du CO2 atmosphérique renforcée
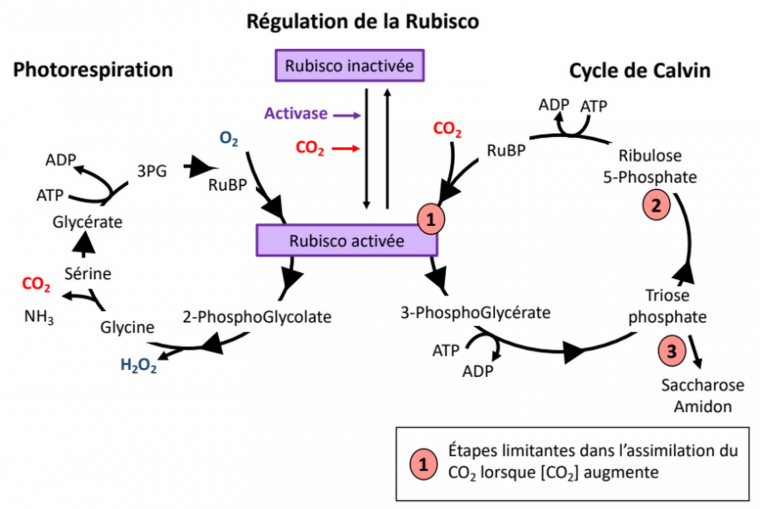
L’augmentation de la concentration de CO2 atmosphérique influence directement le métabolisme carboné. En effet le CO2 est alors plus disponible à l’intérieur des cellules pour l’enzyme Rubisco (ou ribulose-1,5-bisphosphate carboxylase/oxygénase), l’enzyme qui initie l’assimilation du carbone atmosphérique au cours de la photosynthèse. Le CO2 est donc assimilé en plus grande quantité [12]. Cependant, l’assimilation du CO2 ne croît pas linéairement avec l’augmentation de sa concentration atmosphérique : d’autres facteurs limitants interviennent à de hautes concentrations, à savoir la capacité à régénérer le RuBP ainsi que celle d’utiliser les trioses phosphate pour produire du saccharose ou de l’amidon (Figure 2) [13]. Sur le long terme, de fortes concentrations en CO2 dans la cellule peuvent entraîner un rétrocontrôle négatif limitant la quantité de Rubisco produite [13].
La photorespiration et le cycle de Calvin sont deux ensembles de réactions complexes. Seules quelques étapes et quelques-uns des réactifs et produits impliqués sont représentés.
Par ailleurs, l’augmentation de l’activité carboxylase de la Rubisco (assimilation du carbone) se fait au détriment de son rôle dans la photorespiration (réaction métabolique qui commence par l’assimilation de O2 par la Rubisco) [8]. Bien que la photorespiration soit souvent un facteur limitant pour la croissance, sa diminution peut avoir des effets négatifs sur la tolérance aux stress et sur le métabolisme azoté, causant ainsi une réduction du taux de protéines de certaines cultures [8,13,14].
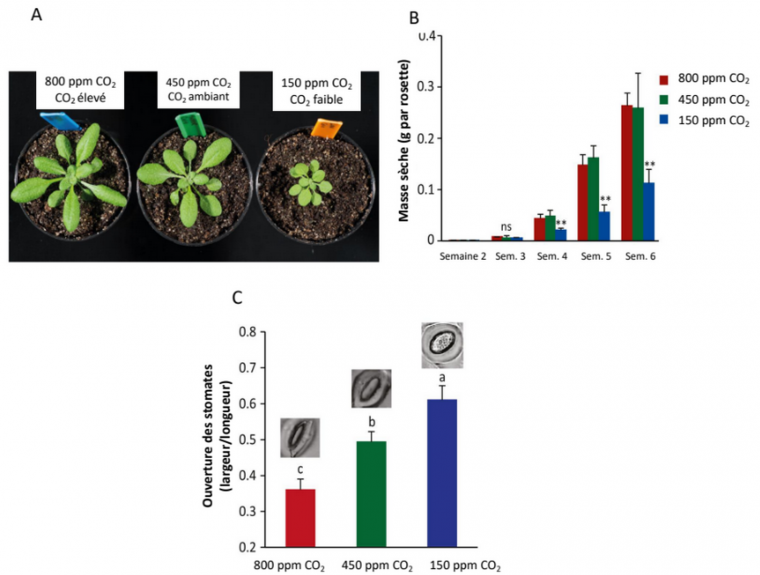
De plus, le CO2 intervient dans des voies de signalisation. Une concentration élevée en CO2 modifie l’activité des canaux ioniques des membranes cellulaires et entraîne ainsi une réduction de l’ouverture des stomates et donc de leur conductivité (Figure 3C). La transpiration est ainsi limitée, ce qui entraîne une économie des ressources en eau du sol, mais limite aussi le refroidissement de la plante [13]. Une réponse transcriptionnelle est également observée et modifie le métabolisme carboné, en stimulant les voies d’assimilation du carbone via la photosynthèse notamment (Figure 5) [12].
Conséquences morphologiques : croissance favorisée et meilleurs rendements
L’assimilation du carbone accrue par la photosynthèse est associée sans surprise à une augmentation de la biomasse : les feuilles sont plus grandes, les tiges sont plus nombreuses [12]. La biomasse des racines augmente ainsi que le ratio racine/tige. En particulier pour les espèces agricoles, davantage de racines latérales sont mises en place et la croissance des racines s’effectue dans des couches plus superficielles du sol (Figures 3A et 3B ; Figure 9, panel sur le CO2) [12].
A. Plants âgés de 4 semaines et cultivés à différentes concentrations en CO2.
B. Masse sèche des rosettes entre 2 et 6 semaines (ns : pas de différence significative, ** : différence significative).
C. Ouverture des stomates chez des plants de 4 semaines.
Le développement reproductif est de même favorisé. Le rendement est augmenté dans de nombreuses espèces agricoles du fait de l’augmentation du nombre de fleurs et de graines tout comme de la masse des graines, ainsi que par un allongement de la phase de développement végétatif et une sénescence retardée [12,13].
Il faut cependant noter que la qualité nutritive des récoltes diminue, d’une part à cause d’une concentration plus faible en fer et en zinc [12] et d’autre part suite à la réduction du taux de protéines. Nous avons en effet déjà mentionné les conséquences associées à la diminution de la photorespiration. Plus généralement le métabolisme azoté est affecté par l’augmentation de la concentration en CO2 du fait, entre autres, d'une assimilation réduite des nitrates [14].
La hausse des températures affecte de nombreux processus cellulaires et morphologiques
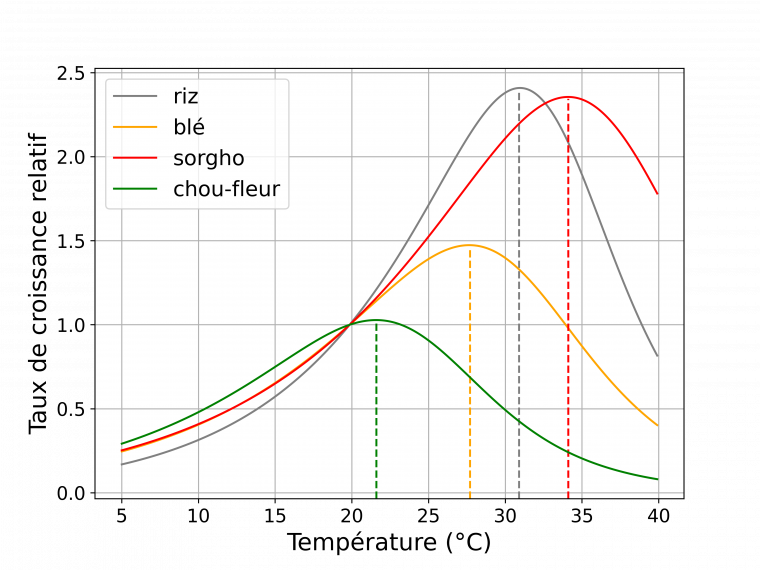
Du fait de l’agitation thermique qu’elle génère, la température intervient dans toutes les réactions biochimiques des cellules. De plus, beaucoup d’enzymes ont une activité dépendant de la température. La température est donc un facteur clé dans le développement des plantes. Elle favorise les réactions biochimiques et le développement jusqu’à un optimum, au-delà duquel une augmentation de la température est défavorable au développement (Figure 4). C’est ce que l’on appelle le stress thermique. Bien évidemment les effets dépendent d’une part des caractéristiques de la hausse de température (intensité, durée, vitesse d’augmentation) et de celle de la plante (en fonction de l’espèce en particulier s’il s’agit d’une plante C3 ou C4, du cultivar, du stade de développement et de la valeur de son optimum de température) [12,15,16].
La référence correspond à la croissance à 20 °C. Les lignes en pointillés marquent la température correspondant à l’optimum de croissance. Les courbes correspondent à un modèle de réponse à la température ajusté sur des données expérimentales de croissance et de développement.
L’augmentation de la température en dessous de l’optimum favorise la croissance
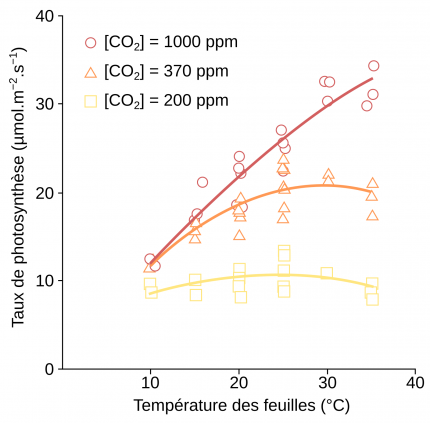
Le taux de photosynthèse correspond à la quantité de CO2 fixée par unité de temps et de surface foliaire.
Lorsque l’élévation de température intervient dans une gamme de température en dessous de l’optimum de croissance, des changements à l’échelle de l’organisme et des organes s’opèrent, avec par exemple une croissance plus importante des parties foliaires [12] ainsi qu’une diminution de la densité et de la conductance des stomates (Figure 9, panel sur la température) [13,16]. Les racines deviennent plus longues, plus nombreuses et poussent plus en surface, modifiant l’aspect du réseau racinaire [12]. Au niveau du métabolisme, la respiration et la photosynthèse sont plus importantes (voir la Figure 5 pour l'effet de la température sur la photosynthèse).
La hausse des températures est aussi responsable d’un changement dans la temporalité des cycles de vie. Beaucoup d’espèces fleurissent alors précocement, ce qui peut être délétère pour la reproduction car cela diminue la possibilité d’accumuler des ressources nécessaires pour le développement reproductif [12,16]. Le décalage temporel peut également être à l’origine d’un problème de synchronisation avec les autres facteurs abiotiques ou biotiques (comme les pollinisateurs) intervenant dans la reproduction [17]. L’avancement du début de la floraison peut être dû à un effet direct de la température sur la vitesse du développement et sur la vernalisation. En particulier, le réchauffement climatique en cours fait craindre une réduction importante des zones géographiques présentant des conditions hivernales suffisamment froides pour assurer la vernalisation, qui est pourtant un préalable indispensable à la floraison des arbres fruitiers par exemple [12,17].
Le stress thermique perturbe l’homéostasie des cellules végétales
En plus des transformations évoquées précédemment, le stress thermique affecte plus fortement le développement reproductif et provoque notamment une inhibition de l’ouverture des anthères, de la germination du pollen et de la croissance du tube pollinique [16].
À l’échelle cellulaire, l’homéostasie cellulaire (c’est-à-dire la composition, les concentrations et la structure des différents composants et compartiments de la cellule) d’une plante soumise à une forte hausse de température (au-dessus de l’optimum) est fortement perturbée (Figure 9, panel sur la température). Tout d’abord l’évapotranspiration augmente, ce qui conduit à une baisse du potentiel hydrique de la plante [15]. De plus l’agitation thermique cause une augmentation de la fluidité des membranes et en conséquence une désorganisation du cytosquelette associé à celles-ci, ainsi qu’une perturbation des concentrations et des flux ioniques (en particulier calciques) [15].
Par ailleurs de fortes températures peuvent être la cause de la dénaturation et de l’agrégation de protéines ainsi que de l’inhibition de leur synthèse [15]. Des températures en hausse sont également à l’origine de l’augmentation du stress oxydatif, notamment via la production de dérivés réactifs de l’oxygène (molécules oxydantes très réactives) toxiques pour la cellule [15,18]. En effet, dans des conditions de stress thermique, l’activité métabolique est perturbée. Par exemple, l’inactivation du photosystème II due à la chaleur, inhibe le transport des électrons le long de la chaîne photosynthétique, aboutissant à la formation de dérivés réactifs de l’oxygène. D’autres mécanismes de production de ces espèces existent, comme le découplage de la chaîne de transport des électrons mitochondriale, l’activation des NADPH oxydases membranaires ou la production du dérivé H2O2 par l’augmentation de la photorespiration [19,20]. Le stress oxydatif est responsable de dégradations des structures cellulaires pouvant aller jusqu’à la mort cellulaire [21].
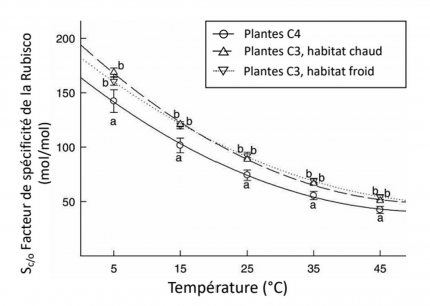
Les plantes C3 sont séparées en plantes vivant dans un habitat froid et en plantes vivant dans un habitat chaud, en fonction de leur optimum de croissance. Le facteur de spécificité correspond au ratio de la capacité de fixation du CO2 par la Rubisco par rapport à celle de l’O2, indépendamment de la concentration de ces deux molécules. Des lettres distinctes indiquent des différences statistiquement significatives.
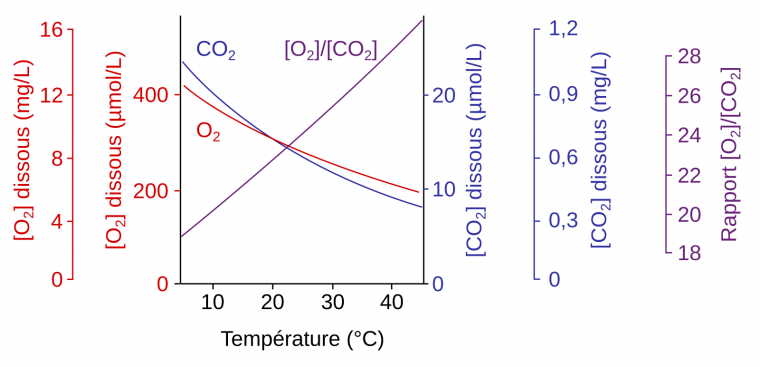
La température affecte fortement le métabolisme. Si nous avons vu qu’une augmentation de température en dessous de l’optimum est favorable à la respiration et à la photosynthèse, lors d’un stress thermique l’activité des enzymes mitochondriales et chloroplastiques est diminuée [15,16,18,22]. En particulier l’activité de la Rubisco décroît. En effet, d’une part l’activase de la Rubisco est inhibée par de fortes températures (voir le contrôle de l’activité de la Rubisco, Figure 2) et d’autre part la spécificité de la Rubisco pour le CO2 diminue à la faveur d’une plus grande assimilation de l’O2 (Figure 6). Ce phénomène entraîne une photorespiration plus importante, qui est encore accentuée par le fait que la diminution de la solubilité du CO2 avec l’augmentation de température est plus forte que celle de l’O2 (Figure 7) [13,15].
La solubilité des deux gaz diminue quand la température augmente. Cependant, la solubilité du CO2 diminue plus vite que celle de l’O2, ce qui amène à une augmentation du rapport [O2]/[CO2].
Télécharger la figure au format SVG.
Un stress thermique est également responsable de changements dans la structure des organites. La photosynthèse diminue du fait de la sensibilité du photosystème II à la photo-oxydation [18] et à la température [15,16] et la chaîne de transport des électrons est alors plus lente (Figure 5 pour l’influence de la température sur le taux photosynthétique).
Mécanismes d’accommodation face à un stress thermique
Les plantes possèdent des mécanismes de protection et de réparation permettant de faire face aux dangers des hautes températures. Pour lutter contre la dénaturation des protéines, les plantes produisent des protéines de choc thermique (en particulier la classe des HSP70 pour Heat shock protein 70) qui ont notamment un rôle de protéines chaperonnes [12,15,23].
Les structures cellulaires sont de plus protégées par la production de métabolites secondaires. Par exemple, l’activité plus intense de l’enzyme PAL (Phenylalanine ammonia lyase) permet d’augmenter la production de composés phénoliques. De même les caroténoïdes protègent les structures cellulaires (par exemple la zéaxanthine protège les lipides des dégâts causés par l’oxydation), tout comme la production d’isoprène protège le photosystème II [15,23]. D’autres antioxydants, comme les enzymes Superoxyde dismutase (SOD) ou Ascorbate peroxydase (APX), permettent de réduire directement la concentration de dérivés réactifs de l’oxygène [15].
L’accumulation de solutés, comme la glycine bétaïne ou la proline, permet de restaurer l’équilibre osmotique et le potentiel hydrique des cellules [15]
Afin de permettre la réalisation de ces adaptations à l’échelle cellulaire et les changements morphologiques décrits ensuite, la signalisation est modifiée en réponse à un stress thermique. Cela concerne la signalisation hormonale, avec notamment une augmentation de la production d’acide abscissique [15], des modifications de l’activité transcriptionnelle [16] ainsi que l’activation de cascades de signalisation [15,23].
Il est important de noter que si la température atmosphérique agit sur la température de la plante via des échanges thermiques, l’état hydrique de la plante est aussi affecté. En effet la pression de vapeur de l’eau dans l’air diminue en cas de chaleur importante, ce qui augmente le gradient de potentiel hydrique entre le sol et l’air et par conséquent accentue l’évapotranspiration de la plante, dont la réserve d’eau diminue alors. Les effets spécifiques au stress hydrique sont abordés dans la suite de cet article.
Augmentation et intensification des périodes de sécheresse
Les épisodes de sécheresse entraînent une faible humidité du sol ainsi qu’un faible potentiel hydrique des parties aériennes de la plante, il y a donc une forte perte d’eau par évapotranspiration, ce qui est dommageable à la croissance de la plante (en particulier des parties foliaires) et à l’intégrité de ses tissus [12,24]. Les signes caractéristiques d’une plante souffrant de la sécheresse sont en effet des feuilles peu rigides, tombantes ou enroulées.
Effets cellulaires et moléculaires : arrêt de la croissance et limitation de la photosynthèse
Le manque d’eau peut occasionner des modifications physiologiques, moléculaires et des dégâts sur la plante. La diminution de la quantité d’eau dans la plante peut entraîner une baisse de la pression de turgescence (à l’origine de l’aspect « flasque » des feuilles) et par conséquent une baisse de la croissance des cellules [24]. La sécheresse est en effet associée à un arrêt de la croissance, tout d’abord lié à un arrêt de l’élongation des cellules par diminution de la pression de turgescence et, lorsque la sécheresse s’intensifie, à l’arrêt de la photosynthèse [25].
La sécheresse est également responsable d’une augmentation de la production des dérivés réactifs de l’oxygène dans les cellules et donc des dégâts dus au stress oxydatif [24], par exemple au niveau des photosystèmes, ce qui limite la photosynthèse [26]. De plus la fermeture des stomates limite les échanges gazeux et donc l’assimilation du CO2, ce qui augmente la photorespiration.
La déshydratation entraîne enfin une altération de la structure des membranes, de leur composition et de l’agencement des lipides, ce qui affecte leur fonctionnement et en particulier modifie leur perméabilité [26,27].
Conséquences morphologiques et fonctionnelles
La plante dispose de mécanismes lui permettant de limiter la perte d’eau par les parties aériennes et de maximiser le captage d’eau, afin de rendre son bilan hydrique moins négatif.
Sur une courte échelle de temps, les stomates jouent un rôle essentiel pour la régulation des flux d’eau et se ferment en cas de déficit hydrique (suite à une diminution de la turgescence des cellules de garde et à l’augmentation de la concentration en acide abscissique) [24,26].
Si certains mécanismes de régulation progressive des surfaces d’échanges peuvent se mettre en place, ils ne peuvent intervenir que dans le cas d’une sécheresse progressive et d’une intensité limitée. Ces mécanismes correspondent à la limitation de l’expansion des feuilles, un enroulement des feuilles ou une sénescence anticipée [12,24,26]. Certaines plantes produisent également des trichomes qui, en réduisant les flux d’air et d’eau ainsi que l’absorption de la lumière (et donc la chaleur qui en résulte), limitent l’évapotranspiration [24]. A contrario, le système racinaire est renforcé pour optimiser l’acquisition et la conservation de la ressource la plus limitante : l’eau [12]. En effet, lorsque les conditions ne sont pas trop drastiques, la croissance des racines est maintenue voire augmentée, le nombre de racines latérales augmente et les racines poussent plus en profondeur (du fait de la modification du gravitropisme et de la signalisation par l’auxine) [12].
Le développement reproductif est également affecté par la sécheresse, avec par exemple un ralentissement de la floraison et une perte de viabilité du pollen [12] (Figure 9, panel sur la sécheresse). La réduction du développement reproductif est associée à une baisse de productivité et de rendement agricole (voir Figure 8 pour un exemple sur le blé et le riz).
Les valeurs indiquent le nombre de données et la barre horizontale l’intervalle de confiance à 95 %. La variation de la valeur d’un trait est calculée en moyennant plus d’une cinquantaine d’études par espèces. Chaque étude mesure des traits d’un groupe de plants témoins, bien irrigué et ceux d’un groupe moins bien irrigué.
Les stratégies face à la sécheresse
Face à la sécheresse, trois grands types de stratégies adaptatives s’observent chez les plantes : échappement, évitement et tolérance. Une stratégie adaptative est un ensemble interconnecté d’adaptations, qui favorise la croissance et la reproduction face à un stress donné.
La stratégie d’échappement s’observe principalement chez des espèces annuelles, qui présentent alors un développement concentré hors des périodes de sécheresse. Cela se fait principalement par une floraison précoce et un développement reproductif rapide avant la période de sécheresse [12,24].
Chez d’autres plantes, une stratégie d’évitement de la déshydratation est observée. Ces plantes présentent les mécanismes de limitation de l’évapotranspiration précédemment évoqués : un système racinaire renforcé, avec des racines profondes, pour augmenter le captage d’eau ainsi que des feuilles présentant des adaptations limitant les échanges d’eau (petite surface ou enroulement des feuilles, cuticule renforcée, présence de trichomes) [12,24]. Ainsi, ces plantes conservent, malgré la sécheresse, un contenu en eau équivalent à celui des périodes humides.
Enfin, certaines plantes subissent le stress et donc une perte en eau, mais sont capables d’y résister (stratégie de tolérance). Ces plantes produisent diverses molécules (sorbitol, glycine bétaïne, etc.) pour réduire la présence des dérivés réactifs de l’oxygène, maintenir l’équilibre osmotique et protéger l’intégrité structurelle de la cellule [24,26]. Ces changements sont bien évidemment accompagnés d’une modification de la régulation transcriptionnelle. Par exemple l’expression des gènes de signalisation de l’acide abscissique augmente dans les feuilles, ainsi que l’expression de ceux associés au métabolisme de la proline et aux modifications des composés de la paroi [12]. Tout particulièrement, la régulation de l’expression et de la localisation des aquaporines est essentielle à la résistance à la sécheresse [29].
Interactions entre les différents facteurs
Les effets décrits précédemment sont ceux observés dans des systèmes expérimentaux où les paramètres (concentration en CO2, température, stress hydrique) sont contrôlés individuellement. Or les quelques études réalisées en perturbant plusieurs facteurs en même temps, comme c’est le cas pour le changement climatique, montrent des interactions entre les différents facteurs. Par exemple, dans des conditions élevées de CO2, les rendements du soja augmentent. Mais si l’on effectue la même expérience dans des conditions de sécheresse, la hausse du rendement due au CO2 devient très faible. Et il en est de même si l’on combine les effets de la température à ceux du CO2 [12].
Une autre limitation est que les plantes ne sont jamais seules dans leur écosystème et il faut tenir compte de leurs interactions avec le reste de la biocénose. Par exemple, une hausse des températures rend souvent les plantes plus sensibles aux pathogènes [16]. Et si l’on combine différents facteurs et les différents organismes de l’écosystème, on peut par exemple s’apercevoir que, chez le soja, une augmentation du CO2 renforce la présence des nodosités uniquement en période de sécheresse [12].
Les composantes abiotiques de l’écosystème sont également à prendre en compte. Ainsi l’augmentation de l’assimilation de carbone associée à une hausse du CO2 atmosphérique ne s’observe que lorsque les quantités de nutriments et d’eau disponibles sont suffisantes [13].
Conclusion
Les modifications de la croissance des plantes abordées dans cet article correspondent principalement à des réponses réversibles et à court terme des végétaux face aux changements de leur environnement. Ces accommodations se réalisent dans les limites de la plasticité phénotypique des espèces. Cependant, sur le long terme, le changement climatique est à l’origine de nouvelles pressions de sélection et donc de modifications de la composition génétique des écosystèmes et de la biodiversité [30,31]. Ces pressions de sélection aboutiront à sélectionner des adaptations aux changements de concentration en CO2, température et quantité d’eau disponible, ou à une extinction des espèces si les changements sont trop brutaux.
Remerciements
Élise Muller et Pascal Combemorel remercient Olivier Loudet et Jean-Louis Durand pour leurs relectures attentives de ce texte ainsi que pour leurs conseils.
Références
[1] « IPCC AR6-WGI Atlas ». https://interactive-atlas.ipcc.ch/atlas (consulté le 11 mai 2022).
[2] Y. Zhou, I. Vroegop-Vos, R. C. Schuurink, C. M. J. Pieterse, et S. C. M. Van Wees, « Atmospheric CO2 Alters Resistance of Arabidopsis to Pseudomonas syringae by Affecting Abscisic Acid Accumulation and Stomatal Responsiveness to Coronatine », Frontiers in Plant Science, vol. 8, 2017, Consulté le : 8 avril 2022. [En ligne]. Disponible sur : https://www.frontiersin.org/article/10.3389/fpls.2017.00700
[3] B. Parent et F. Tardieu, « Temperature responses of developmental processes have not been affected by breeding in different ecological areas for 17 crop species », New Phytologist, vol. 194, no 3, p. 760‑774, 2012, doi : 10.1111/j.1469-8137.2012.04086.x.
[4] K. Hikosaka, K. Ishikawa, A. Borjigidai, O. Muller, et Y. Onoda, « Temperature acclimation of photosynthesis : mechanisms involved in the changes in temperature dependence of photosynthetic rate », Journal of Experimental Botany, vol. 57, no 2, p. 291‑302, janv. 2006, doi : 10.1093/jxb/erj049.
[5] J. Galmés, C. Hermida-Carrera, L. Laanisto, et Ü. Niinemets, « A compendium of temperature responses of Rubisco kinetic traits : variability among and within photosynthetic groups and impacts on photosynthesis modeling », EXBOTJ, vol. 67, no 17, p. 5067‑5091, sept. 2016, doi : 10.1093/jxb/erw267.
[6] J. Zhang et al., « Effect of Drought on Agronomic Traits of Rice and Wheat : A Meta-Analysis », IJERPH, vol. 15, no 5, p. 839, avr. 2018, doi : 10.3390/ijerph15050839.
[7] Y. M. Bar-On, R. Phillips, et R. Milo, « The biomass distribution on Earth », Proceedings of the National Academy of Sciences, vol. 115, no 25, p. 6506‑6511, juin 2018, doi : 10.1073/pnas.1711842115.
[8] C. D. Gross et R. B. Harrison, « The Case for Digging Deeper : Soil Organic Carbon Storage, Dynamics, and Controls in Our Changing World », Soil Syst., vol. 3, no 2, p. 28, avr. 2019, doi : 10.3390/soilsystems3020028.
[9] M. Rubino et al., « Revised records of atmospheric trace gases CO2, CH4, N2O, and δ13C-CO2 over the last 2000 years from Law Dome, Antarctica », Earth Syst. Sci. Data, vol. 11, no 2, p. 473‑492, avr. 2019, doi : 10.5194/essd-11-473-2019.
[10] Masson-Delmotte, V., P. Zhai, A. Pirani, S.L., Connors, C. Péan, S. Berger, N. Caud, Y. Chen, L. Goldfarb, M.I. Gomis, M. Huang, K. Leitzell, E. Lonnoy, J.B.R., Matthews, T.K. Maycock, T. Waterfield, O. Yelekçi, R. Yu, and B. Zhou (eds.), et Masson-Delmotte, V., P. Zhai, A. Pirani, S.L. Connors, C. Péan, S. Berger, N. Caud, Y. Chen, L. Goldfarb, M.I. Gomis, M. Huang, K. Leitzell, E. Lonnoy, J.B.R. Matthews, T.K. Maycock, T. Waterfield, O. Yelekçi, R. Yu, and B. Zhou (eds.), « IPCC, 2021 : Climate Change 2021 : The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change », Cambridge University Press, Consulté le : 30 mars 2022. [En ligne]. Disponible sur : https://www.ipcc.ch/report/ar6/wg2/downloads/report/IPCC_AR6_WGII_FinalDraft_FullReport.pdf
[11] J. E. Olesen et M. Bindi, « Consequences of climate change for European agricultural productivity, land use and policy », European Journal of Agronomy, vol. 16, no 4, p. 239‑262, juin 2002, doi : 10.1016/S1161-0301(02)00004-7.
[12] S. B. Gray et S. M. Brady, « Plant developmental responses to climate change », Developmental Biology, vol. 419, no 1, p. 64‑77, nov. 2016, doi : 10.1016/j.ydbio.2016.07.023.
[13] M. E. Dusenge, A. G. Duarte, et D. A. Way, « Plant carbon metabolism and climate change : elevated CO 2 and temperature impacts on photosynthesis, photorespiration and respiration », New Phytol, vol. 221, no 1, p. 32‑49, janv. 2019, doi : 10.1111/nph.15283.
[14] A. J. Bloom, M. Burger, J. S. R. Asensio, et A. B. Cousins, « Carbon Dioxide Enrichment Inhibits Nitrate Assimilation in Wheat and Arabidopsis », Science, vol. 328, no 5980, p. 899‑903, mai 2010, doi : 10.1126/science.1186440.
[15] A. Wahid, S. Gelani, M. Ashraf, et M. Foolad, « Heat tolerance in plants : An overview », Environmental and Experimental Botany, vol. 61, no 3, p. 199‑223, déc. 2007, doi : 10.1016/j.envexpbot.2007.05.011.
[16] B. Li, K. Gao, H. Ren, et W. Tang, « Molecular mechanisms governing plant responses to high temperatures », Journal of Integrative Plant Biology, vol. 60, no 9, p. 757‑779, 2018, doi : 10.1111/jipb.12701.
[17] S. V. K. Jagadish, R. N. Bahuguna, M. Djanaguiraman, R. Gamuyao, P. V. V. Prasad, et P. Q. Craufurd, « Implications of High Temperature and Elevated CO2 on Flowering Time in Plants », Frontiers in Plant Science, vol. 7, 2016, Consulté le : 23 mars 2022. [En ligne]. Disponible sur : https://www.frontiersin.org/article/10.3389/fpls.2016.00913
[18] S. I. Allakhverdiev, V. D. Kreslavski, V. V. Klimov, D. A. Los, R. Carpentier, et P. Mohanty, « Heat stress : an overview of molecular responses in photosynthesis », Photosynth Res, vol. 98, no 1‑3, p. 541‑550, oct. 2008, doi : 10.1007/s11120-008-9331-0.
[19] E. Medina, S.-H. Kim, M. Yun, et W.-G. Choi, « Recapitulation of the Function and Role of ROS Generated in Response to Heat Stress in Plants », Plants, vol. 10, no 2, p. 371, févr. 2021, doi : 10.3390/plants10020371.
[20] W. Czarnocka et S. Karpiński, « Friend or foe ? Reactive oxygen species production, scavenging and signaling in plant response to environmental stresses », Free Radical Biology and Medicine, vol. 122, p. 4‑20, juill. 2018, doi : 10.1016/j.freeradbiomed.2018.01.011.
[21] S. R. Dunn, J. C. Thomason, M. D. A. Le Tissier, et J. C. Bythell, « Heat stress induces different forms of cell death in sea anemones and their endosymbiotic algae depending on temperature and duration », Cell Death Differ, vol. 11, no 11, p. 1213‑1222, nov. 2004, doi : 10.1038/sj.cdd.4401484.
[22] S. J. Crafts-Brandner et M. E. Salvucci, « Sensitivity of Photosynthesis in a C4 Plant, Maize, to Heat Stress », Plant Physiol, vol. 129, no 4, p. 1773‑1780, août 2002, doi : 10.1104/pp.002170.
[23] S. Kotak, J. Larkindale, U. Lee, P. von Koskull-Döring, E. Vierling, et K.-D. Scharf, « Complexity of the heat stress response in plants », Current Opinion in Plant Biology, vol. 10, no 3, p. 310‑316, juin 2007, doi : 10.1016/j.pbi.2007.04.011.
[24] M. F. Seleiman et al., « Drought Stress Impacts on Plants and Different Approaches to Alleviate Its Adverse Effects », Plants, vol. 10, no 2, Art. no 2, févr. 2021, doi : 10.3390/plants10020259.
[25] J. S. Boyer, « Leaf Enlargement and Metabolic Rates in Corn, Soybean, and Sunflower at Various Leaf Water Potentials », Plant Physiol., vol. 46, no 2, p. 233‑235, août 1970, doi : 10.1104/pp.46.2.233.
[26] S. M. Zargar et al., « Impact of drought on photosynthesis : Molecular perspective », Plant Gene, vol. 11, p. 154‑159, sept. 2017, doi : 10.1016/j.plgene.2017.04.003.
[27] L. Xu, L. Han, et B. Huang, « Membrane Fatty Acid Composition and Saturation Levels Associated with Leaf Dehydration Tolerance and Post-Drought Rehydration in Kentucky Bluegrass », Crop Science, vol. 51, no 1, p. 273‑281, 2011, doi : 10.2135/cropsci2010.06.0368.
[28] T. Degenkolbe et al., « Expression profiling of rice cultivars differing in their tolerance to long-term drought stress », Plant Mol Biol, vol. 69, no 1, p. 133‑153, janv. 2009, doi : 10.1007/s11103-008-9412-7.
[29] S. M. Shivaraj et al., « Dynamic role of aquaporin transport system under drought stress in plants », Environmental and Experimental Botany, vol. 184, p. 104367, avr. 2021, doi : 10.1016/j.envexpbot.2020.104367.
[30] A. A. Hoffmann et C. M. Sgrò, « Climate change and evolutionary adaptation », Nature, vol. 470, no 7335, p. 479‑485, févr. 2011, doi : 10.1038/nature09670.
[31] R. G. Shaw et J. R. Etterson, « Rapid climate change and the rate of adaptation : insight from experimental quantitative genetics », New Phytologist, vol. 195, no 4, p. 752‑765, 2012, doi : 10.1111/j.1469-8137.2012.04230.x.