Rappels sur le Sida et explications des mécanismes d'action des antirétroviraux. Efficacité et limites des trithérapies. Prévention des risques.
Introduction
Depuis le milieu des années 90, avec le développement par l’industrie pharmaceutique de molécules anti-VIH (antirétrovirales) autres que l’AZT, sont apparues les nouvelles stratégies de traitement de l’infection par le VIH (virus de l’immunodéficience humaine) connues sous de nom de trithérapies. Il s’agit d’associations de trois médicaments inhibant la réplication du VIH. Elles permettent de diminuer la quantité de virus circulant dans l’organisme (charge virale en nombre de copies du génome viral/mL de plasma) et surtout de faire remonter le nombre de lymphocytes T auxiliaires (taux de lymphocytes T CD4+ en nombre de cellules/mL de plasma) dont la raréfaction traduit l’affaiblissement du système immunitaire par le virus (immunodépression).
Par rapport aux monothérapies utilisant l’AZT seul, ces traitements sont d’une efficacité majeure et surtout durable, responsable de l’amélioration considérable de la survie des personnes infectées par le VIH. En rétablissant indirectement le fonctionnement immunitaire, ils préviennent l’apparition des maladies opportunistes (qui ne se développent que chez les immunodéprimés) caractéristiques du stade avancé de l’infection par le VIH et responsables de sa mortalité (stade Sida ou syndrome d’immunodéficience acquise).
Cependant, les trithérapies ne guérissent pas de l’infection par le VIH. Tout arrêt du traitement est suivi à plus ou moins court terme d’une réaugmentation de la charge virale et d’une rediminution des taux de lymphocytes T auxiliaires. De plus, ces médicaments sont responsables d’effets secondaires importants, souvent transitoires, mais aussi à long terme. Enfin, des résistances du virus aux différents médicaments peuvent apparaître au fil du traitement, d’autant plus que celui-ci est mal suivi.
Les trithérapies sont donc des traitements à vie, toujours contraignants et parfois pénibles, susceptibles de perdre leur efficacité. Ils ne dispensent en aucun cas des mesures de prévention de la transmission du VIH, essentiellement par l’utilisation de préservatif.
Ce document se compose de 7 parties. Pour chaque partie, les points fondamentaux sont résumés dans des encadrés « À retenir ».
Rappels sur la réplication du virus et l’histoire naturelle de l’infection par le VIH
Le cycle viral du VIH
Le VIH est un virus qui se multiplie dans les cellules porteuses de la protéine membranaire de surface appelée CD4, essentiellement les lymphocytes T auxiliaires ou CD4+ mais aussi les macrophages par exemple. Le virus interagit avec la cellule via la protéine CD4 grâce à la protéine virale appelée gp120, puis, par l’intermédiaire d’une autre protéine virale appelée gp41, l’enveloppe virale fusionne avec la membrane cellulaire. L’ARN viral est ensuite rétrotranscrit en ADN viral puis intégré au génome de la cellule infectée par deux protéines virales présentes dans la particule virale appelées transcriptase inverse et endonucléase. L’ARN génomique et les protéines des nouvelles particules virales sont synthétisés par la machinerie cellulaire. Ces protéines sont produites sous forme de polyprotéines qui sont ensuite clivées par une protéase virale pour libérer les protéines fonctionnelles.
À retenir
- Les protéines virales essentielles au déroulement du cycle viral.
- Les cibles potentielles pour des médicaments (gp120, gp41, transcriptase inverse, endonucléase, protéase).
Les stades de l’infection
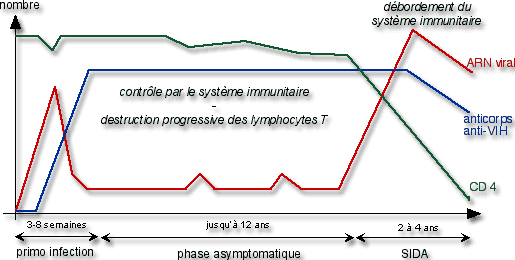
L’infection par le VIH est une infection chronique. Elle se découpe classiquement en 3 stades (Figure 1) :
- Le stade de primo-infection : après contamination par voie sanguine ou sexuelle, le système immunitaire tente d’éliminer le virus sans y parvenir. Des anticorps anti-VIH sont synthétisés qui sont détectés lors des sérologies de dépistage (séropositivité). Cette phase est accompagnée dans les 2/3 des cas de symptômes le plus souvent mineurs.
- Le stade asymptomatique : le virus se multiplie à bas bruit dans l’organisme au sein des lymphocytes T auxiliaires. Cette persistance du virus actif est responsable d’une désorganisation du système immunitaire marquée par une diminution lente du taux de CD4, qui passe progressivement de valeurs normales supérieures à 70 cellules/mL à des valeurs inférieures à 500 cellules/mL, parallèlement à une augmentation de la charge virale. Cette phase est de durée très variable avec une évolution totale de l’infection allant de 2 à 20 ans. Elle est caractérisée par l’absence de symptômes dus à l’infection et passe inaperçue si un dépistage sérologique n’est pas réalisé. Des maladies opportunistes dites mineures (candidoses buccales par exemple) commencent à apparaître signant la fin de la phase asymptomatique.
- Le stade Sida : lorsque la déplétion lymphocytaire devient profonde, des maladies opportunistes majeures se déclarent qui signent la phase évoluée de l’infection au VIH avec une immunodépression acquise sévère. La multiplication virale et la diminution du taux de CD4 s’accélèrent, précipitant l’évolution de l’infection. Ces maladies opportunistes sont le plus souvent des infections virales, bactériennes ou parasitaires, mais aussi des tumeurs, qui ne peuvent se développer que si le système immunitaire est très affaibli. Il s’agit de maladies très graves, ne survenant en règle que pour des taux de CD4 inférieurs à 500 cellules/mL. Le risque est en effet croissant en dessous de 350 cellules/mL, majeur en dessous de 200 cellules/mL. Elles sont très majoritairement responsables de la mortalité de l’infection par le VIH.
À retenir
- La découpe en trois phases de l’infection par le VIH.
- La définition de la séropositivité.
- L’évolution parallèle des marqueurs biologiques (charge virale et taux de CD4) qui permettent de suivre l’évolution de l’infection.
- La définition de la phase de Sida par l’apparition de maladies opportunistes majeures (graves).
Différentes classes d’antirétroviraux : de l’AZT aux inhibiteurs de fusion
Les antirétroviraux sont des molécules de synthèses de différentes natures chimiques regroupées en trois grandes classes selon leur mode d’action : deux classes d’inhibiteurs de la transcriptase inverse et une d’inhibiteurs de protéase. Une quatrième classe d’inhibiteurs de la fusion est actuellement en cours de développement.
Les inhibiteurs nucléosidiques de la transcriptase inverse (INTI)
L’AZT, azidothymidine ou zidovudine (Rétrovir®), qui fut en 1987 le premier médicament efficace dans le traitement du Sida, appartient à la classe des inhibiteurs nucléosidiques de la transcriptase inverse (INTI). Cette molécule a été développée initialement dans le cadre de la recherche de nouveaux agents antimitotiques anticancéreux. D’efficacité très modeste dans cette indication, l’AZT s’est révélé plus tard un inhibiteur efficace de la réplication du VIH.
Il s’agit d’un nucléoside analogue de la thymidine. Comme celle-ci, il est phosphorylé par la thymidine kinase cellulaire et transformé en nucléotide triphosphate. Cette étape est indispensable et nécessite un certain degré d’activité cellulaire. L’AZT triphosphate entre ensuite en compétition avec la thymidine triphosphate au niveau du site actif de la transcriptase inverse et bloque donc la synthèse de l’ADN viral. En effet, l’AZT est utilisé préférentiellement par la transcriptase inverse et très peu par les transcriptases cellulaires qu’il inhibe environ 100 fois moins. Il s’agit donc d’un inhibiteur compétitif relativement spécifique de la transcriptase inverse.
On observe un blocage de l’infection de la cellule par le virus mais l’activité des cellules de l’organisme est préservée. De par son mode d’action (blocage de l’infection des cellules), l’AZT empêche donc l’infection de nouvelles cellules mais est sans effet sur le réservoir de virus déjà intégrés.
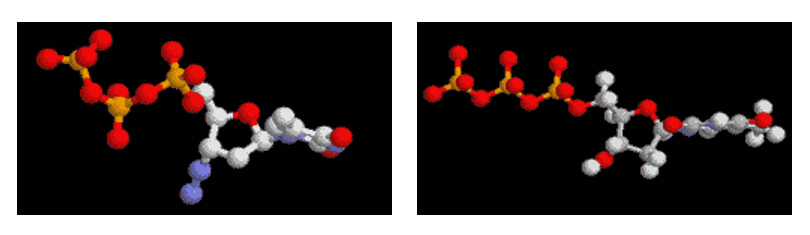
Modélisation tridimensionnelle des molécules d'AZT, à gauche, et de thymidine triphosphate (dTTP), à droite.
Vous pouvez télécharger les fichiers pdb pour une visualisation en 3D : fichier pdb de l'AZT, fichier pdb du dTTP.
Pour pouvoir les visualiser il faut avoir installé un logiciel de visualisation moléculaire 3D comme RasMol (page de téléchargement du logiciel) ou Rastop.
Les autres INTI qui peuvent être des analogues d’autres nucléosides cellulaires, ont un fonctionnement similaire. Il s’agit par exemple du ddI ou didanosine (Videx®) analogue de l’adénosine, et du 3TC ou lamivudine (Épivir®) analogue de la cytidine. Il existe 6 INTI commercialisés à ce jour. Un inhibiteur nucléotidique de mode d’action analogue, le ténofovir (VIREAD®), a été aussi développé.
Ces médicaments sont actifs sur les deux types de virus VIH-1 (le plus répandu) et VIH-2 (virus de sérotype et génotype différent, isolé initialement en Afrique).
Les inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI)
Les inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI) ne sont pas des analogues compétitifs de nucléosides. Ils ne rentrent pas non plus en compétition avec l’ARN génomique viral au niveau du site actif de l’enzyme. Ces molécules se fixent sur des acides aminés de l’enzyme, à proximité du site catalytique dont ils modifient la structure, ce qui rend l’enzyme inactive.
Ces médicaments agissent sans interférer directement avec les substrats de l’enzyme, ce sont donc des inhibiteurs non compétitifs. Ils sont spécifiques de la transcriptase inverse du VIH-1 et donc inactifs sur le VIH-2. L’action sur le cours de l’infection est la même que celle des INTI. Il s’agit des névirapine (Viramune®), delavirdine (Rescriptor®) et éfavirenz (Sustiva®).
Commentaire de l'animation
La fixation d’un INNTI (l’éfavirenz) sur la transcriptase inverse modifie la structure de son site actif. Ceci a pour conséquence de l’inhiber.
A : Transcriptase inverse et éfavirenz.
B : Transcriptase inverse sans inhibiteur (et ADN double brin).
La transcriptase inverse est formée de deux sous-unités (chaînes A et B dans les fichiers pdb ci-dessous). Les fichiers en téléchargement ci-dessous correspondent aux molécules suivantes :
- 2HMI : transcriptase inverse sauvage. Elle est ici associée à un ADN double brin au niveau du site actif. Un fragment d’anticorps (Fab) est présent à l’autre extrémité de la transcriptase inverse.
- 1IKW : transcriptase inverse associée à l’éfavirenz, un inhibiteur qui agit en modifiant la structure tridimensionnelle de son site actif.
Les inhibiteurs de protéase
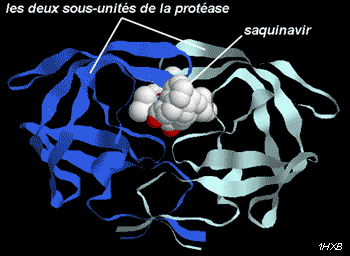
Les inhibiteurs de la protéase virale (antiprotéases) comme le saquinavir (Invirase®) sont des molécules de nature encore différente qui ciblent une autre étape du cycle viral. Développé par génie biochimique à partir de la structure tridimensionnelle de la protéase, le saquinavir est un pseudopeptide (nature chimique proche du peptide avec structure similaire) analogue structural de la séquence peptidique du site de clivage reconnue par la protéase. Il s’insère au site catalytique, à l’interface entre les deux sous unités du dimère qui constitue l’enzyme, et bloque son activité protéolytique de façon sélective et réversible. Son activité sur les protéases humaines analogues est environ 50 000 fois plus faible.
La fixation du saquinavir au niveau du site actif de la protéase du VIH se fait à l’interface entre les deux sous-unités. Elle a pour effet d’inhiber cette enzyme.
En présence d’antiprotéase, la maturation des précurseurs des protéines constitutives de la particule virale est donc impossible, ce qui bloque la formation des particules virales ou engendre des particules incomplètes et non infectieuses. Leur action se situe en aval de celle des inhibiteurs de transcriptase inverse. Il existe six antiprotéases commercialisées à ce jour.
Les inhibiteurs de la fusion
De nouveaux médicaments qui visent à bloquer une nouvelle étape du cycle viral en empêchant la pénétration du virus dans la cellule sont actuellement en cours de développement. Il s’agit entre autre des inhibiteurs de fusion.
Une molécule est en phase finale de développement : le T20 (Pentafuside). Il s’agit d’un polypeptide de 36 acides aminés qui se fixe sur la gp41 et bloque son activité fusiogène. Le T20 est spécifique du VIH-1. Il existe d’autres inhibiteurs de fusion en cours de développement ainsi que des molécules bloquant d’autres étapes de la pénétration du virus dans la cellule.
Les antirétroviraux sont le plus souvent administrés par voie orale sauf le T20 dont la nature polypeptidique oblige l’injection sous cutanée (comme l’insuline, le T20 serait détruit par les enzymes digestives en cas d’administration par voie orale).
À retenir
- La notion d’inhibiteur compétitif et non compétitif d’une enzyme.
- L’intérêt de la connaissance de la structure tridimensionnelle des enzymes des micro-organismes pathogènes pour le développement par génie biochimique de médicaments inhibiteurs spécifiques (anti-protéases).
- L’importance de la spécificité des médicaments inhibiteurs enzymatiques pour l’enzyme virale par rapport aux enzymes cellulaires analogues afin de limiter leur toxicité vis-à-vis des cellules de l’organisme (balance toxicité/efficacité valable pour tous les médicaments).
- Les étapes et les enzymes du cycle viral ciblées par les médicaments antirétroviraux (essentiellement transcriptase inverse et protéase).
- L’inaccessibilité des virus intégrés dans le génome des cellules de l’organisme.
Intérêt des associations d’antirétroviraux : les trithérapies
L’échec des monothérapies
Le traitement par un seul antirétroviral n’est pas efficace pour contrôler la maladie et induire une amélioration durable du statut immunitaire des malades et donc de leur état de santé. Le délai de mise en échec du traitement par monothérapie (développement de résistance virale), variable selon les définitions, est toujours court. Il dépend du type d’antirétroviral : il est plus long pour l’AZT ou zidovudine (8-12 mois) et les autres INTI que pour les INNTI comme la nevirapine (1 mois) ou les antiprotéases pour lesquels il est très court.
Une solution : associations de traitements et trithérapies
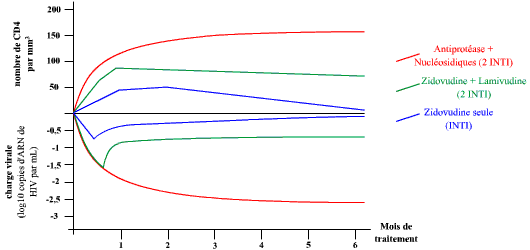
Des études cliniques (essais thérapeutiques) ont montré qu’une efficacité durable et majeure ne pouvait être obtenue que par l’association d’au moins trois antirétroviraux. La comparaison d’une monothérapie à l’AZT, d’une bithérapie aux INTI et d’une trithérapie 2 INTI + 1 antiprotéase, en termes d’augmentation du taux de CD4 (rétablissement de la fonction immunitaire) et de diminution de la charge virale (contrôle de la réplication) au cours du traitement, montre une efficacité plus importante et plus durable de la trithérapie.
Les valeurs données correspondent aux variations observées par rapport au début du traitement. Trois traitements ont été menés pendant six mois : une monothérapie (zidovudine seule), une bithérapie et une trithérapie. La monothérapie et la bithérapie n’ont un effet que transitoire, alors que la trithérapie semble avoir un effet bénéfique plus important et plus stable.
Ce résultat expérimental démontre l’intérêt d’une association d’au moins trois antirétroviraux.
D’après Havlir et al. Viral Dynamics of HIV : implications for drug development and therapeutic strategies. Ann. Int. Med. 1996 ; 124 : 984-94.
Il existe une synergie d’action des trois médicaments (effet supérieur à l’addition simple des effets en monothérapie). Les améliorations biologiques (charge virale, taux de CD4) observées sous trithérapie corrèlent avec une amélioration de l’état de santé des patients, une régression des maladies opportunistes et une diminution de la mortalité.
Ce schéma thérapeutique apparu en 1996 avec les antiprotéases et consistant à « taper très fort » avec une association de médicaments très actifs est à la base des trithérapies antirétrovirales actuelles.
Trithérapies actuelles
À l’heure actuelle, il a été montré que l’on pouvait associer de façon efficace en trithérapie :
- 3 INTI ;
- 2 INTI + 1 INNTI ;
- 2 INTI + 1 antiprotéase.
Le choix de l’une ou l’autre des associations possibles est complexe et relève de l’analyse de la situation du malade par le médecin. L’AZT, pourtant le plus vieux des antirétroviraux utilisés, reste encore fréquemment utilisé dans les trithérapies.
Des limites aux trithérapies
Les trithérapies ont une capacité réelle :
- à améliorer l’état de santé des malades, qui peuvent souvent reprendre une vie normale ;
- à rétablir une fonction immunitaire satisfaisante, avec des taux de CD4 subnormaux ;
- et à contrôler la réplication virale, avec des charges virales qui peuvent souvent devenir indétectables par les techniques actuelles.
Les trithérapies ne guérissent cependant pas de l’infection par le VIH. Cela reste vrai quel que soit l’association de molécules, agissant parfois à plusieurs étapes du cycle viral avec un effet additif et synergique. Tout arrêt du traitement est suivi à plus ou moins court terme d’une réaugmentation de la charge virale et d’une rediminution des taux de lymphocytes T auxiliaires avec la réapparition d’une immunodépression. Les trithérapies sont donc des traitements au long cours, à l’heure actuelle à vie. Par ailleurs, des effets secondaires importants en rendent l’utilisation souvent pénible pour les malades. Enfin, leur efficacité peut être remise en cause par l’émergence de résistance du virus par mutation.
À retenir
- Les trithérapies sont l’association, pour une efficacité majeure et durable, de trois antirétroviraux à efficacité limitée et transitoire quand ils sont utilisés seuls.
- Les trithérapies, en limitant durablement la réplication du virus, rétablissent au moins partiellement le fonctionnement du système immunitaire et donc limitent l’apparition des maladies opportunistes qui font toute la gravité de l’infection par le VIH.
- Les trithérapies ne guérissent pas l’infection par le VIH.
Effets secondaires des trithérapies : la difficulté de l’observance du traitement
Les antirétroviraux ne sont pas des médicaments anodins. Ils présentent tous une certaine toxicité pour l’organisme, responsable d’effets secondaires ou indésirables plus ou moins marqués à court et à moyen-long terme. Ces effets secondaires sont variés, bénins ou graves, et diffèrent selon le moment de leur apparition et la classe ou le type de molécule utilisée. Ils peuvent justifier l’arrêt d’un des antirétroviraux de la trithérapie et son remplacement par un autre.
Les effets secondaires à court terme comme les nausées, troubles digestifs, vertiges et cauchemars sont parfois très gênants mais disparaissent le plus souvent en quelques semaines. Les effets à moyen terme, comme la toxicité mitochondriale des INTI (atteinte des tissus riches en mitochondries comme le foie ou les nerfs), ou à long terme, comme les troubles du métabolisme des lipides avec modification inesthétique de la répartition des graisses (trithérapies en général), sont eux le plus souvent permanents.
Par ailleurs, les trithérapies sont des traitements lourds qui demandent la prise de nombreuses pilules ou gélules, parfois trois fois par jour, malgré des efforts des pharmaciens et médecins pour diminuer le nombre de prises nécessaires. Le suivi médical est rapproché, une aide psychologique est souvent proposée.
Ces éléments concourent à rendre difficile sur le long terme le suivi du traitement (observance) par les malades. Cette bonne observance est néanmoins capitale, car c’est un facteur de bonne efficacité du traitement, de limitation de l’émergence de mutations de résistance et de bonne tolérance à moyen-long terme (de nombreux effets secondaires n’étant que temporaires).
À retenir
- La toxicité des antirétroviraux des trithérapies au long cours dont les causes sont multiples, entre autres l’interaction avec les protéines enzymatiques cellulaires.
- La difficulté d’observance du traitement par trithérapie.
L’émergence de résistance virale aux trithérapies : des mutations adaptatrices
L’apparition de résistances
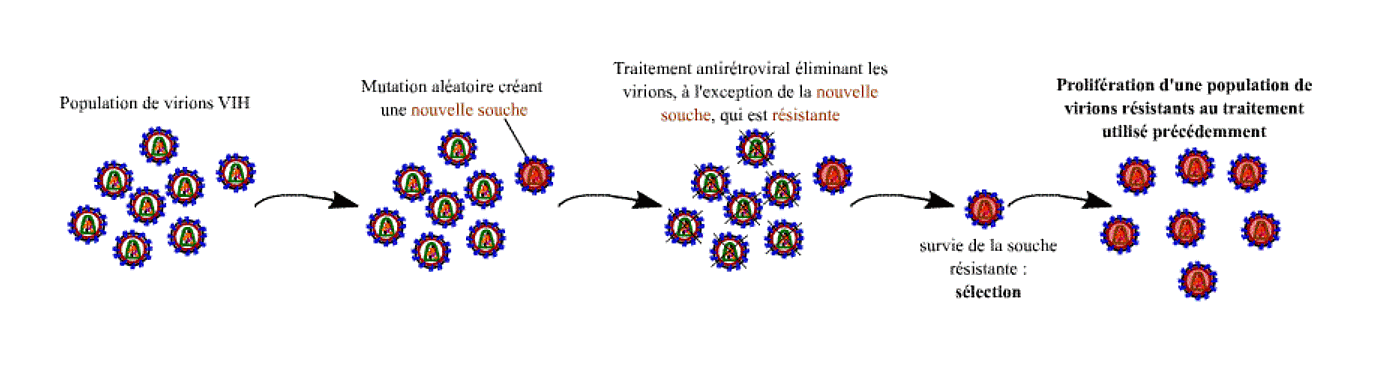
La perte d’efficacité rapide des monothérapies antirétrovirales est due à l’émergence de résistances virales c’est-à-dire que des doses normales de la molécule anciennement efficace n’arrivent plus à inhiber la réplication du virus. Cette résistance phénotypique est le résultat d’une modification génotypique, apparue par mutations, de l’enzyme ciblée par le médicament utilisé (transcriptase inverse ou protéase) et lui permettant de fonctionner en présence de cet inhibiteur.
Il s’agit de mutations spontanées aléatoires qui sont conservées (sélectionnées) parce qu’elles permettent aux virus qui les portent de se multiplier alors que les autres sont bloqués par le traitement. Les virus résistants deviennent alors rapidement majoritaires dans l’organisme.
L’apparition de mutations permet de sélectionner des souches résistantes au traitement appliqué.
Ces mutations se produisent lors des étapes de réplication du génome viral. La transcriptase inverse étant une enzyme peu fiable, en moyenne responsable d’une mutation à chaque cycle de réplication, elle génère une grande diversité mutationnelle au sein de la population de virus, ce qui explique la rapidité de l’apparition de résistance. Cette apparition est donc d’autant plus rapide que le virus continue à se multiplier malgré le traitement.
On comprend donc que l’association de plusieurs médicaments limite l’émergence de résistance. Lorsqu’un virus résistant à un des antirétroviraux de l’association apparaît, sa multiplication est bloquée par un des autres. La fréquence d’émergence de résistance au cours d’une période donnée (incidence) diminue sensiblement lorsque trois molécules sont associées selon les modalités des trithérapies actuelles.
L’incidence des résistances
Cette incidence est cependant non négligeable et des circonstances particulières peuvent l’augmenter. En autorisant une réplication à bas bruit du virus, la mauvaise observance du traitement favorise l’émergence de résistance à un ou plusieurs des antirétroviraux. De même, une charge virale très importante, témoignant d’une réplication intense en phase finale de l’infection par exemple, est une situation à risque d’apparition de résistance. Par ailleurs, la probabilité de voir apparaître une résistance augmente avec la durée du traitement.
L’acquisition d’une résistance à un antirétroviral utilisé en mono ou en trithérapie se traduit parfois par une résistance aux autres antirétroviraux de la même classe alors qu’ils n’ont jamais été utilisés contre cette souche virale (population de virus isolée chez un malade). Cette résistance croisée est décrite au sein des INTI, des INNTI et des antiprotéases. Elle pourrait exister entre INTI et INNTI, mais ce type de résistance reste à documenter. Elle est par contre a priori impossible entre inhibiteurs de la transcriptase inverse et antiprotéase, puisque la modification de l’une des enzymes est sans effet sur l’autre.
Explication moléculaire
À l’échelle moléculaire, l’acquisition d’une résistance à un antirétroviral se traduit par la substitution d’un ou plusieurs acides aminés de la protéine virale visée par celui-ci. Certaines de ces substitutions sont responsables d’une perte d’affinité de l’enzyme pour l’inhibiteur dont l’effet s’amenuise voire disparaît.
En comparant les gènes de la transcriptase inverse ou de la protéase de souches résistantes à un antirétroviral on met en évidence des mutations récurrentes caractéristiques de l’acquisition de cette résistance. Une seule substitution est rarement suffisante pour induire une résistance significative et on observe souvent plusieurs mutations associées. Ces mutations apparaissent de façon aléatoire et probablement séquentielle (les unes après les autres).
De la même façon, on a pu déterminer les mutations responsables de résistances croisées entre molécules d’une même classe.
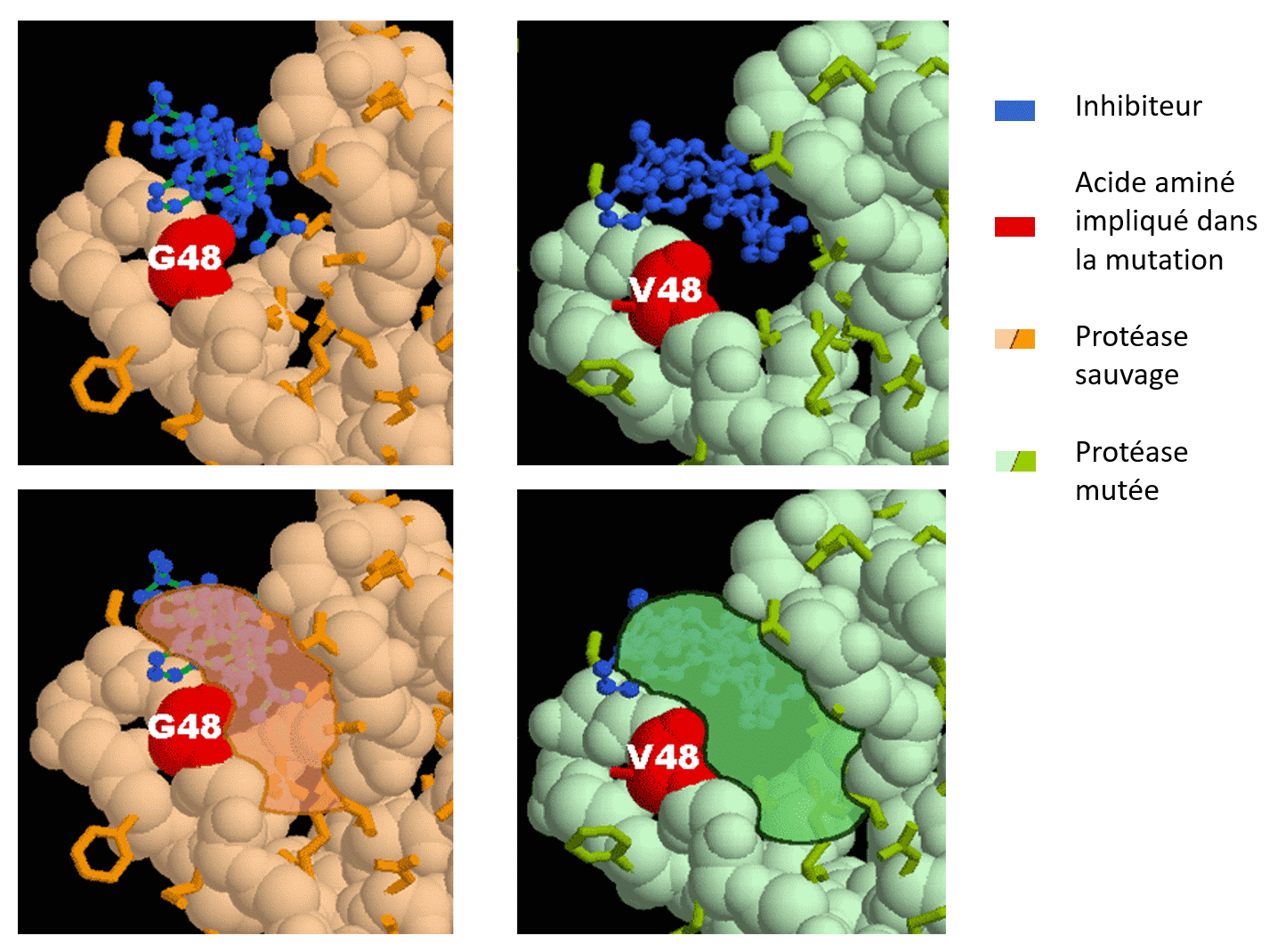
Protéase sauvage du VIH-1 associé à l’inhibiteur (en haut, à gauche) et protéase mutée du VIH-1 associée de manière plus lâche au saquinavir (en haut, à droite). Les images correspondantes, en bas, font apparaître (de manière approximative) la poche du site actif.
Le saquinovir est un inhibiteur de la protéase du VIH-1. Il agit en se fixant au niveau du site actif de cette enzyme. Des études structurales ont permis de démontrer que la mutation de la glycine 48 de cette protéase (G48 sur la figure de gauche) en une valine (V48 sur la figure de droite) a d’importantes conséquences au niveau de la fixation de l’inhibiteur : le saquinovir (en bleu sur la figure) se fixe toujours au niveau du site actif, mais de manière bien plus lâche. La comparaison des deux figures permet de distinguer clairement que l’inhibiteur est plus éloigné de la protéine chez le mutant (figure de droite) que chez le sauvage (figure de gauche). Il apparaît ainsi que la mutation G48V (glycine mutée en valine) se traduit par une résistance de la protéase à l’action du saquinovir.
La lutte contre la résistance
La connaissance de ces mutations caractéristiques de la résistance à un ou plusieurs antirétroviraux permet, en inversant le raisonnement, de prévoir le type de résistance phénotypique présenté par une souche virale à partir de la connaissance de son génotype (séquence des gènes de transcriptase inverse et de protéase). Cette démarche est utilisée en pratique pour adapter les traitements.
La lutte contre l’émergence de souches virales résistantes passe par la limitation des situations à risque que sont les mono ou bithérapies, la mauvaise observance des traitements et les sous-dosages en médicament (mauvaise absorption digestive par exemple). Ces résistances sont contrées par la modification de l’association antirétrovirale de la trithérapie. Cependant, cette course avec le virus peut devenir très complexe avec l’accumulation des résistances, en particulier croisées, justifiant le passage à une quadri voir pentathérapie (4 ou 5 antirétroviraux associés).
Face à ces souches dites multirésistantes, les nouveaux antirétroviraux sont probablement une solution au moins temporaire. À l’inverse, les virus multirésistants sont souvent moins virulents (réplication moins rapide) ce qui traduit l’accumulation de mutations dans son génome et en particulier dans les enzymes ciblées par les médicaments (baisse d’efficacité enzymatique) : la résistance a un coût pour le virus.
À retenir
- Le problème majeur de la résistance virale.
- La séquence mutation – sélection est à l’origine de l’émergence des phénotypes de résistance.
- Le rôle de la faible fidélité de la transcriptase inverse dans la genèse d’une diversité mutationnelle (variabilité du virus).
- Un mécanisme moléculaire majeur de la résistance : substitution d’acides aminés de l’enzyme et perte d’affinité pour l’inhibiteur.
- L’importance de l’observance du traitement dans la limitation de l’émergence de résistance (valable aussi pour les traitements antibiotiques antibactériens).
- Le coût de la résistance pour le virus.
Indication du traitement : un problème médical complexe
La trithérapie : dans quelles situations ?
La mise en route d’une trithérapie dans le cadre d’une infection avérée ou possible par le VIH est un problème médical souvent complexe. Il relève des compétences d’un médecin spécialisé qui s’appuie sur des recommandations d’experts, régulièrement mises à jour en fonction des données d’essais thérapeutiques. Elle est envisagée :
- devant une primo-infection avérée (efficacité en cours d’évaluation) ;
- lors de la naissance d’un bébé de mère séropositive (l’AZT durant l’accouchement par césarienne a considérablement réduit le risque de transmission) ;
- en prophylaxie (traitement préventif) après exposition sexuelle ou à un produit sanguin ;
- et bien sûr au cours de l’infection chronique à VIH.
Grossièrement, les pratiques actuelles consistent à commencer les traitements de l’infection chronique « ni trop tôt, ni trop tard ». Ces stratégies tiennent compte de la pénibilité au long cours du traitement, responsable d’une observance souvent médiocre, et facteur de risque de l’apparition de résistances qui risquent à terme de mettre en échec les traitements disponibles.
Elles intègrent aussi les éléments qui donnent à penser que le contrôle de la maladie et de l’équilibre immunitaire pourrait bénéficier d’un traitement antirétroviral précoce. La présence de symptômes de l’infection, essentiellement les maladies opportunistes, ou un taux de CD4 inférieur à 200 cellules/mL justifient de débuter une trithérapie. Entre 200 et 350 CD4/mL, la décision dépend de la charge virale et de l’évolution des marqueurs biologiques.
La prise en charge des patients atteints du Sida
La prise en charge médicamenteuse des patients ne se limite pas aux trithérapies. En particulier, lors de maladies opportunistes graves comme certaines infections, l’urgence est aux traitements anti-infectieux spécifiques de l’infection opportuniste avec par exemple des antibiotiques ou des antiviraux.
Les trithérapies sont des traitements coûteux (plus de 760 € par mois environ, en 2000) ce qui explique les débats internationaux sur le prix de vente des antirétroviraux par les firmes pharmaceutiques. En effet, les pays en voie de développement, en particulier africains, sont les plus touchés par la pandémie sidéenne et le coût de ces médicaments est une des causes principales limitant l’accès de ces populations à des thérapeutiques antirétrovirales efficaces. Un équilibre est donc à trouver entre les besoins en médicaments des malades les plus pauvres et le retour sur investissement des firmes pharmaceutiques qui ont développé souvent à grands frais les antirétroviraux.
À retenir
- La décision médicale de débuter une trithérapie est fondée sur des résultats d’études thérapeutiques (essais cliniques) fréquemment réactualisés.
- Le coût des trithérapies et le problème de santé international qui en résulte.
Rappel sur les mesures de prévention de la transmission du VIH
L’efficacité des trithérapies ne doit pas faire oublier que la mesure de lutte la plus efficace contre la pandémie sidéenne reste la prévention de la transmission, ceci d’autant plus que les trithérapies sont des traitements non curatifs, pénibles et dont l’efficacité à long terme n’est pas garantie.
La prévention de la transmission repose sur la mise en œuvre de mesures de santé publique et sur l’éducation à la santé avec :
- Le dépistage de la séropositivité VIH proposé par le médecin dans les situations à risque ou de façon libre dans les centres de dépistage, de façon anonyme et gratuite.
- La prévention de la transmission sexuelle par utilisation du préservatif proposé par le médecin dans les situations à risque et surtout dans le cadre de campagne de sensibilisation auprès de populations fragiles comme les adolescents et les jeunes adultes. Cette éducation au préservatif va de pair avec celle au dépistage de la séropositivité VIH pour une utilisation efficace et adaptée à la vie sexuelle des personnes. L’utilisation du préservatif est par ailleurs le moyen de prévention de la transmission des autres maladies sexuellement transmissibles (MST), entre autres les infections génitales bactériennes responsables de stérilité féminine.
- La prévention de la transmission sanguine par sécurisation des produits sanguins à transfuser (risque résiduel actuel infime de 1/1 300 000), accès aux seringues à usage unique et campagnes de sevrage par substitution chez le toxicomane intraveineux, mesures de précautions universelles lors des accidents d’exposition au sang…
- La prévention de la transmission materno-fœtale lors de l’accouchement (AZT intraveineux et césarienne systématique).
Conclusion
Les travaux fondamentaux réalisés depuis la découverte du VIH en 1983 ont permis le développement en un temps record de molécules potentiellement très efficaces pour lutter contre l’infection en bloquant des étapes clefs du cycle viral.
L’utilisation de ces nouveaux médicaments a nécessité l’élaboration de stratégies thérapeutiques adaptées afin d’obtenir l’efficacité optimale et de contrer au mieux les mécanismes de défense du virus. Les trithérapies sont donc le résultat d’un investissement humain impressionnant tant en termes scientifique et médical qu’économique et industriel. Elles ont suscité un espoir important chez les malades mais aussi dans la population qui a vu dans ces nouveaux traitements une étape décisive dans la lutte contre la pandémie de VIH.
Cependant, et malgré un bénéfice indéniable pour la prise en charge des malades, les trithérapies ne garantissent pas à l’heure actuelle l’évolution favorable à long terme des malades traités. De même elles ne pourront pas résoudre à elles seules le problème de santé mondiale que constitue le Sida. Le développement de nouvelles modalités thérapeutiques et le renforcement des mesures de prévention de la transmission du virus restent donc plus que jamais d’actualité.