La prolactine supprime les cycles ovariens des souris allaitantes en réprimant directement l’activité d’une population cellulaire connue sous le nom de neurones à kisspeptine.
La production de lait exige beaucoup d’énergie de la part de l’organisme, tout comme les soins apportés aux louveteaux, aux chatons, aux chiots ou aux bébés qui viennent de naître. Chez de nombreux mammifères, les femelles allaitantes sont peu fertiles, empêchant ainsi les charges physiques de la grossesse de se produire à un moment aussi exigeant 1. Cela se traduit par un arrêt des cycles menstruels ou œstraux, qui sont sous l’influence d’une région du cerveau, l’hypothalamus.
Au cours d’un cycle fertile, des réseaux cellulaires complexes convergent pour contrôler une petite population de neurones de l’hypothalamus qui produisent l’hormone de libération des gonadotrophines (ou GnRH) de manière pulsatile. Ce signal stimule l’hypophyse, située sous le cerveau, qui libère des pulses d’hormone lutéinisante (ou LH), laquelle circule dans le sang pour contrôler le fonctionnement des ovaires. Pendant la lactation, la sécrétion de GnRH ainsi que celle de LH s'arrêtent, ce qui entraîne l’absence de cycles ovariens 2. Cependant, le mécanisme sous-jacent précis qui contrôle ce type d’infertilité – connu sous le nom d’aménorrhée lactationnelle – n’est pas encore totalement compris.
Après la naissance, la tétée est un stimulus qui induit la libération de grandes quantités de prolactine par l’hypophyse 3. Cette hormone agit sur divers tissus centraux et périphériques pour stimuler la production de lait, réguler la prise de nourriture et, comme le montrent les études animales, réduire le stress et favoriser le comportement maternel 4. On pense également que des niveaux élevés de prolactine répriment la production de LH pendant la lactation, car de tels taux sont une cause bien établie d’infertilité masculine et féminine ; en fait, traiter des rongeurs avec de la prolactine suffit à supprimer la sécrétion de LH 5. Cependant, d’autres mécanismes pourraient également être en jeu, tels que des voies nerveuses directement activées par la tétée ou l’augmentation des taux d’autres hormones 6. Définir l’importance relative de la prolactine dans la suppression de la sécrétion de LH et de la fertilité pendant la lactation a donc été un défi jusqu’à maintenant. Aujourd’hui, dans eLife, David Grattan de l’université d’Otago et ses collègues – dont Eleni Hackwell en tant que première autrice – publient de nouvelles informations sur la façon dont la prolactine agit sur les réseaux neuronaux contrôlant les cycles ovariens 7.
Les chercheurs, qui travaillent dans des instituts de Nouvelle-Zélande, d’Allemagne et du Royaume-Uni, ont commencé par concevoir une lignée de souris génétiquement modifiées dans laquelle le récepteur de la prolactine est absent des neurones. Chez ces animaux, les pulses de LH et les cycles œstraux se rétablissent prématurément au début de la lactation, ce qui confirme l’hypothèse selon laquelle les récepteurs cérébraux de la prolactine sont nécessaires pour supprimer la libération de GnRH et de LH ainsi que la fertilité pendant la lactation. Cependant, seule une proportion infime des neurones à GnRH exprime le récepteur de la prolactine, ce qui suggère qu’une autre population neuronale est impliquée « en amont » dans le mécanisme de baisse de la fertilité induit par la prolactine 8.
Pour explorer cette possibilité, Hackwell et coll. se sont concentrés sur un groupe de neurones dans le noyau arqué de l’hypothalamus, qui a récemment été reconnu comme le « générateur de pulses de GnRH » recherché depuis longtemps. Ces cellules produisent un régulateur essentiel de l’axe reproducteur, la kisspeptine, et présentent une activité synchronisée immédiatement avant un pulse de LH 910. L’inhibition de ces neurones ou la suppression de la kisspeptine suffit à supprimer les pulses de GnRH et de LH ; à l’inverse, la stimulation de la libération de kisspeptine par ces cellules peut augmenter l’activité des neurones à GnRH et induire un pulse de LH 1112.
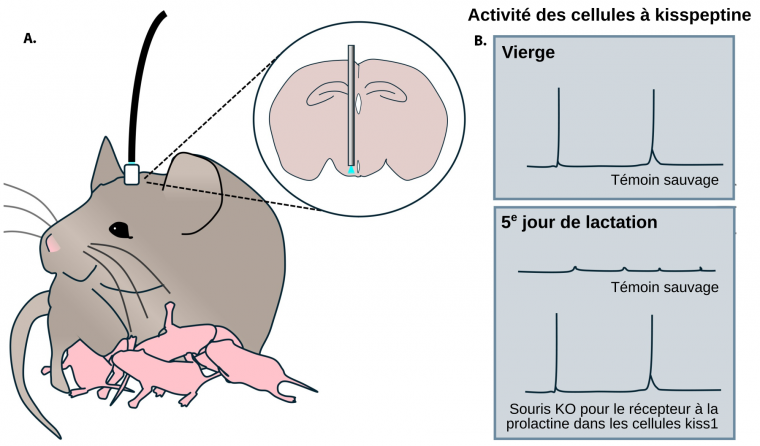
L’équipe a utilisé la photométrie à fibres pour enregistrer l’activité des neurones à kisspeptine du noyau arqué chez des souris libres de leurs mouvements et qui avaient été génétiquement modifiées pour exprimer un marqueur fluorescent lorsque ces cellules sont actives (Figure 1A). Hackwell et coll. ont ainsi pu établir que ces neurones présentent des épisodes d’activité synchrones avec les pulses de LH chez les animaux vierges alors qu’ils sont inactifs pendant la grossesse et la lactation (Figure 1B). Il est frappant de constater que l’activité pulsatile de la LH et les cycles ovariens sont revenus dès le début de la lactation chez les souris dont le récepteur de la prolactine avait été supprimé de manière conditionnelle des cellules à kisspeptine (Figure 1B). La fertilité a été rétablie encore plus tôt lorsque le récepteur de la prolactine était absent de tous les neurones. Étant donné que cette approche de knock-out n’a pas affecté d’autres mécanismes supposés abaisser la production de LH pendant la lactation, tels que d’éventuelles voies nerveuses activées par la tétée, ces résultats soutiennent fortement l’idée que la prolactine est le principal facteur qui induit l’aménorrhée lactationnelle chez la souris.
A. Des souris ont été manipulées génétiquement pour que les neurones à kisspeptine du noyau arqué produisent un indicateur fluorescent qui émet de la lumière (bleue) lorsque la cellule est active. Ce signal peut être détecté par une fibre optique implantée dans l’animal (tige grise dans l’encadré) et relayée à un système de photométrie (câble noir).
B. Une activité pulsatile des neurones à kisspeptine peut être détectée chez les souris vierges, mais pas pendant la lactation. En revanche, cette activité est présente chez les souris allaitantes chez lesquelles le récepteur de la prolactine a été génétiquement supprimé des cellules à kisspeptine (kiss1).
Dans l’ensemble, les travaux de Hackwell et coll. mettent en évidence les neurones à kisspeptine du noyau arqué comme étant le site primaire de l’action de la prolactine pendant la lactation, ce qui fait progresser de manière significative notre compréhension des mécanismes qui sous-tendent l’aménorrhée lactationnelle. En révélant que les cycles ovariens reviennent plus tôt lorsque les récepteurs de la prolactine sont absents de tous les neurones, ils suggèrent également que d’autres populations de cellules sensibles à la prolactine sont impliquées. Parmi les populations candidates, il existe un ensemble de neurones à kisspeptine situés dans le noyau périventriculaire rostral et qui sont responsables de la génération de la poussée de LH qui entraîne l’ovulation. Des recherches complémentaires restent toutefois nécessaires.
Ce texte correspond à la traduction par Valérie Boutin de l’article intitulé Lactation: How to pause fertility, écrit par Aleisha M Moore et paru en 2024 dans la revue eLife 1. La relecture de la traduction a été assurée par Vincent Prévot.