Les progrès dans le développement de nouvelles méthodes de contraception masculine réversible ont été lents. S’il a été clairement démontré que l’approche hormonale est capable de fournir une contraception efficace et réversible, aucun produit n’est disponible sur le marché pour le moment. Actuellement, des essais sont en cours sur un gel autoadministré associant testostérone et Nestorone (un progestatif) ainsi que sur d’autres méthodes étudiées depuis plus longtemps et disponibles essentiellement sous forme injectable. De nouveaux stéroïdes à action prolongée, dotés d’une activité androgénique et progestative, font également l’objet d’essais cliniques. Les approches non hormonales agissent sur la spermatogenèse, sur la maturation des spermatozoïdes dans l’épididyme ou encore au niveau du canal déférent, mais elles restent au stade des essais précliniques. Les enquêtes indiquent que les hommes et leurs partenaires sont prêts à utiliser de nouvelles méthodes de contraception masculine, mais ils n’ont pas cette possibilité pour le moment.
Ce texte correspond à la traduction par Pascal Combemorel de l’article intitulé Male contraception: where are we going and where have we been?, écrit par John Joseph Reynolds-Wright et Richard A. Anderson et paru en 2019 dans la revue BMJ Sexual & Reproductive Health [1]. Les notes de bas de page sont du fait du traducteur. La figure 1 originale a été remplacée par une autre figure, afin de montrer le principe de fonctionnement de la contraception hormonale. Pour certaines des molécules citées, des liens hypertextes ont été ajoutés vers le site PubChem, une base de données chimiques. Un dossier contenant ces molécules est disponible en téléchargement à la fin de l’article.
La relecture de la traduction a été assurée par Jeanne Perrin, médecin et professeure de médecine et biologie de la reproduction et du développement à l’université d’Aix-Marseille, responsable de la formation en contraception masculine de la société d’andrologie de langue française (SALF). Elle est en particulier coautrice d’une récente revue de synthèse : Contraception masculine : quelles (r)évolutions ?
Introduction
En Grande-Bretagne, la Faculté des soins de santé sexuelle et reproductive a déclaré qu’il fallait donner accès aux patients à une gamme complète d’options contraceptives. Pour les hommes, ces options sont actuellement limitées aux préservatifs et à la vasectomie1. Ces deux méthodes ont leurs avantages : le préservatif joue un rôle essentiel dans la prévention des infections et constitue une méthode de contraception largement utilisée et facilement accessible ; la vasectomie est une méthode de contraception permanente très efficace. Cependant, elles ne sont suffisantes ni pour de nombreux hommes sexuellement actifs qui veulent avoir le contrôle de leur fertilité, ni pour leurs partenaires qui souhaitent partager la charge de la contraception. La stérilisation et les préservatifs ne sont pas suffisants pour permettre aux femmes de maîtriser leur fertilité, et le fait de disposer d’une large palette d’outils contraceptifs permet à un plus grand nombre de couples de mieux contrôler leur reproduction. Cette revue aidera les cliniciens à connaître les contraceptifs masculins qui pourraient être commercialisés à moyen terme.
Le parcours d’un spermatozoïde
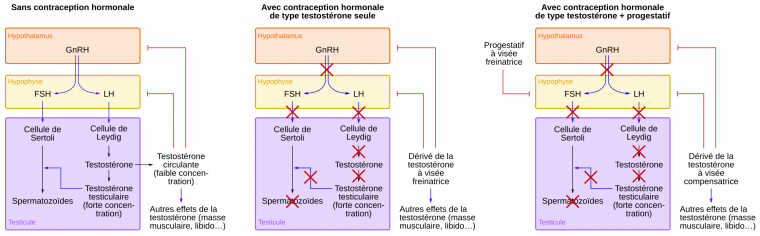
La spermatogenèse commence dans le cerveau. L’hypothalamus sécrète l’hormone de libération des gonadotrophines hypophysaires (GnRH, gonadotropin releasing hormone), qui stimule à son tour l’hypophyse antérieure pour qu’elle libère l’hormone lutéinisante (LH, luteinising hormone) et l’hormone folliculostimulante (FSH, follicle stimulating hormone). Ces hormones agissent ensuite sur les cellules de Leydig et de Sertoli dans le testicule (Figure 1).
Les cellules de Leydig produisent la testostérone, qui est sécrétée dans la circulation sanguine. La testostérone sérique soutient un large éventail de fonctions masculines et est un élément clé de la boucle de rétrocontrôle négatif qui régule la production de GnRH et de gonadotrophines (LH et FSH). La concentration de testostérone est environ quarante fois plus élevée dans les testicules que dans le sang et cette forte concentration est nécessaire aux cellules de Sertoli pour la spermatogenèse [3].
À gauche. Sans contraception hormonale, la GnRH libérée par l’hypothalamus active la sécrétion de LH et de FSH par l’hypophyse. La FSH stimule la spermatogenèse tandis que la LH active la production de testostérone. Cette hormone est présente en forte concentration dans les testicules et est nécessaire à la production de spermatozoïdes. Dans le sang, la concentration en testostérone est plus faible. Elle exerce un rétrocontrôle négatif sur l’axe hypothalamo-hypophysaire et remplit également d’autres fonctions de virilisation (masse musculaire, pilosité, libido…).
Au milieu. Un premier type de contraception hormonale utilise un dérivé de la testostérone seul. Celui-ci supprime la fonction de l’axe hypothalamo-hypophysaire, ce qui bloque la spermatogenèse mais également la production de testostérone testiculaire. Cependant le dérivé de la testostérone permet de compenser l’absence de production de testostérone endogène pour les effets périphériques de cette hormone.
À droite. La contraception hormonale peut également se faire via un dérivé de la testostérone associé à un progestatif. Le progestatif supprime la fonction de l’axe hypothalamo-hypophysaire. Le dérivé de la testostérone a alors pour rôle de compenser l’absence de production de testostérone endogène causée par le progestatif et de permettre ainsi le maintien des caractères sexuels secondaires associés à la testostérone.
FSH, hormone folliculostimulante ; GnRH, hormone de libération des gonadotrophines ; LH, hormone lutéinisante.
Après avoir été libérés des cellules de Sertoli, les spermatozoïdes progressent dans les tubes séminifères et dans l’épididyme pour y être stockés, concentrés et maturés en spermatozoïdes fonctionnels. Enfin, au moment de l’éjaculation, les spermatozoïdes sont transférés de l’épididyme à l’urètre via le canal déférent, puis hors du corps.
Les contraceptifs masculins en cours de développement se répartissent en deux catégories : les hormonaux, qui agissent en inhibant les gonadotrophines, et les non hormonaux. Les stratégies hormonales font intervenir l’axe hypothalamo-hypophyso-testiculaire, en utilisant la testostérone exogène en association avec un progestatif pour exercer un rétrocontrôle négatif et supprimer la sécrétion de GnRH, de FSH et de LH. La testostérone exogène est apportée à une concentration suffisante pour prévenir les effets secondaires hypogonadiques de la suppression de l’axe hypothalamo-hypophyso-testiculaire. Cependant, elle est délivrée à des concentrations trop faibles pour permettre la spermatogenèse. Les méthodes non hormonales peuvent cibler n’importe quelle étape de la spermatogenèse ainsi que la maturation, le détachement, la motilité ou le transport des spermatozoïdes hors du testicule. Cela inclut des méthodes physiques consistant à introduire dans le canal déférent des composés bloquant ou endommageant les spermatozoïdes pendant leur déplacement le long de ce canal. De tels composés peuvent ultérieurement être dissous.
Un bref historique de la contraception hormonale masculine
La question la plus fréquemment posée au sujet de la contraception masculine – à part « quand sera-t-elle prête ? » – est « pourquoi cela prend-il tant de temps ? ». Le résumé qui suit sur l’histoire de la contraception masculine répondra, nous l’espérons, à cette question.
La recherche de nouvelles formes de contraception masculine a commencé plus ou moins en même temps que le développement des méthodes contraceptives hormonales féminines, mais a pris un cours très différent. Le changement de culture qui a suivi la mise à disposition de la pilule contraceptive hormonale féminine en 1965 a conduit à la création, par l’Organisation mondiale de la santé, d’un programme spécial de recherche, de développement et de formation à la recherche en matière de reproduction humaine [4]. Au sein de ce programme, un groupe de travail chargé de mettre au point des méthodes de régulation de la fertilité masculine fut créé. Il identifia des modalités possibles de contraception masculine par le biais de projets de recherche en sciences fondamentales et d’essais cliniques multicentriques de référence sur la testostérone seule ou en association avec des progestatifs [4]. Le groupe de travail concentra également ses efforts sur le développement et la promotion de la vasectomie sans scalpel1, qui est devenue la technique prédominante dans le monde, et du gossypol2, qui était censé être un contraceptif réversible mais qui a malheureusement dû être abandonné en raison de problèmes de toxicité et d’irréversibilité [4].
Pendant une dizaine d’années, à partir du milieu des années 80, le groupe de travail a mis au point de nouveaux esters de testostérone dans l’espoir qu’ils seraient développés par des partenaires industriels pour être utilisés dans le traitement des patients hypogonadiques, ainsi qu’en tant que contraceptifs masculins. Cependant, cela ne s’est pas concrétisé, pour diverses raisons : préoccupations de l’industrie concernant la sécurité des brevets et la possibilité de litiges, perception d’un marché restreint et concurrence avec leurs contraceptifs féminins existants3. Néanmoins, des études marquantes sur l’efficacité contraceptive ont été menées à cette époque en utilisant des injections hebdomadaires d’énanthate de testostérone. La première de ces études a démontré que la plupart des hommes (70 %) devenaient azoospermiques lorsqu’on leur administrait 200 mg/semaine d’énanthate de testostérone, et les couples impliqués dans cette étude l’ont ensuite utilisé comme méthode exclusive de contraception pendant un an. Cette méthode de contraception s’est avérée très efficace, avec seulement 0,8 grossesse pour 100 personnes-années4 d’exposition [6]. Une deuxième étude a cherché à déterminer la valeur en dessous de laquelle doit se situer la concentration en spermatozoïdes du sperme pour que l’on puisse considérer un contraceptif comme efficace et a retenu le seuil de 3 millions/mL5. Cela a permis considérer le traitement comme efficace non pas uniquement chez les hommes azoopermiques, mais également chez ceux dont la numération des spermatozoïdes était inférieure à 3 millions/mL, soit au total 92 % des hommes de l’étude. Une fois encore, une excellente efficacité a été démontrée avec un indice de Pearl6 de 1,4 (intervalle de confiance à 95 % : 0,4 à 3,7) [9]. Bien qu’un indice de Pearl de 8,1 (intervalle de confiance à 95 % : 2,2 à 20,7) ait été atteint même chez les hommes qui n’étaient pas azoospermiques, il a été décidé par la suite que le seuil d’un million de spermatozoïdes par millilitre serait utilisé pour évaluer les futures études sur l’efficacité des contraceptifs [10].
Si ces études ont démontré la possibilité réelle, pour les hommes, d’une contraception hormonale à base de testostérone, les études ultérieures se sont concentrées sur des combinaisons avec des progestatifs, qui sont de puissants suppresseurs de gonadotrophines chez les hommes comme chez les femmes. Dans de telles associations, ce sont essentiellement les progestatifs qui exercent l’effet inhibiteur sur les gonadotrophines ; la testostérone est alors utilisée à des doses beaucoup plus faibles, presque physiologiques, qui permettent de compenser l’absence de sa sécrétion par les cellules de Leydig. De nombreux progestatifs ont été explorés dans les années 90, mais généralement dans le cadre de petites études qui mesuraient la baisse de production de spermatozoïdes plutôt que l’efficacité contraceptive [11]. À cette époque, l’absence de préparation de testostérone à action prolongée constituait une limite importante, bien que des implants de testostérone aient été utilisés dans des études, principalement au Royaume-Uni et en Australie. Des implants combinés de testostérone et d’étonogestrel, ont montré une excellente suppression spermatogénique [12] et, en combinaison avec de l’acétate de médoxyprogestérone, ils ont été utilisés dans une étude d’efficacité, sans aucune grossesse chez 55 couples sur 35,5 personnes-années d’exposition [13].
Le développement par Schering d’une forme de testostérone à action prolongée, l’undécanoate de testostérone, a conduit à une étude en collaboration avec Organon, qui a développé des implants combinant cette molécule à l’étonogestrel. Une suppression efficace de la spermatogenèse a été obtenue [14]. Malheureusement, cette participation de l’industrie a été de courte durée en raison d’un changement de priorités dans les deux entreprises, et il n’existe actuellement aucune étude active financée par des fonds commerciaux. En Chine, de grandes études ont également été menées en utilisant l’undécanoate de testostérone seul [15]. De son côté, l’Organisation mondiale de la santé, en association avec le réseau américain de recherche et de développement sur la contraception, a réalisé une étude d’efficacité sur l’undécanoate de testostérone associé à l’énanthate de noréthistérone, administrés à huit semaines d’intervalle (en prévision du développement d’une injection combinée unique). Cette étude a recruté plus de 300 couples au niveau international, et 96,8 % des hommes ont obtenu une suppression de la spermatogenèse suffisante pour entrer dans la phase de test d’efficacité d’un an. Bien que l’essai ait été interrompu prématurément par un comité de supervision de l’OMS en raison de préoccupations concernant les effets secondaires (malgré le fait que très peu d’hommes aient interrompu le traitement), il n’y a eu que quatre grossesses, ce qui équivaut à indice de Pearl de 2,18 (intervalle de confiance à 95 % : 0,82 à 5,80) pour 100 personnes-années [16]. Cette efficacité est comparable à celle des méthodes hormonales féminines et est nettement supérieure à celle des préservatifs, la seule méthode de contraception masculine réversible actuellement disponible.
Le rôle essentiel de la GnRH dans la régulation de la fonction reproductive en fait une cible d’étude évidente, et ce depuis le développement des premiers agonistes de la GnRH en médecine reproductive. Si, chez l’homme, les agonistes de la GnRH n’entraînent pas une suppression suffisante des gonadotrophines, les antagonistes de la GnRH sont, eux, très efficaces et ont fait l’objet de plusieurs études en association avec la testostérone. Toutefois, ces associations ne réduisent pas plus les concentrations de spermatozoïdes que les associations testostérone-progestatifs [17]. Les antagonistes de la GnRH ont durant longtemps été uniquement disponibles en préparations parentérales nécessitant des injections ou des perfusions régulières, avec toutes les conséquences pratiques et financières que cela implique. De nouveaux antagonistes de la GnRH, pouvant être pris par voie orale (et mis au point pour le traitement de l’endométriose [18]) commencent à être disponibles et pourraient, à l’avenir, avoir un rôle à jouer dans le cadre d’une contraception autonome des patients.
Approches hormonales actuelles et futures
Testostérone et gel transdermique nestorone (acétate de ségestérone)
Avec le soutien de l’Institut national de la santé infantile et du développement humain des États-Unis et du Population Council, un gel de nestorone-testostérone (NES/T) a récemment fait l’objet d’un essai clinique international de phase IIb, visant à établir son efficacité et la fréquence de ses effets secondaires. Le Nestorone est un nouveau progestatif puissant qui présente une faible activité au niveau du récepteur des androgènes. Aux États-Unis, son utilisation dans des anneaux vaginaux est autorisée par la Food and Drug Administration, mais il n’est pas encore disponible au Royaume-Uni. Le gel de nestorone-testostérone représente une méthode de contraception hormonale combinée progestatif-testostérone à prendre en dose quotidienne, de manière autonome. Les effets secondaires devraient a priori être minimes dans la mesure où les doses de testostérone et de progestatif administrées sont relativement faibles [19].
Dans le cadre du développement de cette approche, il a été démontré que l’association nestorone-testostérone supprime la FSH et la LH à moins de 1 UI/L7 (niveau pour lequel d’autres essais ont démontré une efficacité contraceptive) de manière plus constante et plus efficace que le gel de testostérone seul. Une diminution significative de la concentration de spermatozoïdes a été observée dans le groupe nestorone-testostérone, bien que la durée du traitement n’ait été que de quatre semaines. Par ailleurs, aucune différence n’a été constatée dans les mesures psychosexuelles entre les groupes ou par rapport aux valeurs de départ [21].
Suppression de l’axe hypothalamo-hypophyso-testiculaire par la kisspeptine
La kisspeptine est un composé dont le rôle majeur dans la régulation de la libération de GnRH par l’hypothalamus a été récemment mis en évidence. La voie kisspeptine-neurokinine B-dynorphine agit sur l’hypothalamus pour augmenter ou diminuer la libération de GnRH [22]. Cette voie pourrait être utilisée à la fois chez les patients atteints d’hypogonadisme pour augmenter leur production de GnRH et de stéroïdes sexuels, mais aussi pour supprimer la production de GnRH et donc l’axe hypothalamo-hypophyso-testiculaire dans le cadre de la contraception [23]. Cependant, il n’y a pas, à notre connaissance, d’essais en cours concernant l’utilisation de cette voie dans le cadre de la contraception masculine.
Composés androgènes-progestatifs synthétiques et modulateurs sélectifs des récepteurs aux androgènes
De nombreuses molécules présentant à la fois des effets androgènes et progestatifs ont été développées et pourraient servir de contraceptifs masculins ainsi que de traitement pour l’hypogonadisme. Plusieurs études sont en cours pour développer ces médicaments, que ce soit sous forme d’implants ou de pilules. Récemment, des essais de phase I de deux préparations orales, le dodécylcarbonate de 11-β-méthyl-19-nortestostérone [24] et l’undécanoate de diméthandrolone [25], ont été menés et ont montré une suppression des gonadotrophines. Bien qu’à un stade de test très précoce, ces molécules apparaissent prometteuses pour la mise au point de pilules contraceptives masculines.
La 7-α-méthyl-19-nortestostérone est un puissant androgène […] qui pourrait avoir des effets protecteurs contre les maladies de la prostate, tout en soutenant la fonction sexuelle et la densité osseuse [26]. Lorsqu’elle est administrée sous forme d’implant (en raison de sa clairance rapide), la 7-α-méthyl-19-nortestostérone peut assurer une bonne suppression des gonadotrophines et de la spermatogenèse [27].
Administration par micropuces8
De nouvelles méthodes d’administration de composés existants peuvent être envisagées. La technologie des micropuces est en cours de développement pour l’administration de contraceptifs progestatifs pour les femmes et a déjà été utilisée pour l’administration de l’hormone parathyroïdienne [28]. Les micropuces représenteraient une véritable contraception réversible d’action prolongée (long-acting reversible contraception) et permettraient de surmonter les difficultés liées à la fréquence d’administration des doses de testostérone seule ou associée à un progestatif.
Approches non hormonales ciblant la spermatogenèse
Bisdichloroacétyldiamines
La conversion de la vitamine A en acide rétinoïque dans le testicule est essentielle à la spermatogenèse, car l’acide rétinoïque est indispensable à l’initiation de la méiose. Cette division cellulaire est une cible de choix pour la contraception, car sa seule fonction est la production de gamètes haploïdes. Ainsi, des médicaments qui empêcheraient la méiose avec une spécificité suffisante devraient présenter peu d’effets hors cible et ne pas interférer avec la fonction endocrine du testicule. La conversion de la vitamine A en acide rétinoïque est réalisée par des alcools et des aldéhydes déshydrogénases, qui peuvent être inhibées de manière réversible par l’administration de bisdichloroacétyldiamines. Jusqu’à présent, cette approche a été utilisée avec succès pour provoquer une azoospermie réversible chez le lapin, mais malheureusement, chez l’homme, le médicament provoque une réaction semblable à l’effet antabuse9. La poursuite de travaux visant à développer des agents ne présentant pas cet effet secondaire est justifiée par le fait que cette méthode peut induire l’azoospermie plus rapidement que les méthodes hormonales [29].
Inhibiteurs de protéines à bromodomaine spécifiques du testicule
Les protéines à bromodomaine spécifiques des testicules (BRDT) sont exprimées durant la maturation des spermatocytes et jouent un rôle important dans le remodelage de la chromatine. Il a été démontré qu’un inhibiteur de BRDT induit une infertilité réversible chez les souris, sans affecter les niveaux de testostérone sérique ou le comportement copulatoire [30]. À partir de cette importante preuve de concept, la poursuite du développement des inhibiteurs de BRDT pourrait être facilitée par le potentiel de ces médicaments dans le traitement des cancers.
Dérivés de la lonidamine
La lonidamine, découverte dans les années 70, est un médicament non hormonal connu pour ses caractéristiques antispermatogènes. Toutefois, cette molécule engendre également des effets secondaires importants, notamment des douleurs testiculaires et un dysfonctionnement hépatique. Les dérivés de la lonidamine, dont l’adjudine et le gamendazole, ont moins d’effets secondaires et agissent en provoquant un détachement prématuré des spermatides des cellules de Sertoli et, par conséquent, une infertilité [31]. Malheureusement, dans les études sur les animaux, les doses susceptibles de donner une contraception efficace ont eu des effets irréversibles ou ont entraîné des effets secondaires hépatiques. Cependant, d’autres études sont en cours pour modifier ces composés afin d’améliorer la réversibilité et de réduire les effets indésirables.
Traitement thermique
Des augmentations légères et transitoires de la température testiculaire peuvent entraîner une réduction du nombre de spermatozoïdes, en particulier lorsqu’elles sont associées à l’administration d’une hormone. Cependant, l’effet d’un tel traitement thermique est inférieur à celui du traitement combiné par testostérone et progestatif [3210]. Il existe de petites communautés d’hommes qui pratiquent des traitements thermiques de manière autonome, soit par des bains chauds, soit en utilisant des sous-vêtements dont la forme permet de créer une cryptorchidie artificielle11. Ces méthodes ne font pas l’objet de recherches actives à l’heure actuelle. Cependant, une récente étude française d’acceptabilité a rapporté qu’un tiers des personnes interrogées a montré un intérêt pour ce type de contraception [34].
Approches non hormonales ciblant l’épididyme
L’épididyme est un lieu de concentration des spermatozoïdes dans le liquide séminifère et de modifications des lipides et protéines de la surface des spermatozoïdes. Ce processus prend plusieurs semaines et est essentiel à la maturation des spermatozoïdes. Plusieurs domaines sont actuellement explorés comme sites d’intervention potentiels pour un contraceptif masculin. Il existe des protéines, par exemple l’Eppin [35], exprimées spécifiquement dans l’épididyme qui pourraient donc être les cibles de médicaments perturbant leurs fonctions. Comme ces protéines ne sont exprimées que dans l’appareil reproducteur, ces méthodes devraient théoriquement avoir peu d’effets secondaires [35].
Approches non hormonales ciblant le canal déférent
Agents intravasaux
La technique dite du Risug (Reversible Inhibition of Sperm Under Guidance) implique l’injection, dans le canal déférent, d’un polymère qui déstabilise la membrane des spermatozoïdes qui le traversent, les rendant ainsi non viables. Comme il n’y a pas de barrière complète au passage de fluide le long du canal, les problèmes de pression sont évités. Cette méthode est réversible, soit par massage de la zone du canal contenant le polymère afin de déloger ce dernier, soit par injection d’un agent dissolvant. Cette technique a été initialement mise au point en Inde [36] et un composé fait actuellement l’objet d’essais sur des animaux aux États-Unis, sous le nom de Vasalgel. Suite à des essais réussis chez des primates non humains [37], des études précliniques sont en cours.
Antagonistes des récepteurs adrénergiques
Le transport des spermatozoïdes depuis l’épididyme et le long du canal déférent est permis par la contraction de muscles lisses. Les antagonistes des récepteurs adrénergiques α1, tels que la tamsulosine, inhibent ces contractions, et les patients traités avec ces médicaments pour d’autres raisons présentent une numération réduite de spermatozoïdes dans le sperme [38]. Le potentiel contraceptif de ces médicaments n’a été exploré que dans le cadre de petites études, qui ont montré qu’une absence d’éjaculation se produit pour des doses de 0,8 mg, mais avec des effets secondaires, notamment un malaise passager pouvant durer jusqu’à 10 heures. À une dose plus faible de 0,4 mg, les effets secondaires sont réduits, mais le nombre de spermatozoïdes fonctionnels dans le sperme est alors plus élevé. Il est possible que ce composé ou d’autres similaires puissent être utilisés comme contraceptifs masculins « à la demande », car l’effet de ces médicaments est transitoire.
Méthodes barrières
Les méthodes barrières jouent un rôle important dans la prévention des infections. Les nouveaux matériaux et les nouvelles méthodes de production augmentent la diversité des préservatifs disponibles sur le marché dans le but d’améliorer les sensations tout en conservant la sécurité et l’efficacité. Le financement d’une organisation caritative a été utilisé pour développer un préservatif autolubrifiant susceptible d’améliorer le plaisir et de réduire l’inconfort, ainsi que de réduire les dommages causés au préservatif par la friction [39].
Les nouvelles méthodes masculines répondront-elles aux principes généraux du développement des contraceptifs ?
Dans l’idéal, une nouvelle méthode contraceptive devrait remplir cinq critères :
-
Les contraceptifs doivent avoir une efficacité élevée, tant dans des environnements contrôlés (essais cliniques) que dans des conditions réelles d’utilisation.
-
L’effet contraceptif doit être réversible. En effet, il existe déjà des méthodes sûres et efficaces de contraception permanente, mais il manque des méthodes réversibles.
-
Rapidité d’action : le délai entre le début de la contraception et le moment où la méthode empêche la grossesse doit être aussi court que possible pour éviter les grossesses non désirées.
-
Facilité d’utilisation : les nouveaux contraceptifs doivent être simples à utiliser, qu’ils soient pris par le patient lui-même (pilules et gels) ou administrés par un professionnel de santé (injections et implants), avec des règles claires en cas d’oubli de pilule. L’accessibilité aux contraceptifs doit également être facilitée.
-
Sécurité : afin de réduire les abandons, les effets secondaires doivent être minimes, notamment en ce qui concerne les effets sur les caractères sexuels secondaires, la fonction sexuelle et le plaisir sexuel. […]
Certaines des approches évoquées ci-dessus remplissent presque l’ensemble de ces critères. L’efficacité des méthodes actuellement étudiées semble être élevée, avec de faibles taux de spermatogenèse résiduelle et de faibles taux de grossesse. De plus, la réversibilité après l’arrêt du traitement semble complète et les traitements sont faciles à utiliser (injections, gels et pilules). Là où le bât blesse, c’est dans la rapidité d’action : les méthodes hormonales actuellement à l’étude nécessitent plusieurs semaines d’utilisation avant d’être efficaces12 (ce qui est d’ailleurs également le cas pour la vasectomie13). Les méthodes hormonales masculines semblent être très sûres, car elles emploient des stéroïdes qui ont été utilisés chez un grand nombre de personnes pendant de nombreuses années, sans effet sur les caractères sexuels secondaires. Les méthodes hormonales peuvent cependant avoir un effet négatif sur le taux de cholestérol, en entraînant en particulier une diminution de la concentration des lipoprotéines de haute densité. Cela pourrait influencer le risque de maladie cardiaque, mais ce résultat doit être interprété avec prudence car il est issu d’études anciennes, qui utilisaient de fortes doses de testostérone. Par ailleurs, le risque de maladie cardiovasculaire est complexe et multifactoriel. Enfin les contraceptifs hormonaux pourraient avoir des effets positifs sur la fonction prostatique, la masse musculaire et la densité osseuse. Ces effets ne seront correctement caractérisés que lorsque des données à l’échelle de populations entières et sur de longues durées seront disponibles […].
Acceptabilité sociale
Il existe de nombreuses études montrant qu’une forte proportion d’hommes trouve l’idée d’un contraceptif masculin acceptable et que les femmes compteraient sur leurs partenaires masculins pour utiliser une méthode contraceptive masculine [41].
Il est important de rappeler que de nombreuses femmes comptent déjà sur leur partenaire masculin pour la contraception. Environ 54 % des femmes au Royaume-Uni utilisent la stérilisation masculine, le préservatif masculin ou la méthode de retrait comme principale méthode de contraception.
Ainsi, les hommes veulent s’engager dans la santé reproductive, mais actuellement leurs options sont limitées par rapport à l’éventail de choix contraceptifs dont disposent les femmes. […] Les hommes pourraient, comme les femmes, être attirés par les contraceptifs hormonaux pour leurs avantages non contraceptifs. La mise au point de nouveaux stéroïdes pourrait être orientée de manière à favoriser ces effets.
Défis pour les services médicaux
Dans le paradigme de recherche actuel, le développement de la contraception masculine implique des analyses fréquentes du sperme pour confirmer l’azoospermie ou, tout du moins, l’oligospermie avant d’estimer la méthode fiable. Pour une utilisation à grande échelle, il faudrait trouver des marqueurs d’efficacité plus simples. Il faut cependant noter que l’analyse du sperme est utilisée en routine pour confirmer l’efficacité de la vasectomie. Par ailleurs, des autotests pourraient également être une solution puisque plusieurs sociétés développent actuellement de telles technologies dans le cadre de l’estimation de l’infertilité [42].
Résumé
Des méthodes de contraception masculine plus diversifiées sont nécessaires pour répondre aux besoins des hommes et des femmes du monde entier en matière de contraception. Des recherches sur ces méthodes sont en cours depuis les années 70, mais leur développement a été entravé par différents facteurs : difficultés de financement et manque de participation de l’industrie, scepticisme quant à l’existence d’un réel besoin de nouvelles méthodes masculines, lenteur du développement de nouvelles préparations à base de testostérone et problèmes de physiologie (chez les hommes il faut empêcher la production de millions de spermatozoïdes par jour quand chez les femmes il faut bloquer la libération d’un ovocyte par mois). Heureusement, nous n’avons jamais été aussi près de la mise sur le marché de nouvelles méthodes hormonales, et si les méthodes non hormonales semblent pour l’instant plus éloignées, elles pourraient être décisives à l’avenir.
Messages clés
-
Le développement de la contraception hormonale masculine a été retardé par de multiples facteurs, mais des essais cliniques devraient permettre une mise sur le marché de nouveaux produits dans un futur proche.
-
Grâce aux nouvelles technologies, de nouvelles cibles non hormonales pour la contraception masculine ont été découvertes.
-
Le développement d’un large éventail de méthodes de contraception masculine est essentiel.
Documents à télécharger
Quelques unes des molécules évoquées dans l'article. Les fichiers sont à ouvrir avec un logiciel de visualisation moléculaire (par exemple LibMol)
Références
[1] J. J. Reynolds-Wright et R. A. Anderson, « Male contraception: where are we going and where have we been? », BMJ Sex. Reprod. Health, vol. 45, no 4, p. 236‑242, oct. 2019, doi: 10.1136/bmjsrh-2019-200395.
[2] « Dictionnaire médical de l’Académie de Médecine ». https://dictionnaire.academie-medecine.fr/index.php?q=contraception (consulté le juin 04, 2021).
[3] A. D. Coviello et al., « Intratesticular Testosterone Concentrations Comparable With Serum Levels Are Not Sufficient to Maintain Normal Sperm Production in Men Receiving a Hormonal Contraceptive Regimen », J. Androl., vol. 25, no 6, p. 931‑938, 2004, doi: 10.1002/j.1939-4640.2004.tb03164.x.
[4] G. M. H. Waites, « Development of methods of male contraception: impact of the World Health Organization Task Force », Fertil. Steril., vol. 80, no 1, p. 1‑15, 2003, doi: 10.1016/s0015-0282(03)00577-6.
[5] E. M. Coutinho, « Gossypol: a contraceptive for men », Contraception, vol. 65, no 4, p. 259‑263, avr. 2002, doi: 10.1016/s0010-7824(02)00294-9.
[6] W. H. O. T. F. O. M. F. T. R. O. M. FERTILITY, « Contraceptive efficacy of testosterone-induced azoospermia in normal men », The Lancet, vol. 336, no 8721, p. 955‑959, 1990, doi: 10.1016/0140-6736(90)92416-f.
[7] C. R. Abbe, S. T. Page, et A. Thirumalai, « Male Contraception », Yale J. Biol. Med., vol. 93, no 4, p. 603‑613, sept. 2020.
[8] « Efficacité des moyens contraceptifs », L’assurance maladie, sept. 13, 2019. https://www.ameli.fr/assure/sante/themes/contraception/efficacite-moyens-contraceptifs (consulté le avr. 07, 2021).
[9] W. H. O. T. F. on M. for the R. of M. Fertility, « Contraceptive efficacy of testosterone-induced azoospermia and oligozoospermia in normal men », Fertil. Steril., vol. 65, no 4, p. 821‑829, 1996, doi: 10.1016/s0015-0282(16)58221-1.
[10] « Sixth Summit Meeting Consensus: Recommendations for Regulatory Approval for Hormonal Male Contraception », Int. J. Androl., vol. 25, no 6, p. 375‑375, 2002, doi: 10.1046/j.1365-2605.2002.00387.x.
[11] R. A. Anderson et D. T. Baird, « Male Contraception », Endocr. Rev., vol. 23, no 6, p. 735‑762, 2002, doi: 10.1210/er.2002-0002.
[12] R. A. Anderson, D. Kinniburgh, et D. T. Baird, « Suppression of spermatogenesis by etonogestrel implants with depot testosterone: potential for long-acting male contraception. », J. Clin. Endocrinol. Metab., vol. 87, no 8, p. 3640‑9, 2002, doi: 10.1210/jcem.87.8.8773.
[13] L. Turner et al., « Contraceptive efficacy of a depot progestin and androgen combination in men. », J. Clin. Endocrinol. Metab., vol. 88, no 10, p. 4659‑67, 2003, doi: 10.1210/jc.2003-030107.
[14] E. Mommers et al., « Male hormonal contraception: a double-blind, placebo-controlled study. », J. Clin. Endocrinol. Metab., vol. 93, no 7, p. 2572‑80, 2008, doi: 10.1210/jc.2008-0265.
[15] Y.-Q. Gu et al., « A Multicenter Contraceptive Efficacy Study of Injectable Testosterone Undecanoate in Healthy Chinese Men », J. Clin. Endocrinol. Metab., vol. 88, no 2, p. 562‑568, 2003, doi: 10.1210/jc.2002-020447.
[16] H. M. Behre et al., « Efficacy and Safety of an Injectable Combination Hormonal Contraceptive for Men. », J. Clin. Endocrinol. Metab., vol. 101, no 12, p. 4779‑4788, 2016, doi: 10.1210/jc.2016-2141.
[17] A. Thirumalai et S. T. Page, « Recent Developments in Male Contraception », Drugs, vol. 79, no 1, p. 11‑20, 2019, doi: 10.1007/s40265-018-1038-8.
[18] H. S. Taylor et al., « Treatment of Endometriosis-Associated Pain with Elagolix, an Oral GnRH Antagonist », N. Engl. J. Med., vol. 377, no 1, p. 28‑40, 2017, doi: 10.1056/nejmoa1700089.
[19] N. Ilani et al., « A New Combination of Testosterone and Nestorone Transdermal Gels for Male Hormonal Contraception », J. Clin. Endocrinol. Metab., vol. 97, no 10, p. 3476‑3486, 2012, doi: 10.1210/jc.2012-1384.
[20] « Unité internationale », Wikipédia. janv. 23, 2021. Consulté le: juin 04, 2021. [En ligne]. Disponible sur: https://fr.wikipedia.org/w/index.php?title=Unit%C3%A9_internationale&oldid=179123461
[21] B. D. Anawalt et al., « Combined nestorone–testosterone gel suppresses serum gonadotropins to concentrations associated with effective hormonal contraception in men », Andrology, vol. 7, no 6, p. 878‑887, 2019, doi: 10.1111/andr.12603.
[22] K. Skorupskaite, J. T. George, et R. A. Anderson, « The kisspeptin-GnRH pathway in human reproductive health and disease », Hum. Reprod. Update, vol. 20, no 4, p. 485‑500, 2014, doi: 10.1093/humupd/dmu009.
[23] D. B. MacLean, H. Matsui, A. Suri, R. Neuwirth, et M. Colombel, « Sustained Exposure to the Investigational Kisspeptin Analog, TAK-448, Down-Regulates Testosterone into the Castration Range in Healthy Males and in Patients With Prostate Cancer: Results From Two Phase 1 Studies », J. Clin. Endocrinol. Metab., vol. 99, no 8, p. e1445‑e1453, 2014, doi: 10.1210/jc.2013-4236.
[24] S. Wu et al., « Safety and Pharmacokinetics of Single-Dose Novel Oral Androgen 11β-Methyl-19-Nortestosterone-17β-Dodecylcarbonate in Men », J. Clin. Endocrinol. Metab., vol. 104, no 3, p. 629‑638, 2019, doi: 10.1210/jc.2018-01528.
[25] A. Thirumalai et al., « Effects of 28 Days of Oral Dimethandrolone Undecanoate in Healthy Men: A Prototype Male Pill. », J. Clin. Endocrinol. Metab., vol. 104, no 2, p. 423‑432, 2019, doi: 10.1210/jc.2018-01452.
[26] R. A. Anderson, A. M. Wallace, N. Sattar, N. Kumar, et K. Sundaram, « Evidence for tissue selectivity of the synthetic androgen 7 alpha-methyl-19-nortestosterone in hypogonadal men. », J. Clin. Endocrinol. Metab., vol. 88, no 6, p. 2784‑93, 2003, doi: 10.1210/jc.2002-021960.
[27] S. von Eckardstein et al., « A clinical trial of 7 alpha-methyl-19-nortestosterone implants for possible use as a long-acting contraceptive for men. », J. Clin. Endocrinol. Metab., vol. 88, no 11, p. 5232‑9, 2003, doi: 10.1210/jc.2002-022043.
[28] R. Farra et al., « First-in-Human Testing of a Wirelessly Controlled Drug Delivery Microchip », Sci. Transl. Med., vol. 4, no 122, p. 122ra21-122ra21, 2012, doi: 10.1126/scitranslmed.3003276.
[29] J. K. Amory et al., « Suppression of Spermatogenesis by Bisdichloroacetyldiamines Is Mediated by Inhibition of Testicular Retinoic Acid Biosynthesis », J. Androl., vol. 32, no 1, p. 111‑119, 2011, doi: 10.2164/jandrol.110.010751.
[30] M. M. Matzuk et al., « Small-Molecule Inhibition of BRDT for Male Contraception », Cell, vol. 150, no 4, p. 673‑684, 2012, doi: 10.1016/j.cell.2012.06.045.
[31] K. Li et al., « Inhibition of sperm capacitation and fertilizing capacity by adjudin is mediated by chloride and its channels in humans », Hum. Reprod., vol. 28, no 1, p. 47‑59, 2013, doi: 10.1093/humrep/des384.
[32] C. Wang et al., « Transient Scrotal Hyperthermia and Levonorgestrel Enhance Testosterone-Induced Spermatogenesis Suppression in Men through Increased Germ Cell Apoptosis », J. Clin. Endocrinol. Metab., vol. 92, no 8, p. 3292‑3304, 2007, doi: 10.1210/jc.2007-0367.
[33] J. Tcherdukian et al., « Contraception masculine : quelles (r)évolutions ? », Urofrance, nov. 21, 2020. https://www.urofrance.org/base-bibliographique/contraception-masculine-quelles-revolutions (consulté le juin 21, 2021).
[34] M. Amouroux et al., « Are men ready to use thermal male contraception? Acceptability in two French populations: New fathers and new providers », PLOS ONE, vol. 13, no 5, p. e0195824, 2018, doi: 10.1371/journal.pone.0195824.
[35] J. R. Drevet, « Epididymal approaches to male contraception », Basic Clin. Androl., vol. 28, no 1, p. 12, 2018, doi: 10.1186/s12610-018-0078-y.
[36] S. K. Guha, « RISUGTM (reversible inhibition of sperm under guidance) – An antimicrobial as male vas deferens implant for HIV free semen », Med. Hypotheses, vol. 65, no 1, p. 61‑64, 2005, doi: 10.1016/j.mehy.2004.12.030.
[37] A. Colagross-Schouten, M.-J. Lemoy, R. I. Keesler, E. Lissner, et C. A. VandeVoort, « The contraceptive efficacy of intravas injection of VasalgelTM for adult male rhesus monkeys », Basic Clin. Androl., vol. 27, no 1, p. 4, 2017, doi: 10.1186/s12610-017-0048-9.
[38] J. Wang et al., « Assessment of Tamsulosin as a Potential Male Contraceptive in Healthy Volunteers », Urology, vol. 80, no 3, p. 614‑617, 2012, doi: 10.1016/j.urology.2012.06.003.
[39] B. G. Cooper, S. L. Chin, R. Xiao, K. Buch, D. Kim, et M. W. Grinstaff, « Friction-lowering capabilities and human subject preferences for a hydrophilic surface coating on latex substrates: implications for increasing condom usage », R. Soc. Open Sci., vol. 5, no 10, p. 180291, 2018, doi: 10.1098/rsos.180291.
[40] E. Huyghe et al., « Vasectomie et chirurgies contraceptives déférentielles : aspects légaux et techniques », Prog. En Urol., vol. 17, no 4, p. 789‑793, juin 2007, doi: 10.1016/S1166-7087(07)92293-9.
[41] A. Glasier, « Acceptability of contraception for men: a review », Contraception, vol. 82, no 5, p. 453‑456, 2010, doi: 10.1016/j.contraception.2010.03.016.
[42] A. Agarwal et al., « Home sperm testing device versus laboratory sperm quality analyzer: comparison of motile sperm concentration », Fertil. Steril., vol. 110, no 7, p. 1277‑1284, 2018, doi: 10.1016/j.fertnstert.2018.08.049.