Protocole permettant de réaliser en classe la fécondation entre des spermatozoïdes et des ovocytes d'oursins.
Matériel
Matériel biologique
Oursins (Paracentrotus lividus) mâles et femelles vivants, pêchés depuis moins de 24 heures.
Oursins libérant leurs gamètes : produits génitaux de couleur blanche, chez le mâle, à gauche, et rouge-orangé chez la femelle, à droite.
Voir aussi : Oursins mâle et femelle
La fécondation et les premiers stades de la formation d’un embryon peuvent être observés facilement chez l’oursin. En effet, les gamètes femelles ( ovotides de grande taille) et mâles (spermatozoïdes flagellés) sont émis à l’extérieur et la fécondation se réalise dans l’eau de mer.
Matériel technique
- Des lames porte-objets dégraissées à l’alcool à 90 ou 95°, rincées à l’eau distillée ou à l’eau de Volvic et séchées verticalement.
- Des lamelles couvre-objets, de 22 mm × 22, 30 ou 36 mm.
- Un tube de vaseline CODEX.
- Des cristallisoirs, béchers et des boîtes de Pétri.
- Des pipettes Pasteur.
- De l’eau de mer récemment prélevée et filtrée, ou du sel de mer d’aquariophilie pour reconstituer de l’eau de mer à environ 35 grammes pour 1 litre d’eau douce distillée ou d’eau de Volvic.
- Des pissettes en plastique de 100 ou 200 mL.
- Une seringue de 5 mL et une aiguille.
- Une solution 0,53 M de KCl.
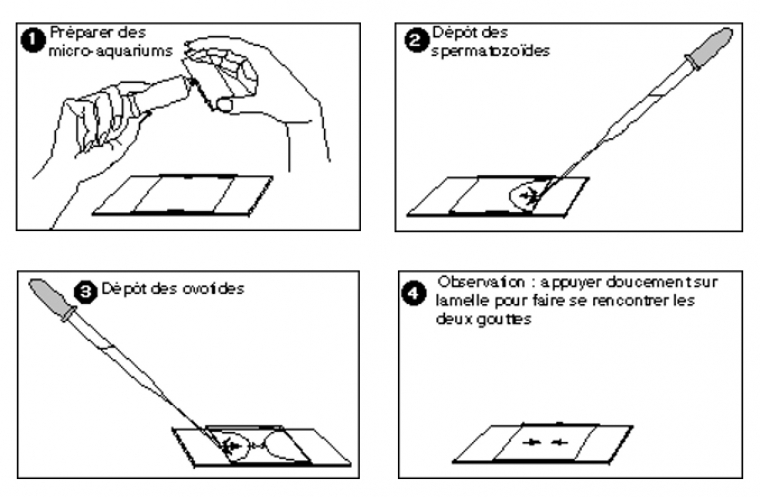
- Des micro-aquariums de Schaudin. Il s’agit d’enduire de vaseline deux bords opposés d’une lamelle. On tient la lamelle entre le pouce et l’index d’une main et on frotte très légèrement le bord de la lamelle contre l’orifice du tube de vaseline en pressant le tube très doucement. Le mouvement alternatif garnit le bord de la lamelle d’une couche plus ou moins fine de vaseline ultérieurement compressible ad libitum.
Protocole expérimental
Récolte des gamètes (par voie naturelle ou chirurgicale)
Quand les oursins sont très frais, la technique la plus simple est de les installer à l’envers, pôle aboral vers le bas, sur des béchers de taille appropriée. L’émission des produits génitaux se fait en principe spontanément. Nettoyer soigneusement le pôle aboral à l’eau de mer (pissette en plastique) et conserver l’eau de lavage dans un cristallisoir. Étiqueter soigneusement des pipettes (mâles et femelles). Attendre que les oursins se décident à émettre leurs produits génitaux. On peut accélérer le processus en injectant, au travers de la membrane péri-buccale, quelques millilitres d’eau de mer ou de 0,5 à 5 mL de KCl à 0,53 M.
Si les oursins se refusent à délivrer leurs produits génitaux par les voies naturelles, couper les tests avec des ciseaux robustes selon le plan équatorial (l’ambitus). Dans le demi-oursin supérieur (face aborale), on remarque les 5 gonades, de teintes blanc-jaunâtre pour les mâles, orangée pour les femelles. Prélever un peu de liquide au sommet de ces gonades, près de la zone péri-proctale, avec des pipettes Pasteur étiquetées.
Réalisation de la fécondation
C’est le temps essentiel de cette manipulation. Il s’agit d’une étape très brève, quelques dizaines de secondes seulement.
Prélever à la pipette étiquetée « femelle » une suspension d’ovotides dans les béchers de la manipulation ou, à défaut, dans les différents liquides de rinçage précieusement conservés. Instiller le contenu de la pipette sous l’un des bords d’un micro-aquarium préparé.
Sous le bord opposé, instiller, avec une pipette étiquetée « mâle », une petite goutte de suspension de spermatozoïdes.
Il est essentiel que les deux gouttes, à leur dépôt, ne soient pas confluentes.
Installer la lame porte-objet sur la platine du microscope et choisir, à faible grossissement, une zone riche en ovotides. Appuyer très doucement sur les bords de la lamelle : la vaseline, très souple, s’aplatit à volonté. On surveille jusqu’à ce que les deux gouttes confluent, les spermatozoïdes étant attirés par les ovotides, la fécondation aura en principe lieu sans tarder.
Observation des stades ultérieurs
Conserver les micro-aquariums dans lesquels la fécondation a eu lieu. La première division (stade 2) se réalise environ au bout de 2 heures et la deuxième (stade 4) au bout de 4 heures.
Pour les stades ultérieurs, conserver un mélange ovotides/spermatozoïdes, placer ce mélange le lendemain dans des micro-aquariums et observer.
Résultats
Observation des gamètes
Les gamètes peuvent être observées in situ ou après prélèvement.
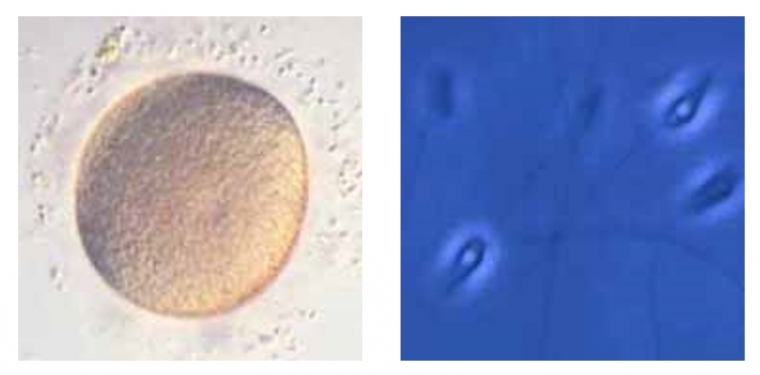
On visualise la forme des cellules femelles : les ovocytes 1, diploïdes, avec un noyau très volumineux et un petit nucléole et, après réduction chromatique, des gamètes femelles mûrs (ovotides), haploïdes dont le noyau (pronucleus femelle) est sensiblement de la même taille que le nucléole des ovocytes 1. Ces deux types cellulaires sont entourés d’une zone mucilagineuse.
Prélèvement des gamètes : à gauche, un ovotide ; à droite, des spermatozoïdes (contraste de Nomarski).
Après prélèvement, on peut observer les gamètes femelles (ovotides) et les gamètes mâles (spermatozoïdes) libérés dans le milieu.
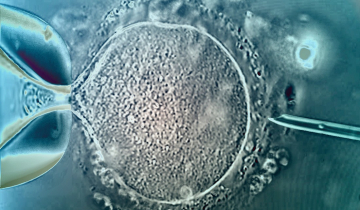
Fécondation
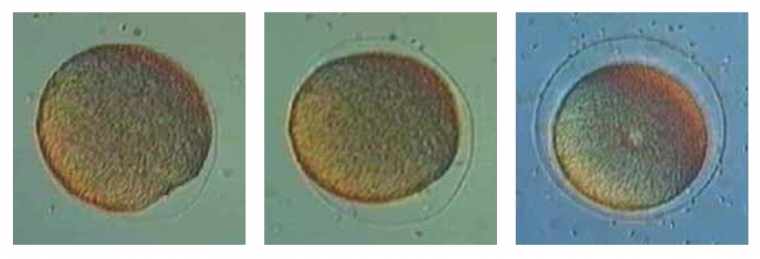
Trois étapes montrent la fécondation d’un ovotide par un spermatozoïde :
A gauche : début du soulèvement de la membrane de fécondation (à 5 heures), la tête du spermatozoïde fécondant est visible.
Au centre : le soulèvement de la membrane se poursuit autour de l'ovotide.
A droite : fin du soulèvement de la membrane de fécondation, celle-ci représente un obstacle mécanique à toute autre tentative de fécondation.
Observation au contraste de Nomarski
Segmentation
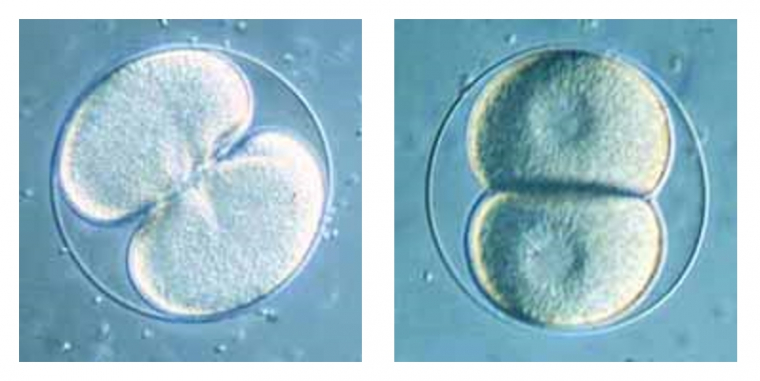
La cellule-œuf diploïde, ou zygote, résultant de la fécondation subit sa première division après environ deux heures et devient un embryon à l’abri de la membrane de fécondation. La segmentation se poursuit jusqu’au stade blastula.
Première division du zygote : du début de la segmentation à la fin du stade 2 in vivo (contraste de Nomarski).
Pour en savoir plus
Vous pouvez trouver les étapes ultérieures du développement sur le site BMédia avec le document sur le Développement des échinodermes.