Cet article présente la méthode d'électrophorèse de l'hémoglobine utilisant comme support les bandes d'acétate de cellulose.
Protocole
Le principe de la simulation utilisée est le même que celui décrit pour l’électrophorèse des hémoglobines sur gel d’agarose supporté, correspondant à la distribution des hémoglobines A et S dans trois générations au sein d’une famille. Il est indiqué dans le document « Identification des phénotypes moléculaires et des génotypes par électrophorèse de l’hémoglobine » et ne sera donc pas repris ici où l’on se limitera aux particularités liées à l’utilisation de bandes d’acétate de cellulose comme support d’électrophorèse.
Les échantillons utilisés pour mener l’électrophorèse sont des solutions réalisées artificiellement avec des hémoglobines A et S du commerce dissoutes à raison de 2,5 mg/mL dans du tampon d’électrophorèse préalablement oxygéné par une agitation vigoureuse. Pour chaque « membre de la famille », on place dans un tube Eppendorf étiqueté 100 µL de solution. Les échantillons correspondant aux individus homozygotes pour HbA sont constitués de 100 µL de la solution d’hémoglobine A, les échantillons correspondant aux individus homozygotes pour HbS sont constitués de 100 µL de la solution d’hémoglobine S et les échantillons correspondant aux individus hétérozygotes sont constitués d’un mélange de 50 µL de la solution d’hémoglobine A et de 50 µL de la solution d’hémoglobine S. Un tel volume permet de réaliser une vingtaine de pistes d’électrophorèse.
-
Mettre à tremper les bandes d’acétate de cellulose dans le tampon d’électrophorèse (tampon tris-véronal) pendant 10 à 20 minutes.
-
Essorer l’excès de tampon en plaçant les bandes entre deux feuilles de papier absorbant essuie-tout.
A gauche: trempage des bandes d'acétate dans la solution tampon
A droite: essorage des bandes entre deux feuilles de papier absorbant
-
Placer la bande sur le portoir en veillant à disposer la face absorbante vers le haut. La bande doit être tendue et ses extrémités doivent dépasser suffisamment pour tremper dans le tampon une fois le support placé dans la cuve.
NB : Le dispositif de fixation de la bande sur le support varie selon les fabricants. -
Remplir les deux compartiments de la cuve avec un même volume de tampon d’électrophorèse.
-
Mettre en place le(s) support(s) dans la cuve.
A gauche: mise en place de la bande d'acétate sur le support
A droite: mise en place des supports dans la cuve à électrophorèse remplie de tampon
-
Prélever un échantillon et le déposer sur la bande, déjà en place sur son support, au tiers de l’extrémité, côté cathode (borne noire) en prenant garde que la bande soit bien horizontale et que l’échantillon ne coule pas. On peut prélever et déposer les échantillons soit avec une micro-pipette, soit avec un capillaire, soit avec un applicateur comme celui présenté ci-dessous, réalisé avec un bouchon et deux trombones pour permettre un dépôt linéaire.
-
Recommencer pour chaque échantillon en laissant un espace suffisant pour ne pas risquer la fusion des échantillons qui diffusent légèrement lors du dépôt. Utiliser un applicateur différent pour chaque échantillon ou sinon, bien nettoyer l’applicateur entre chaque dépôt.
A gauche: applicateur réalisé à partir d'un bouchon
A droite: dépôt des échantillons d'hémoglobine sur les bandes d'acétate
-
Fermer la cuve, mettre sous tension et faire migrer environ 1 h sous 150 V (voir ci-dessous).
-
Après migration, placer les bandes dans la solution de rouge ponceau pendant 10 minutes.
-
Décolorer le fond rouge des bandes en les trempant dans des bains successifs d’acide acétique à 5 %. Agiter le cas échéant pour accélérer la décoloration.
La décoloration progressive du fond des bandes d'acétate permet l'apparition des échantillons d'hémoglobine colorés en rouge ponceau.
Résultats
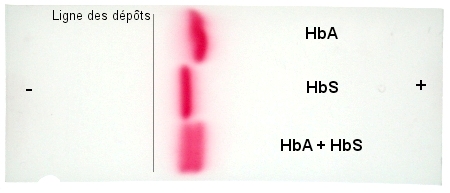
L’hémoglobine S, moins chargée électriquement que l’hémoglobine A (en raison de la substitution d’un acide glutamique par une valine en position 6 de la chaîne de la bêta-globine), migre moins loin que l’hémoglobine A et peut ainsi être distinguée de celle-ci sur la bande d’acétate de cellulose.
Solutions utilisées
-
Tampon tris-véronal
Tris (hydroxyméthyl) aminométhane : 7,2 g
Acide diéthylbarbiturique : 1,82 g
Diéthylbarbiturate de sodium : 10,2 g
Eau distillée : 1 L -
Solution de coloration : rouge ponceau
Rouge ponceau : 2 g
Acide trichloracétique : 30 g
Eau distillée : 1 L -
Solution de décoloration du rouge ponceau
Acide acétique à 5 %
Fournisseur
Kit électrophorèse
SORDALAB
ZA Des Poupettes
91580 Villeuneuve sur Auvers