L’équipe de Patrick Collombat, de l’université de Nice, a récemment montré que l’injection de GABA, molécule connue pour son rôle de neurotransmetteur, permettait d’augmenter la quantité de cellules β chez des souris modèles du diabète de type 1. Retour sur cette découverte et ses implications.
L’équipe de Patrick Collombat, de l’université de Nice, a récemment montré que l’injection de GABA, molécule connue pour son rôle de neurotransmetteur, permettait d’augmenter la quantité de cellules β chez des souris modèles du diabète de type 1 [1]. Retour sur cette découverte et ses implications.
Planet-Vie : Vous avez montré que l’injection de GABA chez des souris rendues diabétiques était capable de provoquer la régénération et la différenciation des cellules α du pancréas en cellules β, ce qui permet de restaurer une glycémie normale chez ces souris [1]. Comment en êtes-vous venu à travailler sur cette molécule ?
Patrick Collombat : C’est une longue histoire. Au départ, nous avions utilisé des modifications génétiques qui permettait de forcer l’expression du gène Pax4 dans les cellules α du pancréas. De façon surprenante, nous avions noté la conversion de ces cellules, fabriquant normalement du glucagon, en cellules produisant de l’insuline.
Nous avions également montré que le corps régénère les cellules α manquantes, qui se mettent alors à exprimer Pax4 et qui sont à leur tour converties en cellules productrices d’insuline. On observe donc une augmentation massive du nombre de cellules fabriquant de l’insuline.
Nous nous étions alors demandé comment appliquer cela chez l’homme. Sachant que l’on ne peut pas fabriquer d’humains génétiquement modifiés, nous voulions trouver une molécule pouvant faire la même chose. Nous nous sommes donc associés à plusieurs laboratoires et avons testé des millions de molécules pour voir si elles pourraient provoquer la conversion des cellules α en cellules β. Nous en avons trouvé deux : le GABA et l’artéméther, un médicament anti-malaria. Ce résultat a été démontré de manière indépendante dans plusieurs laboratoires, en utilisant des cribles différents. Ces deux candidats jouent sur la voie de signalisation du GABA, ce qui démontre l’importance de cette voie.
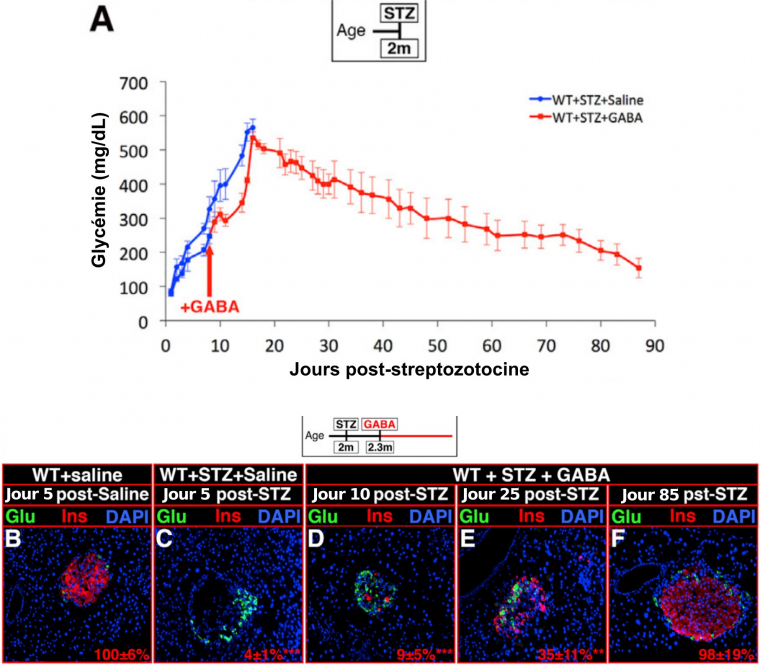
A. Des souris sauvages (WT, wild-type) de deux mois sont traitées avec des doses élevées de streptozotocine (STZ) pour détruire leurs cellules β et sont ensuite traitées au GABA ou avec une solution saline. Ces dernières décèdent d'hyperglycémie alors que les souris ayant reçu du GABA, après un pic, retrouvent une glycémie normale.
B-F. Des immunohistochimies réalisées au niveau du pancréas montrent un perte des cellules β productrices d’insuline (Ins) suite au traitement à la streptozotocine (STZ), (B et C). Le traitement au GABA permet une augmentation progressive du nombre de cellules productrices d’insuline (D à F). Le pourcentage de cellules β est indiqué en rouge, en utilisant la condition WT + solution saline comme référence.
Glu : cellules productrices de glucagon (cellules α).
DAPI : met en évidence le noyau des cellules.
Quels mécanismes envisagez-vous pour expliquer la conversion des cellules α en cellules β suite à l’administration de GABA ?
Les preuves que nous avons pu accumuler jusqu’ici démontrent que le GABA va se fixer sur le récepteur GABAA des cellules α, ce qui induit la voie de signalisation du GABA. Celle-ci provoque une inhibition de l’expression du gène Arx ainsi que l’exclusion du noyau de la protéine Arx, un facteur de transcription. Ces mécanismes conduisent à la transdifférenciation des cellules α en cellules β. Dans nos précédents travaux chez les souris transgéniques, c’était l’expression de Pax4 qui causait l’inhibition d’Arx. L’inhibition de l’expression du gène Arx est donc suffisante à l’initiation du processus de conversion des cellules α en cellules β.
La conversion des cellules α en cellules β correspond-elle à des processus de transdifférenciation ou de dédifférenciation-redifférenciation ?
La transdifférenciation correspond au passage direct d’un état différencié A vers un autre état différencié B. Cela s’oppose aux mécanismes de dédifférenciation-redifférenciation où la transition de l’état A à l’état B se fait en passant par un stade un peu moins différencié. Ces différences théoriques peuvent être difficiles à déceler en pratique. Une dédifférenciation peut se produire sans que l’on arrive à en trouver des marqueurs, on ne la voit donc pas.
Concernant les cellules α du pancréas, nous savons qu’elles ne redeviennent pas des cellules souches, ni des précurseurs du pancréas comme on les observe au cours du développement. Pour autant, l’on ne peut pas dire qu’elles ne reviennent pas vers un état plus initial, moins différencié. On observe des cellules exprimant à la fois insuline et glucagon, mais qui deviennent très rapidement des cellules n’exprimant que de l’insuline, ce qui nous fait dire que l’on aurait plutôt affaire à de la transdifférenciation.
Au cours du développement embryonnaire, les cellules β sont-elles issues directement des cellules précurseurs du pancréas, ou passent-elles d’abord par un stade cellules α ?
C’est extrêmement débattu. Au cours du développement, il y aurait deux vagues de genèse de cellules endocrines. La première vague serait constituée de cellules n’exprimant que du glucagon et la seconde de cellules exprimant soit glucagon, soit de l’insuline, ou de la somatostatine, etc. Par ailleurs, il a été montré qu’une cellule exprimant du glucagon au cours du développement ne deviendra pas une cellule exprimant de l’insuline et vice-versa. Des travaux récents semblent cependant contredire ces résultats. Cela reste donc débattu.
Votre étude montre que les cellules α sont converties en cellules β suite à l’action du GABA. Cela ne pourrait-il pas mener à un épuisement du stock de cellules α du pancréas ?
La conversion des cellules α en cellules β induit des processus de néogénèse, c’est-à-dire de régénération des cellules α. Par ailleurs, comme ces cellules mettent un certain temps à être converties en cellules β, il y a toujours une production de glucagon par l’organisme.
Nous avons également pu confirmer qu’il n’y a pas de problème d’épuisement du stock de cellules α en réalisant des expériences d’ablation. Celles-ci consistent à injecter aux souris de la streptozotocine, un composé qui provoque la mort des cellules β. Chez des souris non traitées au GABA, cela conduit à une hyperglycémie et à la mort des souris. Chez les souris traitées au GABA, les cellules β sont régénérées à partir des cellules α, les souris survivent. Nous avons pu réaliser pour le moment jusqu’à quatre cycles d’ablation totale et de régénération. Est-ce que la source va s’épuiser ? Nous ne le savons pas.
Ce que l’on sait, c’est que si l’on donne du GABA pendant toute la vie de l’animal, les îlots grandissent en continu, jusqu’à devenir dix fois plus gros que ceux de souris témoin. Il semblerait donc qu’il n’y a pas d’épuisement, tout du moins chez la souris.
À part l’injection de streptozotocine, quels modèles permettent l’étude du diabète de type 1 et quelles sont leurs limites ?
L’avantage de la streptozotocine est que c’est un modèle rapide : en trois semaines, les souris développent une hyperglycémie et décèdent.
Il existe également les souris NOD (Non-Obese Diabetic) qui sont un modèle de diabète auto-immun. Le problème des souris NOD est qu’il faut attendre six mois avant qu’elles développent les premiers symptômes. Nous donnons actuellement du GABA à ces souris. Nos résultats préliminaires semblent montrer que les cellules β sont protégées par l’administration de GABA.
Chez l’homme, le diabète de type 1 est une maladie très longue : il peut se passer plusieurs années entre l’apparition des premiers anticorps anti-cellules β et la destruction totale des cellules β. Par ailleurs, les symptômes surviennent seulement quand 95 % des cellules β ont été détruites. Notre idée est donc de retarder l’apparition des symptômes grâce à la régénération des cellules β.
Les modèles que nous utilisons ne sont donc pas parfaits : ils ne récapitulent pas exactement ce qui se passe chez l’homme, mais l’on ne peut malheureusement pas faire mieux. Nous allons donc initier des essais chez l’homme.
Quelles seraient les modalités de traitement chez l’homme ?
Nous travaillons avec une compagnie pharmaceutique pour mener un essai pilote sur 60 patients diabétiques, auxquels seront injectées différentes doses selon différentes durées. La glycémie ainsi que la production d’insuline des patients seront alors évaluées.
L’injection de GABA pourrait-elle entraîner des effets secondaires ?
Chez les souris, l’injection de GABA entraîne une augmentation de la taille des îlots de Langerhans. Cependant, si l’on arrête d’injecter du GABA, le processus de régénération s’arrête. Il n’y a donc pas de prolifération incontrôlée des cellules.
En outre, l’avantage du GABA est que c’est une molécule commercialisée depuis des années dans certains pays comme complément alimentaire. Certains body-builders en consomment des doses très importantes, jusqu’à 18 grammes par jour ! La consommation de GABA, même massive, ne semble pas causer d’effets secondaires.
Sachant que la disparition des cellules β s’observe également chez les personnes atteintes de diabète de type 2, un traitement au GABA serait-il envisageable pour ces patients ?
Il est vrai que dans 25 % des cas de DT2 il y a disparition des cellules productrices d’insuline. Le diabète de type 2 est cependant plutôt un problème de « surdité » : l’insuline est produite mais le message passe mal. Si l’on ajoutait du GABA, l’on augmenterait la production d’insuline, ce qui pourrait aider. Nous sommes en train d’étudier cela mais nous n’avons pas pour le moment la preuve que le GABA pourrait être un traitement efficace, à cause de la résistance à l’insuline observée chez les diabétiques de type 2.
À part le traitement au GABA, quelles sont les autres pistes de traitement du diabète de type 1 ?
Il y a pour commencer l’autre molécule que nous avons trouvée : l’artéméther, un anti-paludique déjà approuvé par la FDA.
Une autre voie de recherche actuelle, ce sont les cellules souches. Il s’agirait de reproduire ce qui se passe au cours du développement embryonnaire en trouvant quels signaux permettent la différenciation de cellules productrices d’insuline. Le problème de l’utilisation de cellules souches est qu’il faut être certain que toutes les cellules que l’on injecte au patient sont bien différenciées, sans quoi une cellule non différenciée pourrait initier un cancer. Il y a également la crainte que même si toutes les cellules transférées sont bien différenciées, certaines puissent se dédifférencier et là aussi générer une tumeur.
D’autres approches visent à arrêter la réaction auto-immune mais cela est complexe en raison de la multitude d’antigènes impliqués.
Références
-
Ben-Othman et al., Long-Term GABA Administration Induces Alpha Cell-Mediated Beta-like Cell Neogenesis, Cell (2017), http://dx.doi.org/10.1016/j.cell.2016.11.002