Dans le contexte de la motilité de cellules uniques, les mécanismes d’orientation dans l’espace sont divers et impliquent de pouvoir percevoir certains signaux présents dans l’environnement. La survie de ces cellules repose sur cette capacité nécessaire pour trouver des sources de nutriments ou fuir des dangers par exemple. Dans cet article, nous illustrerons ce processus en prenant pour exemple les bactéries magnétotactiques.
Des bactéries adaptées à leurs enjeux environnementaux
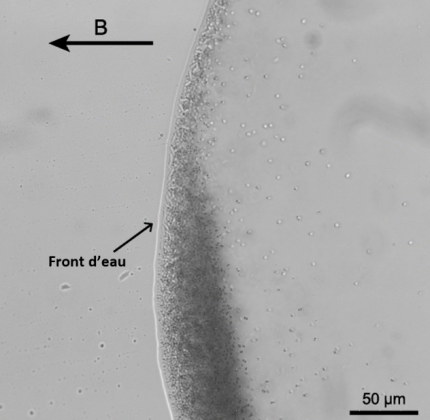
Les bactéries magnétotactiques présentes dans une goutte d'échantillon sont observées au microscope optique. Les bactéries sont soumises à un champ magnétique parallèle au plan de la lame et de direction B indiquée par la flèche. Les bactéries magnétotactiques sont celles qui se déplacent en bord de goutte jusqu’à l’interface air/eau. Dans cet échantillon, les bactéries magnétotactiques sont aussi bien représentées par des cocci (ou coques) que des bacilles.
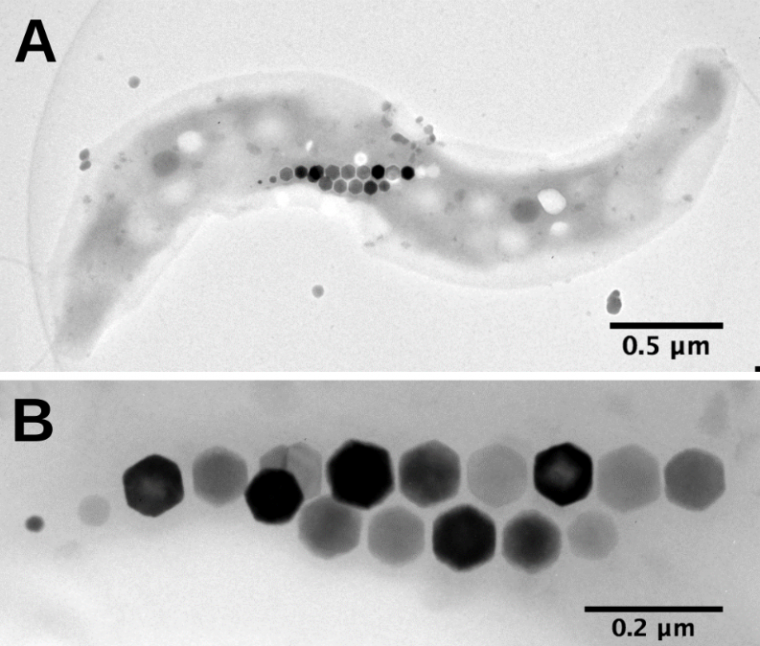
Les bactéries magnétotactiques se retrouvent spécifiquement dans les premiers centimètres des sédiments aquatiques et parfois dans la colonne d’eau de lacs chimiquement stratifiés. Ce type de micro-organismes a été observé pour la première fois en 1963 par Salvatore Bellini, un docteur affilié à l’université de Padoue, qui étudiait des échantillons d’eau à la recherche d’éventuels pathogènes. Mais la notion de magnétotactisme n’apparaît qu’une dizaine d’années plus tard suite à leur redécouverte par Richard P. Blakemore [1]. Lors de ses recherches portant sur certaines bactéries dans les sédiments marins du Massachusetts [2], il décrit des bactéries s’orientant et naviguant en fonction des déplacements d’un aimant (Figure 1). En les observant au microscope électronique, il rapporte qu’elles contiennent des chaînes de cristaux nanométriques dont il sera plus tard montré qu’elles consistent en des cristaux de fer [3].
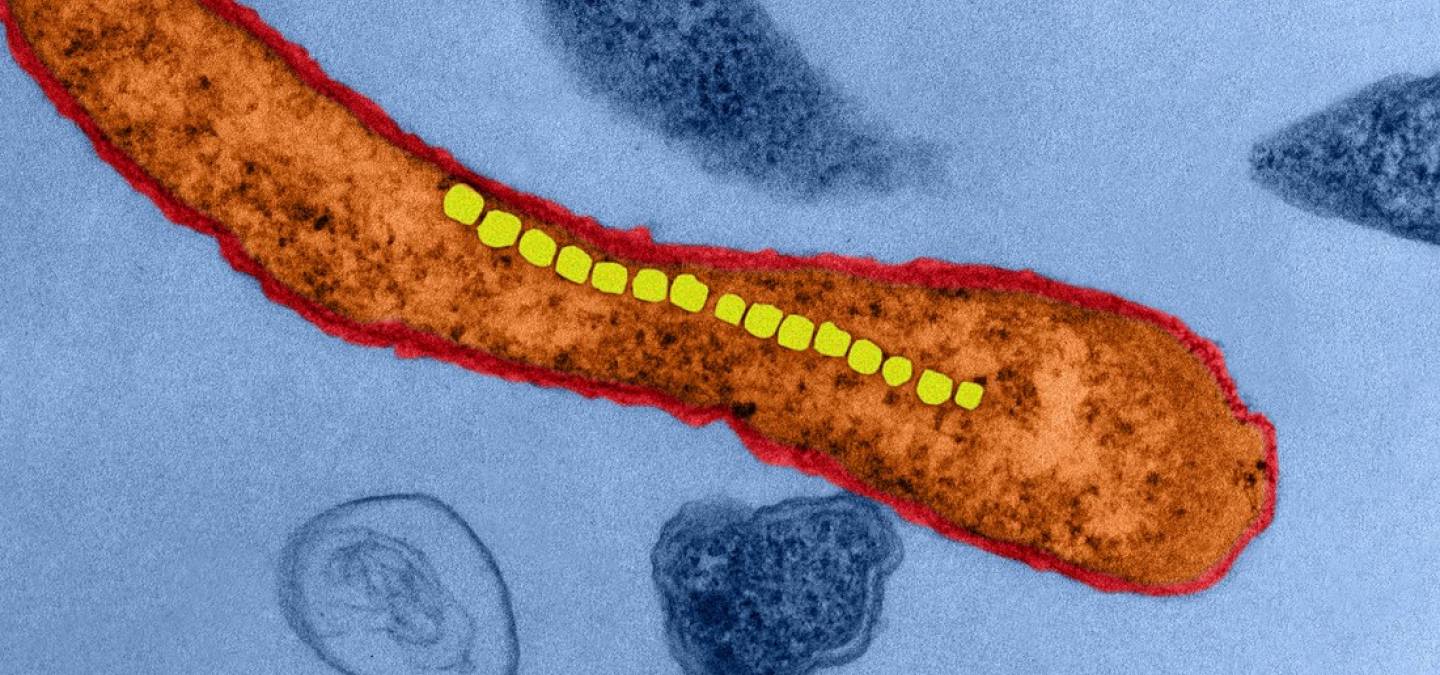
De nombreux organismes ont développé au cours de l’évolution la capacité d’exploiter le champ magnétique terrestre pour s'orienter et naviguer, une propriété connue sous le nom de magnétoréception [4]. En particulier, certaines bactéries sont dites magnétotactiques car elles peuvent se déplacer selon les lignes du champ magnétique terrestre. La perception de ce champ leur est conférée par des organites, appelés magnétosomes, composés de cristaux ferrimagnétiques de taille nanométrique et enveloppés d’une membrane lipidique (Figure 2). L’interaction entre le cytosquelette et des protéines associées à la membrane des magnétosomes permet l'alignement de ces derniers dans le cytoplasme de la bactérie le long de son axe de motilité [5]. Cet arrangement confère à la cellule un moment magnétique1 [4]. La chaîne de magnétosomes se comporte alors comme l’aiguille d’une boussole et permet à la cellule de s’aligner de manière passive au champ magnétique local [6]. Chez la majeure partie des bactéries, la mobilité répond à une nage aléatoire dans un espace en trois dimensions – par un processus de run and tumble2– qui peut cependant être biaisée par la détection d’un gradient chimique. Les bactéries magnétotactiques, quant à elles, restreignent leur mouvement à un déplacement en une dimension, c'est-à-dire le long d’une ligne de champ magnétique. Cela leur conférerait un avantage énergétique par rapport aux bactéries non magnétotactiques [7]. Il est maintenant établi au travers de plusieurs expériences que les bactéries magnétotactiques naviguent dans l’espace à l’aide du champ magnétique terrestre, ainsi que d’autres composantes environnementales comme la lumière ou des gradients de molécules en fonction des espèces [8].
Bactérie magnétotactique (A) observée au microscope électronique à transmission. Les magnétosomes (B) s’alignent le long de la bactérie selon son axe de motilité. Leur taille ne permet de les observer qu’en microscopie électronique où ils apparaissent denses aux électrons.
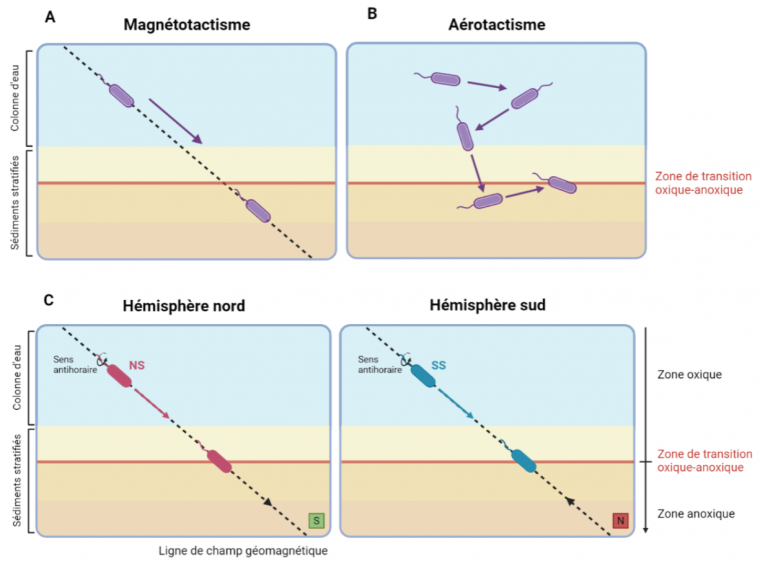
Pour comprendre le lien entre lignes de champ magnétique et déplacement des bactéries magnétotactiques, il est nécessaire de rappeler que la Terre génère un champ magnétique comparable à celui émis par un aimant droit. Le champ magnétique terrestre prend son origine dans le noyau de la Terre. Les lignes de champ sortent au niveau de l’hémisphère sud et rentrent au niveau de l’hémisphère nord. Au niveau des eaux de l’hémisphère nord, les lignes de champ sont plongeantes ; elles sont donc orientées dans le sens de concentrations décroissantes en dioxygène dans la colonne d’eau et dans les sédiments. Or, la concentration en dioxygène est un facteur important pour la croissance de ces bactéries qui tolèrent peu, voire pas, les conditions oxiques. Suite à des pressions évolutives, elles ont donc développé des stratégies qui leur permettent d’optimiser la recherche d’un habitat favorable à leur survie [3], [9].
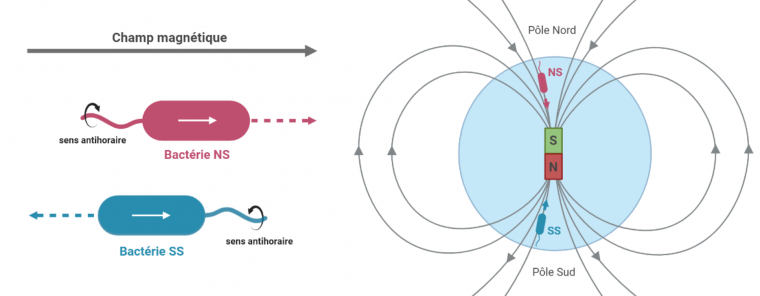
Le moment magnétique de la cellule s’oriente toujours dans le sens des lignes de champs magnétiques. Malgré tout, le sens de motilité n’est pas le même selon le type de bactérie. La majeure partie des bactéries magnétotactiques de l’hémisphère nord sont de type « North-seeking » (NS) et se déplacent dans le même sens que les lignes de champ magnétique. À l’inverse, le sens de mobilité de la majorité des bactéries magnétotactiques de l’hémisphère sud (qualifiées de « South-seeking », SS) est inversé par rapport aux lignes de champ magnétique. Si l’alignement au champ magnétique est un mécanisme passif, la nage quant à elle, est un mécanisme actif et permis par la rotation de flagelles à l’une ou aux deux extrémités de la cellule. De cette façon, que les bactéries soient dans l’hémisphère nord ou sud, elles se dirigeront toujours vers les profondeurs [3], [10] (Figure 3).
Le moment magnétique (représenté par une flèche blanche) du dipôle contenu dans la bactérie est, dans les deux cas, aligné avec le champ magnétique terrestre (flèche grise). La rotation des flagelles dans le sens anti-horaire propulse la cellule tandis qu’une rotation dans le sens horaire la tracte. Le sens de déplacement des bactéries est indiqué par une flèche pointillée. Malgré un moment magnétique parallèle dans les deux cas au champ magnétique, le sens de motilité n’est pas le même selon le type de bactérie. Dans le cas d’une bactérie North-seeking (NS), la rotation des flagelles dans le sens antihoraire permet à la cellule de se déplacer dans le même sens que les lignes de champ magnétique. L’inverse est observé chez les bactéries South-seeking (SS). Schéma réalisé à l'aide de BioRender.
Le fait que toutes les bactéries magnétotactiques présentes dans un hémisphère ne soient pas du même type (c’est-à-dire uniquement North-seeking dans l’hémisphère nord et uniquement South-seeking dans l’hémisphère sud) laisse à penser que d’autres mécanismes rentrent en jeu dans le déplacement. Le magnétotactisme seul ne suffit pas à expliquer comment ces organismes arrivent à réajuster leur position au cours du temps, dans un environnement qui n'est pas statique [11]. Il a été montré que les bactéries magnétotactiques sont capables de percevoir la teneur en dioxygène de l'environnement, grâce à des protéines capables de s'y lier, et de se déplacer en réponse au gradient d'O2, un phénomène appelé aérotactisme. Les bactéries magnétotactiques répondent également à d'autres types de gradients chimiques, bien que ceux-ci soient moins bien caractérisés. Ainsi, la perception du champ magnétique terrestre permet aux bactéries magnétotactiques de s’aligner selon les lignes de champ et de limiter leur déplacement, tandis que son association avec les capacités d'aérotactisme et chimiotactisme leur permet de trouver et maintenir leur position dans un habitat optimal à leur survie et croissance [12], [13] (Figure 4).
Dans l’exemple présenté ici, la cellule a une préférence pour les milieux pauvres en dioxygène. Il a en effet été reporté que la plupart des bactéries magnétotactiques tendent à vivre à l’interface entre les zones oxique et anoxique qui est une région optimale pour leur croissance.
(A) De manière passive, la chaîne de magnétosomes s’aligne sur les lignes de champ magnétique terrestre (indiquées par une ligne en pointillés) que la bactérie suit lors de son déplacement. Si l’on considère un déplacement par le biais du magnétotactisme uniquement, la cellule devrait s’enfoncer de plus en plus profondément.
(B) Dans une situation d’aérotactisme seul, la cellule exposée à un environnement trop riche en dioxygène se dirige vers des strates de sédiments plus en profondeur en suivant le gradient de dioxygène. À l’inverse lorsqu’elle atteint un environnement dont elle perçoit une concentration trop faible de dioxygène, la rotation de ses flagelles ira dans le sens opposé, lui permettant de remonter en direction de la surface. Des réajustements sont nécessaires au cours du temps pour maintenir une position idéale vis-à-vis de la teneur en dioxygène. Cependant, la mobilité se ferait dans un espace 3D qui demanderait plus d’énergie pour atteindre une position optimale.
(C) La mobilité des bactéries magnétotactiques se fait sous l’effet du magnéto-aérotactisme : en suivant les lignes de champ magnétique, elles peuvent fuir les concentrations en dioxygène élevées qui leur seraient néfastes jusqu’à atteindre leur zone de croissance optimale. Le sens du champ magnétique est indiqué par une flèche noire.
Schéma réalisé à l’aide de Biorender.
La biogénèse des magnétosomes
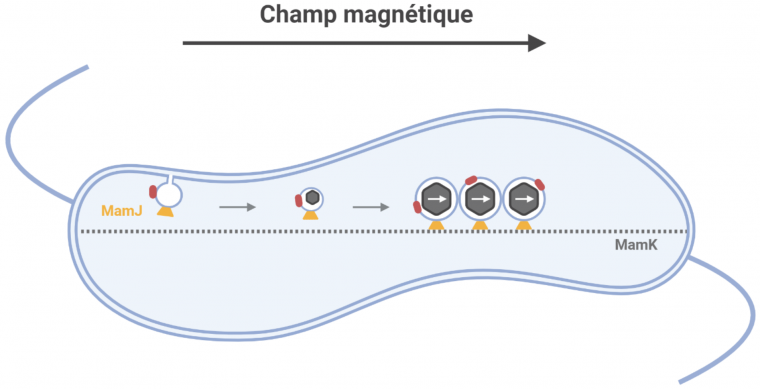
La culture des bactéries magnétotactiques, ainsi que leur manipulation génétique, ont permis aux chercheurs de mieux comprendre les processus cellulaires à l’origine du magnétotactisme. Alors que les bactéries sont souvent décrites comme des micro-organismes ne présentant pas de compartiment intracellulaire, de plus en plus d’exemples mettent en lumière la compartimentation des bactéries avec la présence d’organites qui remplissent des fonctions spécifiques [14]. La production de magnétosomes par les bactéries magnétotactiques constitue un parfait exemple. La formation des magnétosomes est sous le contrôle d'une batterie de gènes (cluster) dont le nombre varie en fonction de l’espèce. Une dizaine de gènes est en effet conservée chez toutes les bactéries magnétotactiques et peut être associée à des gènes accessoires avec plus ou moins de redondance fonctionnelle [15]. Chez les espèces modèles les plus étudiées, telles que Magnetospirillum magneticum, plus de 40 gènes identifiés comme codant des protéines associées aux magnétosomes sont regroupés en une même région chromosomique appelée genomic magnetosome island (MAI). Celle-ci correspond à environ 100 kb, soit 2 % du génome des Magnetospirillum spp. et code des protéines impliquées dans chaque étape de la biogenèse des magnétosomes (formation de vésicules, transport et biominéralisation du fer) ou dans leur alignement [14], [16].
Plusieurs protéines sont recrutées au niveau de la membrane plasmique et permettent son invagination et donc la formation de vésicules. D’autres protéines spécialisées (en rouge) sont chargées de transporter le fer dans le lumen du magnétosome en formation créant des conditions chimiques propices à la nucléation et la croissance de cristaux de fer. L’alignement des vésicules entre elles est, entre autres, assuré par l’interaction entre les protéines spécialisées MamJ (en jaune) et le cytosquelette composé de MamK (ligne pointillée) similaire au cytosquelette d’actine. En s’alignant, la chaîne de magnétosomes forme un dipôle magnétique permettant à la cellule de s’aligner le long des lignes de champ magnétique. Schéma réalisé à l’aide de Biorender.
La biogenèse des magnétosomes comprend plusieurs étapes stéréotypées entre les différentes espèces magnétotactiques, chacune d’entre elles demandant une machinerie génétique complexe (Figure 5). L’interaction de la membrane plasmique avec des protéines spécifiques induit la courbure et l’invagination de la membrane pour former des vésicules. Différentes protéines sont alors adressées au futur organite [16]. Les cristaux de fer résultent de l’incorporation d’une balance entre deux ions du fer, le fer ferrique (Fe3+) et le fer ferreux (Fe2+). Alors que l’assimilation du Fe3+ dans la cellule est soumise à un transport dépendant de l’énergie, celle du Fe2+, qui est soluble à pH neutre, peut également suivre un processus de diffusion [17]. Le fer transporté est précipité pour être biominéralisé en un cristal dans le lumen du magnétosome. La formation d’un cristal est dépendante des conditions de concentration de ses éléments constitutifs, ainsi que du pH et du gradient redox de son environnement. Ces facteurs sont hautement contrôlés à l’intérieur de la vésicule par des protéines spécialisées, donnant lieu chez une même bactérie à des cristaux dont la taille et les propriétés magnétiques varient peu [12], [16]. Enfin, les magnétosomes s’assemblent les uns aux autres en une chaîne grâce notamment à l’interaction entre des protéines du magnétosome et le cytosquelette [18].
Lors de la division cellulaire, les deux cellules filles héritent de magnétosomes de manière égale : la chaîne de magnétosomes est positionnée par le cytosquelette de sorte que le site de division cellulaire la sépare en deux parties équivalentes. Ce processus est donc coordonné avec la division cellulaire. Les magnétosomes maintenant positionnés à l’un des pôles de la cellule sont finalement transportés en son centre pour devenir fonctionnels et fournir à la bactérie un dipôle magnétique permanent [3].
Écologie des bactéries magnétotactiques
Les bactéries magnétotactiques se retrouvent dans tous types d’environnements aquatiques d’eau douce ou marins, y compris avec des conditions physicochimiques extrêmes. Il existe une grande diversité de morphologies (cocci, bâtonnets, vibrions, spirilles, etc.) et de métabolismes chez ces bactéries qui présentent une géométrie très variable parmi les magnétosomes qu’elles produisent [13].
Malgré le fait que les magnétosomes remplissent une fonction commune, leur composition, structure, arrangement et autres caractéristiques peuvent diverger d’une espèce à l’autre [3], [6] (Figure 6). Deux types de minéraux ferrimagnétiques, la magnétite (un oxyde de fer de formule Fe2+Fe3+2O4) et la greigite (de formule chimique Fe2+Fe3+2S4), peuvent être produits en milieu réduit par les bactéries magnétotactiques [16]. En général, les bactéries faisant partie d’une même espèce ne sont capables de produire qu’un seul type de cristal, que ce soit dans sa composition ou dans sa géométrie. Il a été montré que la formation de l’un ou l’autre de ces minéraux n’était pas dépendante des composés chimiques à disposition dans l’environnement, puisqu’en présence de plus hautes concentrations de sulfure d’hydrogène, les bactéries produisant de la magnétite continuent de la produire [19].
Cet arbre phylogénétique montre la géométrie et la composition de magnétosomes associées aux groupes de bactéries magnétotactiques chez qui ceux-ci ont été caractérisés. Il semblerait qu’une corrélation existe entre évolution et type de magnétosome produit. On remarque notamment que la greigite est produite spécifiquement par des bactéries de l’embranchement des Deltaproteobacteria.
L’interface oxique-anoxique est une fine couche de basse concentration en dioxygène où l’on retrouve à la fois des espèces chimiques réduites et oxydées, représentant ainsi un habitat propice à la croissance de micro-organismes microaérophiles [20]. En ce sens, la présence de bactéries magnétotactiques à cette interface est d’abord conditionnée par un gradient de dioxygène, mais également par ceux des conditions redox et des gradients d’autres composés chimiques. Bien qu’elles ne représentent pas la majorité de la biomasse bactérienne benthique, les bactéries magnétotactiques jouent un rôle important dans les cycles du fer, de l’azote, du soufre et du carbone, qui restent à quantifier pleinement. Mais l’utilisation de ces composés diffère généralement selon le groupe auquel elles appartiennent. Elles incorporent, par exemple, un taux élevé de fer dissout de leur environnement qu’elles séquestrent sous la forme d’un cristal insoluble. Il est estimé que cette incorporation du fer se situe à des taux 10 à 1000 fois plus élevée que chez des bactéries non magnétotactiques [17]. De plus, il a été observé qu’un apport en fer dans les océans stimulait la croissance du phytoplancton, réduisant ainsi la concentration en CO2 atmosphérique. Par conséquent, il a été proposé que le fer, et indirectement les bactéries magnétotactiques, jouent un rôle important dans les écosystèmes et le changement climatique [21]. Ces organismes auraient aussi pu avoir un impact sur le cycle du fer à des périodes géologiques antérieures [22]. Il est d’ailleurs rapporté que la concentration en Fe2+ se situait probablement entre 0,03 et 0,05 mM durant l’Archéen contre entre 0,05 et 2 nM actuellement [23]
Origine et évolution du magnétotactisme
L’origine des bactéries magnétotactiques remonterait à la fin de l’Archéen. Elles auraient constitué l’un des groupes d’organismes les plus anciens capables de biominéralisation [23]. Elles forment un groupe polyphylétique dont les membres sont distribués à travers plusieurs embranchements dans lesquels tous n’ont pas la capacité de former des magnétosomes. Pendant de nombreuses années, il a été admis que la diversité phylogénétique de ces bactéries à Gram négatif1 se limitait à deux embranchements – les Proteobacteria et les Nitrospirota [4]. Cependant, le développement de nouvelles méthodes d’identification a récemment révélé une diversité bien plus importante, étendue à au moins quatorze autres embranchements, et qui pourrait malgré tout être encore considérablement sous-estimée [13].
L’origine et le transfert des gènes impliqués dans le magnétotactisme au cours de l’évolution restent des sujets très discutés. Malgré leur grande diversité, les analyses des bactéries des embranchements nouvellement découverts semblent indiquer que toutes les bactéries magnétotactiques partagent un ancêtre commun et donc des gènes homologues impliqués dans le magnétotactisme [24], [25]. Cet ancêtre commun aurait existé au moins avant la divergence des embranchements Proteobacteria et Nitrospirota. La perte des gènes liés au magnétotactisme au cours de l’évolution expliquerait que seulement une minorité des bactéries connues parmi les descendants de l’ancêtre commun aux protéobactéries soient capables de produire des magnétosomes [26], [27]. Cependant, ce scénario est peu parcimonieux car il aurait nécessité trop d’évènements de perte indépendantes dans des groupes très divergents. Certains travaux évoquent l’implication du transfert horizontal de gènes2 dans la dissémination du caractère magnétotactique et dans son évolution parallèlle3 à travers différents embranchements [4]. Cette hypothèse est appuyée par des expériences de laboratoire où des bactéries initialement non magnétiques le sont devenus. Dans le cadre du développement d’applications du magnétotactisme, plusieurs laboratoires ont en effet réussi cette transformation en transférant des gènes du MAI dans des bactéries non magnétiques. Ce changement de phénotype nécessite le transfert d’un petit nombre de gènes seulement, suggérant que ce phénomène puisse s’être produit dans des conditions naturelles [28]. D’autant qu’il a été révélé au cours des dernières années que le MAI est mobile, ce qui favoriserait son insertion dans le génome de l’hôte [29].
La complexité des magnétosomes pose la question des différentes étapes évolutives et fonctionnelles qui ont permis leur émergence. Il est suggéré que des particules magnétiques se soient développés dans un premier temps pour remplir une fonction différente du magnétotactisme. En effet, il se pourrait que ces particules aient initialement servi comme solution à la toxicité des espèces réactives de l’oxygène intracellulaires, connues pour infliger un stress oxydant aux cellules, ce qui les endommage [13]. Il a aussi été proposé que le fer emmagasiné ait initialement été utilisé comme accepteur ou donneur d’électrons pour les réactions du métabolisme. Cependant, le changement des conditions environnementales, notamment l’élévation de la teneur en dioxygène dans l’eau et dans l’atmosphère, pourrait avoir mené à une nouvelle fonction de ces organites au cours du temps. En ce sens, il est proposé que le magnétotactisme ait évolué en réponse à une pression environnementale liée à la coévolution de bactéries magnétotactiques avec des cyanobactéries [23].
Quelles applications ?
Les bactéries magnétotactiques représentent un modèle présentant de nombreux avantages dans l’étude de la biominéralisation et de la perception magnétique [4]. Au-delà de cette compréhension, leurs potentielles applications sont explorées pour répondre à de nombreuses problématiques de l’ordre de la bioremédiation, des biotechnologies et du secteur biomédical [6]. Elles pourraient ainsi servir dans la bioremédiation de métaux lourds, la détoxification de fluides, la purification de populations cellulaires, l’imagerie à résonance magnétique (IRM), le transport de composés actifs pour le traitement de différentes maladies et d’autres technologies [30]. Ici, on propose de décrire deux approches thérapeutiques potentielles dérivées des bactéries magnétotactiques et qui ont des applications concrètes dans le traitement des cancers.
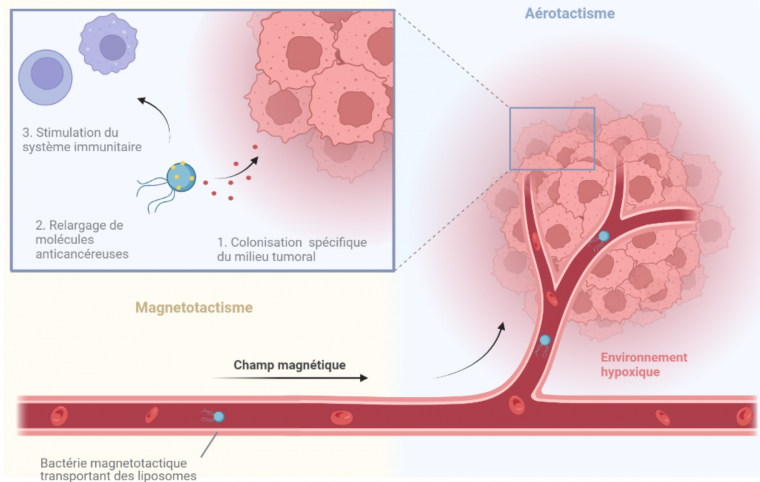
Les bactéries magnétotactiques, qui sont des organismes non pathogènes pour l’humain, pourraient être utilisées pour transporter certains traitements. En effet, des essais menés chez les souris ont permis d’établir qu’il est possible de les guider à travers le système sanguin jusqu’à la tumeur lorsqu’une injection directement à proximité de la tumeur n’est pas possible [31] (Figure 7A). Le contrôle de la mobilité se fait par un champ magnétique directionnel produit par un aimant ou bien par résonance magnétique. La membrane externe des bactéries à Gram négatif leur permet de créer des liaisons avec des liposomes contenant des particules anticancéreuses [32] (Figure 7B). Cette approche fait d’eux des nanorobots capables de délivrer des molécules de manière ciblée. Les tissus cancéreux sont connus pour devenir des régions hypoxiques qui conviennent parfaitement à la colonisation par ce type de bactéries microaérophiles ou anaérobies, ajoutant à leur sélectivité [33]. De plus, la présence de bactéries est interprétée par le corps comme une infection, activant le système immunitaire là où elles se trouvent [34]. Ainsi, leur utilisation chez l’humain présenterait l’avantage majeur de réduire les doses de traitement à administrer, tout en diminuant les effets secondaires dus à sa dissémination dans les tissus sains.
Avec les nouvelles méthodes de traitement du cancer, les chercheurs tentent de dépasser les limitations des approches traditionnelles comme la radiothérapie ou la chimiothérapie. Les propriétés des bactéries magnétotactiques à pénétrer plus facilement les tissus et à proliférer dans les zones hypoxiques en font des organismes prometteurs dans le développement de nouvelles technologies anticancéreuses. Les bactéries magnétotactiques pourraient être dirigées par un champ magnétique vers l'emplacement de la tumeur et s’aider de l’aérotactisme en zone hypoxique pour la coloniser spécifiquement. Chez la souris, de nombreuses études in vivo démontrent leur efficacité à faire régresser une tumeur par de multiples mécanismes incluant la compétition pour les ressources, la libération de molécules anticancéreuses chargées dans des liposomes associés à la membrane et l’immunostimulation. Ces propriétés pourraient être exploitées en complément de méthodes déjà existantes pour en augmenter l’efficacité du traitement. Schéma réalisé à l'aide de Biorender.
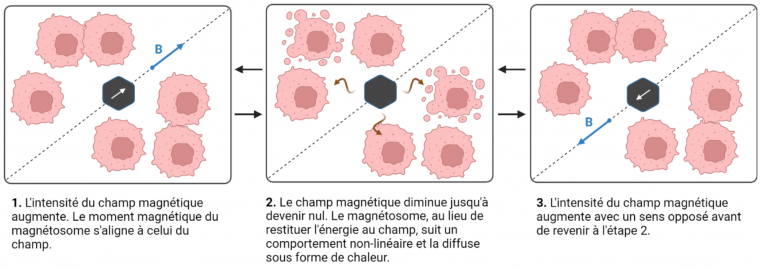
Tandis que l’utilisation un jour de bactéries magnétotactiques chez l'être humain reste incertaine, l’emploi de technologies aux propriétés proches des magnétosomes semble constituer une voie plus probable dont l’utilisation clinique a déjà été approuvée par la FDA (administration américaine des denrées alimentaires et des médicaments) et l’EMA (Agence européenne des médicaments) [35]. Dans le traitement du cancer, l’hyperthermie magnétique consiste pour l’instant en l’injection de nanoparticules magnétiques synthétiques [36]. Les nanoparticules démontrent d’une grande pénétrance mais doivent être entourées d’une couche protectrice pour éviter leur agglomération [37]. Leur effet sur la tumeur se base sur le fait que ces éléments diffusent de la chaleur de manière locale lorsqu’ils sont soumis à un champ magnétique alternatif : l’énergie magnétique est ainsi convertie en énergie thermique [38], [39] (Figure 8). Les expériences ont montré qu’une hausse de 4 à 9 °C suffisait à conduire les cellules cancéreuses à l’apoptose sans incidence sur les cellules saines. L’hyperthermie offre l’avantage d’à la fois réduire les effets secondaires connus des traitements conventionnels et de pouvoir être associée à ces derniers [40]. Les nanoparticules magnétiques actuellement utilisées, comme les nanoparticules d’oxydes de fer, présentent un magnétisme instable dû à leur très petite taille (superparamagnétisme). Elles pourraient être remplacées dans le futur par des magnétosomes qui présentent les avantages d’avoir une composition plus pure, une géométrie uniforme et une taille qui leur confèrent une plus grande stabilité [41].
Exposé à un champ magnétique, un matériau magnétique passe d’un stade de désordre à un stade arrangé en alignant son moment magnétique au champ, ce qui se traduit par une augmentation d’énergie. Inversement, si ce matériau n’est plus plongé dans un champ, il perdra l’énergie qu’il avait accumulée. Les matériaux magnétiques possèdent un cycle d’hystérésis. Cela signifie que leur comportement est non linéaire, passant par un chemin différent pour atteindre un niveau maximal d’énergie et revenir à un stade de repos. La transition d’état excité à l’état de repos étant différente du chemin qui avait mené la particule magnétique à un plus haut niveau d’énergie, une partie de l’énergie est dissipée sous forme de chaleur plutôt que rendue au champ magnétique.
La thérapie hyperthermique exploite cette propriété grâce à un champ magnétique alternatif. Il s’agit d’un champ magnétique dont le sens change au cours du temps sans changer de direction. Le passage d’un sens à l’autre implique de passer par un stade nul, correspondant à une absence de champ. Ainsi, chaque retour à un vecteur de champ nul est accompagné d’une diffusion d’énergie provenant des particules magnétiques. Schéma réalisé à l’aide de Biorender.
D’autres usages ont vu le jour, utilisant les propriétés des magnétosomes dans des applications cette fois environnementales, par exemple dans le traitement des eaux pollués. Les bactéries magnétotactiques représenteraient une solution efficace, peu coûteuse et non toxique dans le retrait de métaux lourds, d’éléments radioactifs et d’autres polluants organiques [42]. Il reste cependant de nombreuses zones d’ombres à élucider concernant la formation de magnétosomes et la génétique qui lui est liée. Eu égard à leurs remarquables propriétés magnétiques, en particulier leur stabilité magnétique, l’étude des bactéries magnétotactiques constitue une voie prometteuse dans le développement de biotechnologies en lien avec le nanomagnétisme.
Bibliographie
[1] R. Blakemore, “Magnetotactic bacteria,” Science (1979), vol. 190, no. 4212, 1975, doi : 10.1126/science.170679.
[2] R. B. Frankel, “The discovery of magnetotactic/magnetosensitive bacteria,” Chinese Journal of Oceanology and Limnology, vol. 27, no. 1, 2009, doi : 10.1007/s00343-009-0001-7.
[3] R. Uebe and D. Schüler, “Magnetosome biogenesis in magnetotactic bacteria,” Nature Reviews Microbiology, vol. 14, no. 10. 2016. doi : 10.1038/nrmicro.2016.99.
[4] W. Lin and L. F. Wu, “Magnetotactic bacteria and magnetoreception,” Journal of Oceanology and Limnology, vol. 39, no. 6. 2021. doi : 10.1007/s00343-021-2001-1.
[5] M. Toro-Nahuelpan et al., “MamY is a membrane-bound protein that aligns magnetosomes and the motility axis of helical magnetotactic bacteria,” Nat Microbiol, vol. 4, no. 11, 2019, doi : 10.1038/s41564-019-0512-8.
[6] K. G. Gareev et al., “Magnetotactic bacteria and magnetosomes : Basic properties and applications,” Magnetochemistry, vol. 7, no. 6. 2021. doi : 10.3390/magnetochemistry7060086.
[7] S. Klumpp, C. T. Lefèvre, M. Bennet, and D. Faivre, “Swimming with magnets : From biological organisms to synthetic devices,” Physics Reports, vol. 789. 2019. doi : 10.1016/j.physrep.2018.10.007.
[8] Y. Wang, G. Casaburi, W. Lin, Y. Li, F. Wang, and Y. Pan, “Genomic evidence of the illumination response mechanism and evolutionary history of magnetotactic bacteria within the Rhodospirillaceae family,” BMC Genomics, vol. 20, no. 1, 2019, doi : 10.1186/s12864-019-5751-9.
[9] C. L. Monteil and C. T. Lefevre, “Magnetoreception in Microorganisms,” Trends in Microbiology, vol. 28, no. 4. 2020. doi : 10.1016/j.tim.2019.10.012.
[10] S. Satyanarayana, S. Padmaprahlada, R. Chitradurga, and S. Bhattacharya, “Orientational dynamics of magnetotactic bacteria in Earth’s magnetic field—a simulation study,” J Biol Phys, vol. 47, no. 1, 2021, doi : 10.1007/s10867-021-09566-9.
[11] S. Klumpp and D. Faivre, “Magnetotactic bacteria,” Eur Phys J Spec Top, vol. 225, no. 11–12, pp. 2173–2188, Nov. 2016, doi : 10.1140/epjst/e2016-60055-y.
[12] M. Amor et al., “Chemical signature of magnetotactic bacteria,” Proc Natl Acad Sci U S A, vol. 112, no. 6, 2015, doi : 10.1073/pnas.1414112112.
[13] W. Lin et al., “Expanding magnetic organelle biogenesis in the domain Bacteria,” Microbiome, vol. 8, no. 1, 2020, doi : 10.1186/s40168-020-00931-9.
[14] H. C. McCausland and A. Komeili, “Magnetic genes : Studying the genetics of biomineralization in magnetotactic bacteria,” PLoS genetics, vol. 16, no. 2. 2020. doi : 10.1371/journal.pgen.1008499.
[15] F. B. Mandal, “A review of the ecology, genetics, evolution, and magnetosome – induced behaviours of the magnetotactic bacteria,” Isr J Ecol Evol, 2021, doi : 10.1163/22244662-bja10028.
[16] Y. Li, “Redox control of magnetosome biomineralization,” J Oceanol Limnol, vol. 39, no. 6, 2021, doi : 10.1007/s00343-021-0422-5.
[17] M. Amor, F. P. Mathon, C. L. Monteil, V. Busigny, and C. T. Lefevre, “Iron-biomineralizing organelle in magnetotactic bacteria : function, synthesis and preservation in ancient rock samples,” Environmental Microbiology, vol. 22, no. 9. 2020. doi : 10.1111/1462-2920.15098.
[18] S. Klumpp and D. Faivre, “Interplay of magnetic interactions and active movements in the formation of magnetosome chains,” PLoS One, vol. 7, no. 3, 2012, doi : 10.1371/journal.pone.0033562.
[19] C. T. Lefèvre and D. A. Bazylinski, “Ecology, Diversity, and Evolution of Magnetotactic Bacteria,” Microbiology and Molecular Biology Reviews, vol. 77, no. 3, 2013, doi : 10.1128/mmbr.00021-13.
[20] A. Brune, P. Frenzel, and H. Cypionka, “Life at the oxic-anoxic interface : Microbial activities and adaptations,” FEMS Microbiology Reviews, vol. 24, no. 5. 2000. doi : 10.1016/S0168-6445(00)00054-1.
[21] W. Lin, Y. Pan, and D. A. Bazylinski, “Diversity and ecology of and biomineralization by magnetotactic bacteria,” Environmental Microbiology Reports, vol. 9, no. 4. 2017. doi : 10.1111/1758-2229.12550.
[22] R. Havas, J. F. Savian, and V. Busigny, “Iron isotope signature of magnetofossils and oceanic biogeochemical changes through the Middle Eocene Climatic Optimum,” Geochim Cosmochim Acta, vol. 311, 2021, doi : 10.1016/j.gca.2021.07.007.
[23] P. Goswami, K. He, J. Li, Y. Pan, A. P. Roberts, and W. Lin, “Magnetotactic bacteria and magnetofossils : ecology, evolution and environmental implications,” NPJ Biofilms Microbiomes, vol. 8, no. 1, p. 43, Dec. 2022, doi : 10.1038/s41522-022-00304-0.
[24] C. T. Lefèvre et al., “Monophyletic origin of magnetotaxis and the first magnetosomes,” Environ Microbiol, vol. 15, no. 8, 2013, doi : 10.1111/1462-2920.12097.
[25] H. Du et al., “Magnetosome Gene Duplication as an Important Driver in the Evolution of Magnetotaxis in the Alphaproteobacteria,” mSystems, vol. 4, no. 5, 2019, doi : 10.1128/msystems.00315-19.
[26] W. Lin et al., “An ancient origin of magnetotactic bacteria,” Proceedings of the National Academy of Sciences of the United States of America, vol. 114, no. 26. 2017. doi : 10.1073/pnas.1707301114.
[27] W. Lin et al., “Genomic expansion of magnetotactic bacteria reveals an early common origin of magnetotaxis with lineage-specific evolution,” ISME Journal, vol. 12, no. 6, 2018, doi : 10.1038/s41396-018-0098-9.
[28] C. T. Lefèvre, M. L. Schmidt, N. Viloria, D. Trubitsyn, D. Schüler, and D. A. Bazylinski, “Insight into the evolution of magnetotaxis in Magnetospirillum spp., based on mam gene phylogeny,” Appl Environ Microbiol, vol. 78, no. 20, 2012, doi : 10.1128/AEM.01951-12.
[29] C. L. Monteil et al., “Repeated horizontal gene transfers triggered parallel evolution of magnetotaxis in two evolutionary divergent lineages of magnetotactic bacteria,” ISME Journal, vol. 14, no. 7, 2020, doi : 10.1038/s41396-020-0647-x.
[30] G. Vargas, J. Cypriano, T. Correa, P. Leão, D. A. Bazylinski, and F. Abreu, “Applications of magnetotactic bacteria, magnetosomes and magnetosome crystals in biotechnology and nanotechnology : mini-review,” Molecules, vol. 23, no. 10. 2018. doi : 10.3390/molecules23102438.
[31] E. Alphandéry, “Applications of magnetotactic bacteria and magnetosome for cancer treatment : A review emphasizing on practical and mechanistic aspects,” Drug Discovery Today, vol. 25, no. 8. 2020. doi : 10.1016/j.drudis.2020.06.010.
[32] O. Felfoul et al., “Magneto-aerotactic bacteria deliver drug-containing nanoliposomes to tumour hypoxic regions,” Nat Nanotechnol, vol. 11, no. 11, 2016, doi : 10.1038/nnano.2016.137.
[33] M. Dróżdż, S. Makuch, G. Cieniuch, M. Woźniak, and P. Ziółkowski, “Obligate and facultative anaerobic bacteria in targeted cancer therapy : Current strategies and clinical applications,” Life Sciences, vol. 261. 2020. doi : 10.1016/j.lfs.2020.118296.
[34] S. Zhou, C. Gravekamp, D. Bermudes, and K. Liu, “Tumour-targeting bacteria engineered to fight cancer,” Nature Reviews Cancer, vol. 18, no. 12. 2018. doi : 10.1038/s41568-018-0070-z.
[35] M. L. Fdez-Gubieda, J. Alonso, A. García-Prieto, A. García-Arribas, L. Fernández Barquín, and A. Muela, “Magnetotactic bacteria for cancer therapy,” Journal of Applied Physics, vol. 128, no. 7. 2020. doi : 10.1063/5.0018036.
[36] T. I. Shabatina, O. I. Vernaya, V. P. Shabatin, and M. Y. Melnikov, “Magnetic nanoparticles for biomedical purposes : Modern trends and prospects,” Magnetochemistry, vol. 6, no. 3. 2020. doi : 10.3390/magnetochemistry6030030.
[37] W. Wu, C. Z. Jiang, and V. A. L. Roy, “Designed synthesis and surface engineering strategies of magnetic iron oxide nanoparticles for biomedical applications,” Nanoscale, vol. 8, no. 47, 2016, doi : 10.1039/c6nr07542h.
[38] J. Mosayebi, M. Kiyasatfar, and S. Laurent, “Synthesis, functionalization, and design of magnetic nanoparticles for theranostic applications,” Advanced Healthcare Materials, vol. 6, no. 23. 2017. doi : 10.1002/adhm.201700306.
[39] X. Liu et al., “Comprehensive understanding of magnetic hyperthermia for improving antitumor therapeutic efficacy,” Theranostics, vol. 10, no. 8, 2020, doi : 10.7150/thno.40805.
[40] T. Zhang, H. Xu, J. Liu, Y. Pan, and C. Cao, “Determination of the heating efficiency of magnetotactic bacteria in alternating magnetic field,” J Oceanol Limnol, vol. 39, no. 6, 2021, doi : 10.1007/s00343-021-1071-4.
[41] A. Basit, J. Wang, F. Guo, W. Niu, and W. Jiang, “Improved methods for mass production of magnetosomes and applications : a review,” Microbial Cell Factories, vol. 19, no. 1. 2020. doi : 10.1186/s12934-020-01455-5.
[42] X. Wang et al., “Magnetotactic bacteria : Characteristics and environmental applications,” Frontiers of Environmental Science and Engineering, vol. 14, no. 4. 2020. doi : 10.1007/s11783-020-1235-z.