Cet article présente la technique de séquençage de l'ADN dite du didésoxy.
Introduction
Le séquençage d’un ADN, c’est-à-dire la détermination de la succession des nucléotides le composant, est aujourd’hui une technique de routine pour les laboratoires de biologie. Cette technique utilise les connaissances qui ont été acquises depuis une trentaine d’années sur les mécanismes de la réplication de l’ADN.
Voir aussi sur un sujet proche le document "Le séquençage des génomes".
Le séquençage : présentation générale
Les techniques de séquençage utilisent des enzymes particulières : les ADN polymérases. Ces enzymes sont capables de synthétiser un brin complémentaire d’ADN, à partir d’un brin matrice.
Documents à télécharger
Animation Flash (fichier swf)
Ces réactions se font par ajout de désoxyribonucléotides (dNTP : désoxyNucléotide TriPhosphate). On utilise, pour le séquençage, des nucléotides légèrement différents : les didésoxyribonucléotides (ddNTP). Les ddNTP diffèrent des dNTP par l’absence d’un groupement OH bien précis.
En effet, lorsqu’une ADN polymérase utilise un ddNTP au lieu d’un dNTP, elle n’est plus capable de rajouter le moindre nucléotide à sa suite : la synthèse du brin d’ADN s’arrête donc…
Documents à télécharger
Animation Flash (fichier swf)
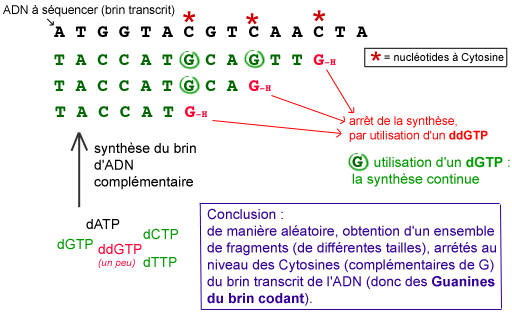
Les techniques de séquençage se basent sur ces connaissances. On procède de la façon suivante : une ADN polymérase synthétise le brin complémentaire de l’ADN à séquencer. Dans le milieu de réaction se trouvent des dNTP en grand nombre, et une faible proportion d’un ddNTP (à Adénine, ou Guanine, ou Thymine, ou Cytosine). A un moment totalement aléatoire, un ddNTP sera ajouté à la chaîne en cours de synthèse, par l’ADN polymérase. Cette synthèse s’arrêtera donc à cet endroit.
Par exemple, si le milieu réactionnel contient une faible proportion de didésoxyribonucléotide à Guanine (ddGTP), on obtiendra, à la fin des réactions, un ensemble de brins d’ADN de tailles variées, selon l’endroit où un ddGTP se sera inséré et que la réaction d’élongation aura ainsi été stoppée (ce qui correspond, du fait de la complémentarité des bases, à la présence d’une Cytosine dans le brin d’ADN séquencé). On répète la même opération avec un milieu contenant du ddATP, un milieu contenant du ddCTP, et un milieu contenant du ddTTP.
L'utilisation d'un didésoxyribonucléotide (ici le ddGTP) permet d'obtenir un ensemble de fragments d'ADN de différentes tailles, correspondant aux emplacements d'un nucléotide donné.
Il ne reste plus qu’à « lire » la séquence : on fait migrer tous ces fragments sur un gel, afin de les séparer selon leur taille. A chaque niveau d’une « ligne » du gel correspond une taille (précise au nucléotide près) du fragment d’ADN. Afin de lire les quatre nucléotides de l’ADN, on fait migrer séparément les fragments issus des quatre mélanges réactionnels (à ddATP, à ddCTP, à ddGTP et à ddTTP).
On peut alors lire la séquence (animation en boucle) :
Documents à télécharger
Animation Flash (fichier swf)
Quelques points de technique…
Une ADN polymérase n’est pas capable de débuter une synthèse d’un brin d’ADN à partir de rien. Il lui faut partir d’un court fragment d’ADN, appelé une amorce. Cette amorce est un oligonucléotide de 15 à 25 nucléotides, complémentaire d’une séquence d’ADN connue, située juste en amont de l’ADN à séquencer :
Les « réactions de séquence » (avec ddNTP) sont rapides (moins de 15 minutes). Le point long du protocole est en fait la lecture du résultat.
La plus vieille méthode, encore utilisée dans les séquençages « à la main » (voir au contraire l’automatisation ci-dessous) consiste en une migration de deux à quatre heures sur gel d’acrylamide. Il faut ensuite pouvoir « voir » les fragments d’ADN. Pour cela, certains des nucléotides utilisés sont marqués, soit par ajout d’une molécule fluorescente (sur l’amorce utilisée), soit par utilisation de nucléotides marqués radio-activement.
On « lit » donc la séquence soit en regardant la fluorescence, soit en exposant un film photographique au gel (après révélation, des bandes sombres apparaissent là où se trouvait de l’ADN : voir les exemples de résultats ci-dessus, obtenus par cette méthode). La séquence lue est limitée à 200 – 300 nucléotides environ : au-delà, les bandes sont trop tassées… Leur ordre n’est plus déterminable…
L’automatisation du séquençage
La très grande majorité des séquences réalisées et publiées aujourd’hui sont réalisées sur des séquenceurs automatiques. Ceux-ci sont capables de réaliser les réactions de séquence, puis de les lire.
Pour cela, on marque les fragments d’ADN grâce à des marqueurs fluorescents. Une fois la réaction de séquence terminée, la taille des fragments obtenus est déterminée par une chromatographie. Le séquenceur détecte la fluorescence sortant des colonnes de chromatographie, repérant ainsi les fragments d’ADN et leur taille précise. Les systèmes les plus modernes permettent même de lire les quatre nucléotides à partir d’une seule colonne de chromatographie.
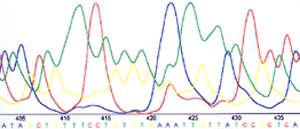
Le résultat est présenté par la machine sous forme de courbes présentant la fluorescence détectée, et l’interprétation qui en est faite en termes de nucléotides. Pour exemple, voici un court extrait d’une telle courbe :
Les quatre courbes correspondent à la détection de la fluorescence des fragments d'ADN obtenus. Un pic correspond donc à la détection d'un nucléotide donné dans la séquence: l'interprétation est donnée sous les courbes (en bleu : Adénine, en vert : Thymine, en jaune : Guanine, en rouge : Cytosine).
Les séquenceurs automatiques présentent de nombreux avantages : l’automatisation et l’utilisation d’une chromatographie au lieu d’une électrophorèse permettent un gain de temps appréciable. Le coût de revient est bien moindre (une fois amorti l’investissement dû à l’achat de la machine). De plus, alors qu’on ne peut guère espérer lire plus de 300 nucléotides de manière correcte lors d’un séquençage « à la main », les séquenceurs permettent de lire plusieurs centaines de nucléotides avec une très bonne qualité, jusqu’à 1000 pour les appareils les plus performants !
La seule limitation à l’utilisation de séquenceurs automatiques reste leur coût d’achat élevé, qui impose, concrètement, la mise en place de services communs de séquençage dans les instituts de recherche.
Remerciements
Un grand merci à Jean-François Riou, du laboratoire de Biologie Moléculaire et Cellulaire du Développement (UMR 7622, CNRS – UPMC), pour ses discussions sur le sujet, et les figures de gels de séquences et de séquences automatiques présentées ici.
Remarque : les puristes se rappelleront que ce document est destiné aux enseignants du secondaire, et voudront bien excuser les petites imprécisions qui découlent d’une nécessaire simplification des explications (en particulier, nous avons choisi un sens de lecture des gels du haut vers le bas, sans rentrer dans l’explication du sens « normal » du bas vers le haut (précision inutile pour le grand public)…