Xenopus laevis est l’espèce d’amphibien la plus utilisée dans les laboratoires. C’est un modèle qui a apporté des connaissances essentielles en biologie du développement. Son génome vient d’être séquencé et l’histoire évolutive qu’il révèle est assez originale.
Le xénope est un des modèles classiques d’embryologie. Il a beaucoup contribué à l’apport de connaissances sur des processus fondamentaux tels que le contrôle du cycle cellulaire, les inductions embryonnaires, la déformation des cellules et la migration cellulaire.
Au mois d’octobre 2016, le xénope faisait la une de la revue Nature. C’est l’étude de son génome très particulier qui était à l’honneur.
L’espèce de xénope qui est la plus répandue dans les laboratoires est Xenopus laevis. Elle a un nombre de chromosomes 2n = 36 qui est environ le double de celui plus habituel chez les autres Xenopus. Par exemple pour Xenopus tropicalis, qui est aussi utilisé dans les laboratoires, notamment pour faire de la transgénèse, 2n = 20. L’hypothèse concernant les origines de Xenopus laevis suppose la survenue d’une fécondation croisée exceptionnelle entre deux espèces à 2n = 18 générant des allotétraploïdes qui auraient été fertiles. Les résultats des travaux des chercheurs de multiples instituts, essentiellement américains et japonais, et qui ont été publiés dans Nature en octobre 2016 sont en faveur de cette hypothèse.
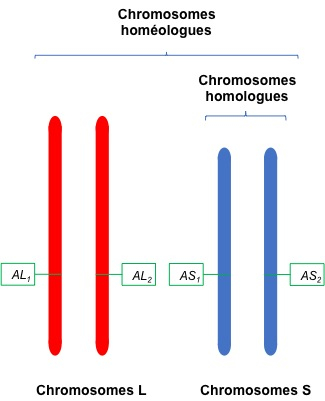
Chaque gène (ici le gène A) peut être présent en 4 exemplaires (tétraploïdie) sur deux jeux de chromosomes homologues provenant de 2 espèces différentes (chromosomes homéologues).
Les auteurs ont séquencé l’ensemble du génome de la souche de X. laevis la plus communément utilisée dans les laboratoires. Ils ont aussi fait des cartes cytogénétiques des chromosomes. Chaque type de chromosome de X. laevis est présent en quatre exemplaires que l’on peut grouper en 2 groupes de 2 : les chromosomes S pour short (court) et les chromosomes L pour long. Un chromosome S et un chromosome L correspondants sont appelés chromosomes homéologues (et non pas homologues). Les chromosomes L proviendraient d’une des espèces et les chromosomes S de l’autre espèce qui se sont hybridés (Figure 1).
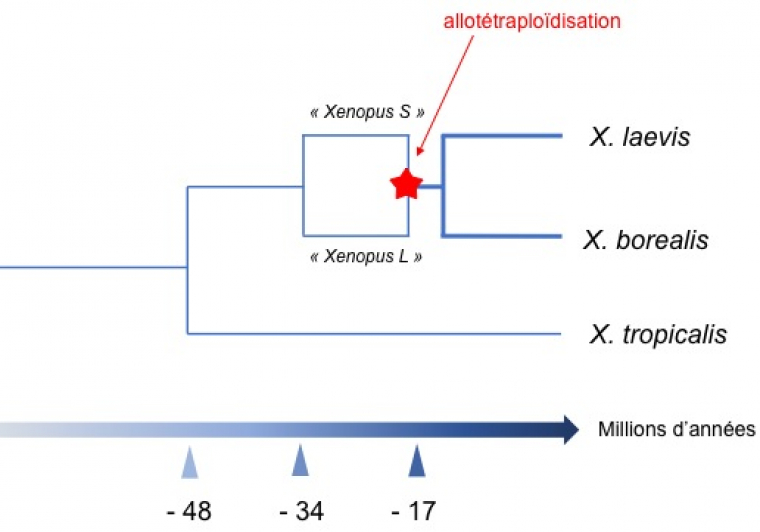
Par comparaison de séquences, les auteurs ont pu dater la chronologie des évènements. Les deux espèces ancestrales se seraient séparées il y a 34 millions d’années et l’allotétraploïdisation directement à l’origine de X. laevis (et d’une autre espèce apparentée X. borealis) aurait eu lieu il y a 17 à 18 millions d’années (Figure 2). Comme il y avait des redondances, beaucoup de gènes ont été supprimés par délétion ou ont accumulé des mutations jusqu’à devenir des pseudogènes. Les auteurs ont remarqué que ce sont plus souvent les gènes des chromosomes S que des chromosomes L qui ont subi des délétions ou qui sont devenus des pseudo-gènes. Sans doute les pressions de sélection étaient-elles plus favorables au maintien des allèles provenant de l’espèce L plutôt que de ceux provenant de l’espèce S.
Le dernier ancêtre commun entre les deux espèces de Xenopus les plus utilisées dans les laboratoires, X. laevis et X. tropicalis, a vécu il y a 48 millions d’années. Un épisode de spéciation il y a 34 millions d’années a produit les deux espèces dites S et L qui se sont ensuite hybridées et ont donné une descendance fertile il y a 17 millions d’années. Un dernier épisode de spéciation a eu lieu peu après donnant naissance à X. laevis et à X. borealis, toutes deux allotétraploïdes.
Néanmoins 56 % des gènes se retrouvent toujours sur les deux homéologues (avec chacun deux homologues/allèles classiques). Dans ce cas, l’expression des gènes peut varier de manière importante au sein d’un couple d’homéologues. Par exemple dans le laboratoire où je travaille à l’Université Paris Sud, nous étudions un gène dont l’un des homéologues est plus exprimé durant la gastrulation et l’autre durant la neurulation et l’organogénèse. On voit à l’œuvre la diversification du patron d’expression des gènes, ce qui peut amener à des innovations structurales et fonctionnelles.
Que ce soit par allotétraploïdisation (un évènement plus courant chez les plantes que chez les Vertébrés) ou par une duplication directe, ces évènements d’augmentation de la taille du génome peuvent apporter de la « matière première » génétique à des nouvelles mutations et à une diversification. On sait qu’il y a eu deux séries de duplication du génome à la base de la radiation des Vertébrés. C’est notamment à cause de cette double duplication qu’il y a quatre complexes de gènes Hox chez les Vertébrés qui contrôlent la répartition des structures le long de l’axe antéro-postérieur et pas seulement un seul complexe comme chez la drosophile (voir à ce sujet l’article Développement embryonnaire et gènes homéotiques). La diversité des récepteurs aux hormones stéroïdes des Vertébrés provient aussi du même mécanisme. Ici, chez le xénope, par un processus un peu différent, on aboutit également à une grande diversité possible et les suites de cette étude seront sans doute passionnantes pour analyser au cas par cas le comportement des 4 exemplaires des gènes qui sont présents.
Référence
Session et al. (2016) Genome evolution in the allotetraploid frog Xenopus laevis. Nature 538, 336–343. doi :10.1038/nature19840