Les couleurs que présentent les Animaux peuvent avoir différentes fonctions adaptatives : camouflage, avertissement des prédateurs, communication intraspécifique (notamment dans le contexte de la sélection sexuelle)… Après avoir présenté ces fonctions, cet article décrit les mécanismes responsables de l'évolution des couleurs chez les Animaux.
Couleur, coloration et motif de couleurs
Le terme de couleur désigne la perception qu’un organisme a d’une certaine longueur d’onde. Cette perception est propre à chaque individu.
La coloration d’un organisme définit l’ensemble des facteurs physiques et chimiques qui produisent une couleur ou un ensemble de couleurs. Dans ce second cas, quand ces couleurs présentent un arrangement spatial, on parle de motif de couleurs.
Pour approfondir, consulter l'article La coloration des Animaux : éléments de physique et de chimie.
Les fonctions adaptatives des couleurs
Une approche historique largement influencée par Wallace
C’est au XIXe siècle qu’émerge une compréhension du rôle des couleurs dans un cadre adaptatif, en lien avec l’évolution des populations et des espèces. Si Darwin est souvent considéré comme le « père » de la théorie de la sélection naturelle, c’est un de ses contemporains, lui aussi convaincu par cette théorie (puisqu’il l’a élaborée indépendamment), qui s’attache à étudier la couleur des Animaux dans un cadre adaptatif : Alfred Russell Wallace (1823-1913) (Wallace, 1877). Darwin ne sera toutefois pas en reste sur l’étude de la pigmentation puisqu’il a de son côté travaillé sur les variétés de pigeons domestiques. À l’époque, Whitwell Elwin (un contemporain de Darwin, critique de sa théorie de l’évolution naissante) rapporte ainsi que « tout le monde s’intéresse aux pigeons » en faisant notamment référence à la diversité des morphes pigmentaires (Darwin, 1868 ; Domyan et Shapiro, 2017). Membre de diverses sociétés ornithologiques, sur les pigeons ou les canaris, Darwin fut en outre un ornithologue passionné. S’il est connu pour ses travaux sur les « pinsons » des Galápagos, Darwin s’est de longue date intéressé aux Oiseaux, à leur forme et à leur couleur (Frith, 2016).
À l’époque, on pensait ainsi que les couleurs avaient été créées pour l’agrément visuel qu’elles procuraient ou qu’elles étaient le résultat d’une exposition prolongée à la chaleur ou à la lumière (Caro, 2017). À l’inverse, en allant à l’encontre de la pensée victorienne dominante, Wallace proposa pour la première fois une classification fonctionnelle des rôles biologiques des couleurs. Il définit ainsi cinq grandes catégories de couleurs pour les Animaux et les Plantes : les couleurs de protection, les couleurs d’avertissement, les couleurs sexuelles, les « couleurs typiques » et les couleurs d’attraction (uniquement chez les Plantes et chez les Insectes). Ces grandes catégories ont depuis été affinées, mais elles restent encore largement valables aujourd’hui. Nous proposons ci-dessous une version moderne de la classification effectuée par Wallace.
Les différentes fonctions adaptatives de la couleur selon Wallace, revisitées
La couleur d’un organisme, à la fois au niveau des teintes et des motifs, peut avoir plusieurs fonctions qui lui confèrent un avantage adaptatif, c’est-à-dire un gain de fitness par rapport à s’il n’avait pas cette couleur. Une revue a récemment été publiée sur le sujet dans Science et décrit quelques grandes fonctions de la couleur, ainsi que les bases biologiques sous-jacentes et les « espaces à conquérir », c’est-à-dire les nouvelles pistes à explorer pour une meilleure compréhension de la couleur (Cuthill et coll., 2017). L’étude de la couleur d’un organisme a été réalisée selon différents points de vue : origines moléculaires et cellulaires des couleurs, physiologie de la perception de la lumière, aspects comportementaux, rôles évolutifs de la coloration… Une étude exhaustive de la couleur des êtres vivants nécessite donc l’interaction entre des spécialistes de différentes disciplines (Cuthill et coll., 2017).
« Protective colors » : le camouflage
Hippocampus bargibenti, une espèce d’hippocampe dont les individus se fondent particulièrement bien dans l’environnement riche en gorgones. Cette adaptation correspond à une forme particulière de camouflage : le cryptisme, dans lequel un individu est peu visible.
La catégorie des couleurs de protection, les protective colors de Wallace, regroupe l’ensemble des stratégies de camouflage. La définition de ce dernier est variable selon les auteurs. Stevens et Merilaita définissent le camouflage comme l’ensemble des adaptations de teinte, de luminosité et de motif de couleur permettant à l’organisme de ne pas être détecté ou reconnu dans son milieu. Des couleurs qui empêchent la détection sont qualifiées de cryptiques. Cette catégorie correspond aux organismes ayant des couleurs permettant un camouflage sur l’arrière-plan (Figure 1) (Emerson et coll., 1990).
Chaetodon lunula est une espèce de poisson corallien présentant une couleur camouflante de type « contre-illumination ». Le dos, sombre, rend les individus moins visibles par un prédateur qui les observerait de dessus, sur un substrat sombre. Le ventre, clair, les rend moins visibles par un prédateur qui les regarderait de dessous, la surface de l’eau étant plus claire.
Les stratégies de contre-illumination (countershading) (Rowland, 2011 ; Manceau et coll., 2011), visibles chez les requins ou chez le poisson Chaetodon lunula (Hamilton et Peterman, 1971), rentrent dans cette catégorie (Figure 2). Les individus « contre-illuminés » présentent le plus souvent une face dorsale plus sombre que la face ventrale, ce qui les rend moins détectables par un prédateur depuis le dessus (le fond de l’eau ou le sol étant souvent sombre) et depuis le dessous (la surface étant souvent plus claire).
Il existe au sein des stratégies de cryptisme la stratégie dite de « coloration perturbatrice » (disruptive coloration) : l’individu, en arborant des signaux visuels très contrastés par rapport au reste de son corps, masque son contour et donc est paradoxalement camouflé. C’est le cas par exemple du léopard Panthera pardus (Figure 3).
Panthera pardus (le léopard), est une espèce présentant une stratégie de camouflage appelée « coloration trompeuse ». Le corps de l’animal, présentant de nombreux contrastes, a un contour difficile à délimiter pour l’œil des proies et le rend paradoxalement camouflé.
La stratégie de camouflage présentée ici est la « transparence » : l’essentiel du corps est incolore, diminuant ainsi les chances d’être repéré par un prédateur.
Les animaux transparents représentent un cas extrême de cryptisme mais les exemples sont rares chez les Vertébrés adultes (voir toutefois le poisson amazonien Microphilypnus amazonicus). Le camouflage par transparence concerne par contre les larves, notamment celles de poissons coralliens (Holzer et coll., 2017) (Figure 4).
Outre le cryptisme (« l’individu se fond avec un élément du décor, le rendant moins détectable »), la mascarade (masquerade) est un autre type de camouflage où la proie est bien détectée par le prédateur, mais où ce dernier ne la reconnait pas car elle ressemble à un objet de l’environnement (Stevens et Merilaita, 2009 ; Skelhorn et coll., 2010). Par exemple, les juvéniles d’une espèce de poisson corallien, Platax orbicularis, ressemblent à des feuilles mortes ou à des débris végétaux (Figure 5).
« Warning colors » : les couleurs d’avertissement
C’est un exemple d’aposématisme.
Les couleurs d’avertissement de Wallace se répartissent en deux grands groupes. Tout d’abord, les couleurs portées par des animaux toxiques qui signalent ainsi leur non comestibilité à l’égard des prédateurs. L’aposématisme en est un exemple : les couleurs contrastées d’un individu permettent un apprentissage du prédateur qui se détourne de la proie (Speed, 2000). Le prédateur est ainsi éloigné grâce à la présence d’un signe distinctif (c’est l’origine du mot aposématisme qui vient du grec apo-, loin, et sêma-, signe) (Poulton, 1890) (Figure 6).
Le mimétisme müllérien exploite l’aposématisme (Müller, 1879) : lorsque deux espèces toxiques se ressemblent, les prédateurs apprennent d’autant plus vite à les éviter, leur conférant un avantage sélectif (Figure 7). Par exemple, les deux espèces Meiacanthus atrodorsalis et Plagiotermus laudandus, toutes deux toxiques et vivant dans les mêmes environnements coralliens, se ressemblent et détournent ainsi leurs prédateurs communs.
À gauche, un individu d’une espèce toxique de poisson corallien, Plagiotremus laudandus. À droite, une autre espèce toxique, Meiacanthus atrodorsalis, dont les individus ressemblent à ceux de la première. Les deux espèces, toutes deux toxiques, éloignent d’autant plus efficacement leurs prédateurs communs. Elles sont ainsi dites « mimétiques mullériennes ».
Sources : Plagiotremus laudandus : Izuzuki, CC BY-SA, Reef App ; Meiacanthus atrodorsalis : Klaus Stiefel, CC BY-NC, Flickr.
Le second groupe de couleurs d’avertissement correspond à celles portées par des animaux non toxiques, comestibles, qui miment des espèces toxiques (Figure 8). Ce type de mimétisme est qualifié de batésien, suite à sa description par Henry W. Bates (Bates, 1862). Il existe des formes de mimétisme intermédiaires entre le mimétisme batésien et müllérien, que nous ne détaillerons pas ici (Rowland et coll., 2010).
Un individu toxique de l’espèce Meiacanthus nigrolineatus (à gauche) et un individu inoffensif de l’espèce Ecsenius gravieri (à droite). L’individu de E. gravieri est dit « mimétique batésien » de l’individu de M. nigrolineatus : non toxique, le premier exploite en effet le détournement des prédateurs dû à la toxicité du second.
Sources : Meiacanthus nigrolineatus : Richard Field, CC BY-NC, FishBase ; Ecsenius gravieri : Alain Feulvarch, CC BY, Wikimedia.
« Sexual colors » : les couleurs sexuelles
Les couleurs, dans cet exemple, constituent un type de couleur sexuelle.
Lorsque les mâles et les femelles d’une même espèce présentent des couleurs différentes, celles-ci sont qualifiées de sexuelles. Généralement, un des sexes (le plus souvent, mâle), arbore des couleurs vives, alors que l’autre sexe est, lui, camouflé. Ce dimorphisme est un facteur clef de la sélection sexuelle.
« Typical colors » : une catégorie aujourd’hui largement remaniée
Les couleurs « typiques » de Wallace peuvent aujourd’hui être définies en deux sous-ensembles qui ne semblent pas être directement liés aux catégories citées précédemment.
1. Les signaux colorés de communication intraspécifique, en dehors du contexte de la sélection sexuelle. Il s’agit des signaux de compétition intraspécifique (Tibbetts et Dale, 2004 ; Senar, 2006), des signaux attirant les congénères ce qui augmente la probabilité collective de détecter et d’échapper à un prédateur (Figure 10) (DE L. Brooke, 1998), des signaux servant à signaler sa jeunesse et donc sa compétitivité faible (Rohwer, 1978), et enfin, des signaux permettant aux juvéniles de reconnaître leurs parents.
Dans ce cas, la couleur est un signal de communication intraspécifique et permet aux individus de se reconnaître comme congénères.
2. Les signaux de communication interspécifique qui permettent soit d’éviter l’hybridation entre espèces proches (Wagner et coll., 2007 ; Santana et coll., 2012), soit de leurrer les prédateurs (Figure 11) (Powell, 1982). Dans cette sous-catégorie seraient aujourd’hui rangées les attractive colors, couleurs permettant aux plantes d’attirer les pollinisateurs ou les espèces dispersant les fruits.
Les taches sombres sur la nageoire dorsale, situées dans une zone non vitale de l’individu, ressemblent à des yeux et leurrent les prédateurs. Si l’individu n’arrive pas à fuir, les prédateurs attaquent alors préférentiellement cette zone mais portent des coups qui ne sont que rarement mortels.
Il est à noter que la communication intraspécifique est plus diverse que les signaux de regroupement, seuls représentés ici.
Sources des images : voir le reste de l'article.
Les catégories de Wallace ne sont pas exhaustives
Une fonction adaptative des couleurs d’origine pigmentaire non envisagée par Wallace tient aux propriétés même des pigments : ceux-ci absorbent une partie de la lumière incidente. Cette absorption conduit rarement à l’émission d’un photon en retour (fluorescence) : dans la majorité des cas, l’énergie absorbée se dissipe sous forme de chaleur. Ainsi, chez les Animaux, la mélanine a un rôle de thermorégulation majeur. Les animaux sombres absorbent relativement plus de chaleur, ils se réchauffent donc plus vite que les animaux clairs. Toutefois, la thermorégulation est un processus complexe impliquant des facteurs physiologiques, comportementaux et écologiques. La seule lumière incidente ne suffit donc pas à expliquer les variations de température corporelle (Dreiss et coll., 2016).
En outre, les couleurs peuvent avoir une fonction de photoprotection : en absorbant les rayons ultraviolets de la lumière solaire, la mélanine neutralise l’effet mutagène de ces rayons (Brenner et Hearing, 2008). C’est ainsi l’un des rôles biologiques majeurs du bronzage chez l’espèce humaine.
Évolution de la couleur
Nous l’avons vu, il existe de multiples fonctions associées aux couleurs. Celles-ci sont généralement considérées adaptatives, dans le sens où elles confèrent un gain de valeur sélective (fitness) à l’individu (Hubbard et coll., 2010). Quelles sont alors les forces évolutives qui sous-tendent ce trait ? Avant de répondre à cette question, précisons que les motifs de couleur ne sont pas forcément adaptatifs et que des cas de polymorphisme de couleur soumis à la dérive ont été documentés, par exemple chez la grenouille Rana pipiens (Hoffman et coll., 2006).
La couleur est due à une interaction entre sélection naturelle, sexuelle et sociale
La sélection naturelle
Deux forces évolutives principales sont souvent évoquées, voire opposés, pour expliquer l’évolution des motifs de couleur : la sélection naturelle et la sélection sexuelle.
La sélection naturelle repose sur des facteurs écologiques. Par exemple, un individu mieux camouflé dans son environnement aura plus de chances de ne pas être vu par un prédateur, donc de survivre, de se reproduire et de transmettre ses gènes associés à un camouflage efficace. La descendance sera donc plus efficacement camouflée dans le même environnement et, à terme, les individus seront adaptés à celui-ci. Le camouflage peut également être un caractère sélectionné chez les prédateurs, qui seront ainsi moins bien repérés par leurs proies. Ce mode de sélection fut développé de concert par Wallace et Darwin.
La sélection sexuelle
L’explication des couleurs très voyantes portées par certains individus d’un sexe (souvent mâle) semble aller contre la logique énoncée ci-dessus. La solution à ce problème logique réside dans l’importance du choix de l’autre sexe (souvent femelle) pour les individus les plus colorés : c’est la sélection intersexuelle (qui agit sur d’autres traits que la couleur, comme certains attributs physiques). Il existe une autre forme de la sélection sexuelle dans laquelle les individus du même sexe sont en compétition pour l’accès à la reproduction : on parle de sélection intrasexuelle.
La première personne à suggérer l’importance de la sélection sexuelle et du choix des femelles est Darwin (Darwin, 1871). Il allait ainsi à l’encontre de la pensée victorienne dans laquelle la femme n’est pas à même de faire un choix. Darwin ayant postulé une continuité « psychologique, intellectuelle et morale » entre l’Homme et les autres êtres vivants, suggérer qu’une femelle d’un animal autre que l’Homme puisse choisir son partenaire, c’est accepter que les femmes soient également dotées d’un libre-arbitre (Milam, 2010) ! Le choix des femelles, selon Darwin, entraîne le développement de caractères de plus en plus esthétiques chez les mâles.
Wallace pense qu’au contraire le choix du partenaire est une marque distinctive de l’intelligence humaine. Les autres animaux ne seraient donc pas en mesure de choisir leurs partenaires reproducteurs. Partageant la paternité de la théorie de la sélection naturelle, Wallace est biaisé vers cette dernière et tente de tout expliquer à travers ce prisme. Par exemple, il fit l’observation que les organes les plus actifs (foie, rate, etc.) sont aussi les plus colorés. Par analogie, les couleurs fortes seraient sélectionnées chez les individus les plus actifs. Ainsi, les femelles seraient nécessairement moins colorées que les mâles car moins vigoureuses (Prum, 2012).
Un siècle et demi plus tard, les résultats d’observations et d’expériences accumulés montrent que Wallace se trompait et que Darwin avait raison : la sélection sexuelle, à travers notamment le dimorphisme sexuel et le choix des femelles, est un facteur clef de l’évolution de la couleur des animaux. Malgré cette erreur de Wallace, l’essentiel des travaux menés sur la sélection sexuelle sont aujourd’hui considérés comme néowallaciens. Comment expliquer ce renversement de situation ?
Darwin, en rapport avec la pensée victorienne, considérait la sélection sexuelle comme une course à l’esthétisme : les mâles ne pouvaient être que plus beaux parce que les femelles le souhaitaient. Cette hypothèse était rejetée par Wallace mais ce dernier pensait que le choix des femelles pouvait effectivement avoir lieu, à une condition : « La seule façon dont nous pouvons expliquer les faits observés, c’est en supposant que la couleur et l’apparence sont strictement corrélées avec la santé, la vigueur et l’aptitude générale à survivre » (« The only way in which we can account for the observed facts is by supposing that colour and ornament are strictly correlated with health, vigor, and general fitness to survive. », Wallace, 1895, p. 178 et 179). Alors qu’il s’était initialement farouchement opposé à la sélection sexuelle, ces propos attestent que Wallace finit par admettre ce mode de sélection mais uniquement dans le cadre de la sélection naturelle.
Ironiquement, c’est donc Wallace qui a proposé en premier un mécanisme compatible avec une compréhension moderne de la sélection sexuelle (Prum, 2012). Cette théorie a été reprise par Zahavi en 1975. Apparemment, il n’avait pas eu connaissance des propos de l’époque de Wallace. Il dit ainsi : « Wallace rejette complètement la théorie de la sélection sexuelle par les partenaire » (« Wallace dismissed altogether the theory of sexual selection by mate ») et « Je propose que la sélection sexuelle est efficace car elle augmente la capacité du sexe sélectionnant à détecter la qualité du sexe sélectionné » (« I suggest that sexual selection is effective because it improves the ability of the selecting sex to detect quality in the selected sex. », Zahavi, 1975, p. 207). Ce sont des propos très similaires de ceux de Wallace un siècle plus tôt ! En 1977, Zahavi publiait la théorie dite « des bons gènes » : les femelles tendent à se reproduire plus fréquemment avec les mâles les plus voyants, justement car ceux-ci sont repérables. Si les mâles les plus colorés ont survécu, c’est qu’ils ont été plus capables d’échapper à des prédateurs. Ces mâles sont donc en meilleure santé, portent des « bons gènes » et il y a intérêt à se reproduire avec eux (Zahavi, 1977 ; Caro, 2005).
Cette théorie a depuis largement été testée. Après la confirmation que les femelles choisissaient effectivement les mâles (plus souvent que l’inverse), les signaux qui intéressent les femelles ont été de mieux en mieux compris. Ces signaux reposent sur l’intensité de la couleur ou sur le motif de couleurs (Hill, 2006 ; Andersson et Simmons, 2006). Des cas inverses, où les mâles sont attirés par des signaux colorés chez les femelles, ont déjà été documentés chez les Oiseaux et chez les poissons Téléostéens (Amundsen, 2000 ; Amundsen et Forsgren, 2001). Lorsque les femelles sont colorées, ce n’est donc pas simplement une conséquence de la sélection pour certains caractères colorés chez les mâles (Amundsen et Forsgren, 2001). Enfin, la corrélation de ces signaux colorés avec certains traits liés à la condition phénotypique a également été effectuée, par exemple pour la masse corporelle, la quantité de testostérone ou la masse de la progéniture (Roulin, 2009 ; Piault et coll., 2009 ; Béziers et coll., 2017).
En conclusion, alors que Darwin considérait que la sélection sexuelle était un facteur clef de l’évolution des espèces (à raison), son mécanisme a paradoxalement été proposé par Wallace, un opposant de longue date de cette théorie. L’étude de l’opposition entre ces deux éminents naturalistes sur la sélection sexuelle nous renseigne donc sur les mécanismes biologiques sous-jacents.
La sélection sociale
Un troisième mode de sélection est la sélection sociale (Tanaka, 1996 ; Wolf et coll., 1999). Ce type de sélection a été conceptuellement développé récemment, à la fin des années 1990, et est encore vivement débattu (Clutton-Brock, 2010 ; Milam et coll., 2011). La sélection sociale a été définie en complément à la sélection sexuelle. Cette théorie postule que l’ensemble des relations sociales (et pas seulement celles concernant l’accès à la reproduction) peut avoir un effet sur la valeur sélective d’un individu. L’évolution des motifs de couleurs pourrait donc être influencée par ce mode de sélection. Ainsi, alors que les signaux issus de la sélection sexuelle induisent la mise à l’écart des rivaux, les signaux issus de la sélection sociale permettent au contraire à l’individu de ne pas se séparer de ses congénères, ce qui maximise ses chances d’échapper à la prédation (Senar, 2006).
Conflits entre modes de sélection multiples : application à la coloration
Les différentes forces sélectives entrent parfois en conflit. Fisher a ainsi montré que les préférences des femelles tendent à être corrélées aux attributs mâles. Cela peut conduire à un processus d’emballement (runaway), la sélection sexuelle allant alors à l’encontre de la sélection naturelle. Dans une telle situation, les mâles ne sont plus en mesure d’échapper à un prédateur car leurs caractères sexuels deviennent « extravagants » (Fisher, 1958 ; Kirkpatrick, 1982). Chez les guppies P. reticulata, une étude a montré que les mâles les plus colorés, bien que préférés par les femelles, sont également plus détectés et attrapés des prédateurs (Godin et McDonough, 2003). Chez les lions, plus la crinière est foncée, plus les femelles sont attirées par les mâles ; cependant, une crinière foncée induit une hyperthermie (Caro, 2005). Il s’instaure donc un équilibre entre les facteurs de sélection « écologiques » et « sexuels ».
La couleur est un trait qui évolue souvent vite
Les différentes forces évolutives évoquées ci-dessus fonctionnent simultanément lors de l’évolution d’une espèce ou d’une lignée. Cela a été mis en évidence dans de nombreuses lignées de Protostomiens (ex. les Lépidoptères) et de Deutérostomiens (ex. les Vertébrés). Cela a en particulier été démontré dans les radiations de Vertébrés actuels : les lézards du genre Anolis (Muñoz et coll., 2013), les poissons perroquets (Streelman et coll., 2002) et les poissons Cichlidés. Chez ces derniers, une évolution par sélection divergente de la couleur chez des paires d’espèces a été documentée (Allender et coll., 2003 ; Seehausen et coll., 2008 ; Wagner et coll., 2012).
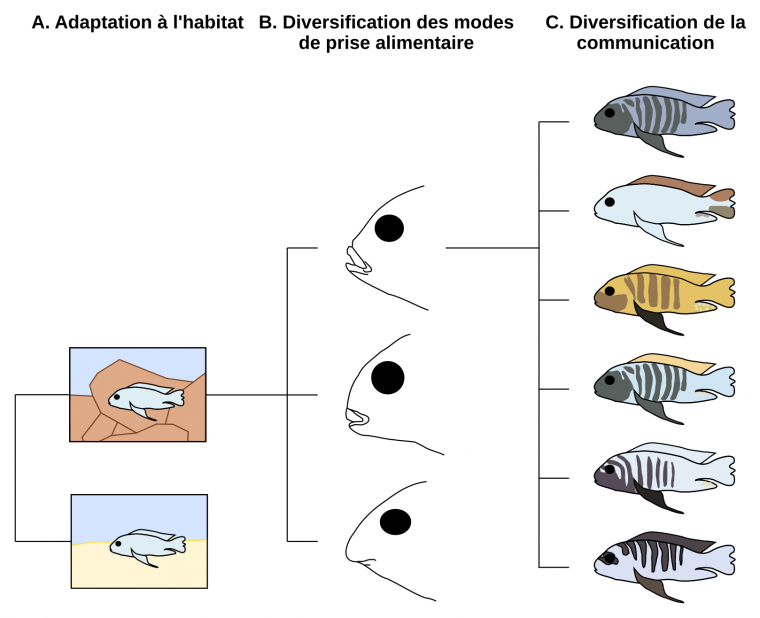
Selon Streelman et coll., une radiation évolutive se fait en trois temps (Figure 13). En premier lieu, les différentes populations d’une même espèce colonisent de nouveaux habitats. Ensuite, elles se spécialisent par des morphologies différentes. Enfin, les signaux colorés, souvent liés à de la signalisation intra et interspécifique, interviennent lors d’une troisième étape qui induit des barrières reproductives, principalement des barrières de communication (Streelman et coll., 2002 ; Kocher, 2004).
A. La première étape d’une radiation peut être l’adaptation à de nouveaux habitats (rocheux en haut, sableux en bas). B. Les morphologies trophiques peuvent alors se diversifier. C. Au sein du nouvel habitat, les signaux de communication, tels que la couleur, peuvent alors évoluer rapidement.
À l’inverse, un trait lié à la couleur, tel que la vision, peut être rapidement perdu. Au cours de l’évolution du poisson Astyanax mexicanus, plusieurs populations cavernicoles ont évolué de manière plus ou moins isolée des populations de surface, pendant des durées variables et difficiles à calculer, mais probablement de l’ordre de quelques centaines de milliers d’années (Fumey et coll., 2018). Ces populations sont devenues aveugles et dépigmentées de manière convergente (Protas et coll., 2006 ; Casane et Rétaux, 2016). Ainsi, dans des conditions de réduction de la pression de sélection sexuelle basée sur la couleur, une perte de la pigmentation noire, mélanique, est rapidement observée. Cela souligne le coût du maintien d’un phénotype coloré qui doit donc être contrebalancé par des bénéfices pour les organismes de surface.

Références
- Allender, C. J., Seehausen, O., Knight, M. E., Turner, G. F., & Maclean, N. (2003). Divergent selection during speciation of Lake Malawi cichlid fishes inferred from parallel radiations in nuptial coloration. Proceedings of the National Academy of Sciences, 100(24), 14074–14079. https://doi.org/10.1073/pnas.2332665100
- Amundsen. (2000). Why are female birds ornamented ? Trends in Ecology & Evolution, 15(4), 149–155. https://doi.org/10717684
- Amundsen, T., & Forsgren, E. (2001). Male mate choice selects for female coloration in a fish. Proceedings of the National Academy of Sciences, 98(23), 13155–13160. https://doi.org/10.1073/pnas.211439298
- Andersson, M., & Simmons, L. W. (2006). Sexual selection and mate choice. Trends in Ecology & Evolution, 21(6), 296–302. https://doi.org/10.1016/j.tree.2006.03.015
- Bates, H. B. (1862). Contributions to an insect fauna of the Amazon valley (Lepidoptera : Heliconidae). Transactions Of the Linnean Society of London, 23, 495–556. https://doi.org/10.1111/j.1095-8312.1981.tb01842.x
- Béziers, P., Ducrest, A.-L., Simon, C., & Roulin, A. (2017). Circulating testosterone and feather-gene expression of receptors and metabolic enzymes in relation to melanin-based colouration in the barn owl. General and Comparative Endocrinology, 250, 36–45. https://doi.org/10.1016/j.ygcen.2017.04.015
- Brenner, M., & Hearing, V. J. (2008). The Protective Role of Melanin Against UV Damage in Human Skin†. Photochemistry and Photobiology, 84(3), 539–549. https://doi.org/10.1111/j.1751-1097.2007.00226.x
- Caro, T. (2005). The Adaptive Significance of Coloration in Mammals. BioScience, 55(2), 125–136. https://doi.org/10.1641/0006-3568(2005)055[0125 : TASOCI]2.0. CO ; 2
- Caro, Tim. (2017). Wallace on Coloration : Contemporary Perspective and Unresolved Insights. Trends in Ecology & Evolution, 32(1), 23–30. https://doi.org/10.1016/j.tree.2016.10.003
- Casane, D., & Rétaux, S. (2016). Evolutionary Genetics of the Cavefish Astyanax mexicanus. https://doi.org/10.1016/bs.adgen.2016.03.001
- Clutton-Brock, T. (2010). We do not need a Sexual Selection 2.0—nor a theory of Genial Selection. Animal Behaviour, 79(3), e7–e10. https://doi.org/10.1016/j.anbehav.2009.10.018
- Cuthill, I. C., Allen, W. L., Arbuckle, K., Caspers, B., Chaplin, G., Hauber, M. E.,… Caro, T. (2017). The biology of color. Science, 357(6350), eaan0221. https://doi.org/10.1126/science.aan0221
- Darwin, C. (1868). The Variation of Animals and Plants Under Domestication. John Murray, London.
- Darwin, C. (1871). The Descent of Man, and Selection in Relation to Sex. John Murray, London.
- DE L. Brooke, M. (1998). Ecological factors influencing the occurrence of “flash marks” in wading birds. Functional Ecology, 12(3), 339–346. https://doi.org/10.1046/j.1365-2435.1998.00204.x
- Domyan, E. T., & Shapiro, M. D. (2017). Pigeonetics takes flight : Evolution, development, and genetics of intraspecific variation. Developmental Biology, 427(2), 241–250. https://doi.org/10.1016/j.ydbio.2016.11.008
- Dreiss, A. N., Séchaud, R., Béziers, P., Villain, N., Genoud, M., Almasi, B.,… Roulin, A. (2016). Social huddling and physiological thermoregulation are related to melanism in the nocturnal barn owl. Oecologia, 180(2), 371–381. https://doi.org/10.1007/s00442-015-3491-3
- Emerson, S. B., Cooper, T. A., & Ehleringer, J. R. (1990). Convergence in Reflectance Spectra Among Treefrogs. Functional Ecology, 4(1), 47. https://doi.org/10.2307/2389651
- Fisher, R. (1958). The Genetical Theory of Natural Selection, 2nd ed. Dover, N. Y.
- Frith, C. (2016). Charles Darwin’s Life With Birds : His Complete Ornithology. Oxford University Press.
- Fumey, J., Hinaux, H., Noirot, C., Thermes, C., Rétaux, S., & Casane, D. (2018). Evidence for late Pleistocene origin of Astyanax mexicanus cavefish. BMC Evolutionary Biology, 18(1), 43. https://doi.org/10.1186/s12862-018-1156-7
- Godin, J.-G. J., & McDonough, H. E. (2003). Predator preference for brightly colored males in the guppy : a viability cost for a sexually selected trait. Behavioral Ecology, 14(2), 194–200. https://doi.org/10.1093/beheco/14.2.194
- Hamilton, W. J., & Peterman, R. M. (1971). Countershading in the colourful reef fish Chaetodon lunula : Concealment, communication or both ? Animal Behaviour, 19(2), 357–364. https://doi.org/10.1016/S0003-3472(71)80017-9
- Hill, G. (2006). Female choice for ornamental coloration. In G. E. Hill & K. J. McGraw (Eds.), Bird Coloration : Function and evolution2 (pp. 137–200). Harvard University Press.
- Hoffman, E. A., Schueler, F. W., Jones, A. G., & Blouin, M. S. (2006). An analysis of selection on a colour polymorphism in the northern leopard frog. Molecular Ecology, 15(9), 2627–2641. https://doi.org/10.1111/j.1365-294X.2006.02934.x
- Holzer, G., Besson, M., Lambert, A., François, L., Barth, P., Gillet, B.,… Laudet, V. (2017). Fish larval recruitment to reefs is a thyroid hormone-mediated metamorphosis sensitive to the pesticide chlorpyrifos. ELife, 6. https://doi.org/10.7554/eLife.27595
- Hubbard, J. K., Uy, J. A. C., Hauber, M. E., Hoekstra, H. E., & Safran, R. J. (2010). Vertebrate pigmentation : from underlying genes to adaptive function. Trends in Genetics, 26(5), 231–239. https://doi.org/10.1016/j.tig.2010.02.002
- Kirkpatrick, M. (1982). Sexual selection and the evolution of female choice. Evolution, 36(1), 1–12. https://doi.org/10.1111/j.1558-5646.1982.tb05003.x
- Kocher, T. D. (2004). Adaptive evolution and explosive speciation : the cichlid fish model. Nature Reviews Genetics, 5(4), 288–298. https://doi.org/10.1038/nrg1316
- Manceau, M., Domingues, V. S., Mallarino, R., & Hoekstra, H. E. (2011). The Developmental Role of Agouti in Color Pattern Evolution. Science, 331(6020), 1062–1065. https://doi.org/10.1126/science.1200684
- Milam, E. L. (2010). Looking for a Few Good Males. John Hopkins University Press.
- Milam, Erika L., Millstein, R. L., Potochnik, A., & Roughgarden, J. E. (2011). Sex and sensibility : The role of social selection. Metascience, 20(2), 253–277. https://doi.org/10.1007/s11016-010-9464-6
- Müller, F. (1879). Ituna and Thyridia : a remarkable case of mimicry in butterflies. Transactions of the Entomological Society of London, 20–29.
- Muñoz, M. M., Crawford, N. G., McGreevy, T. J., Messana, N. J., Tarvin, R. D., Revell, L. J.,… Schneider, C. J. (2013). Divergence in coloration and ecological speciation in the Anolis marmoratus species complex. Molecular Ecology, 22(10), 2668–2682. https://doi.org/10.1111/mec.12295
- Piault, R., Gasparini, J., Bize, P., Jenni‐Eiermann, S., & Roulin, A. (2009). Pheomelanin‐Based Coloration and the Ability to Cope with Variation in Food Supply and Parasitism. The American Naturalist, 174(4), 548–556. https://doi.org/10.1086/605374
- Poulton, E. (1890). The Colours of Animals : Their Meaning and Use, Especially Considered in the Case of Insects. D. Appleton, 1890.
- Powell, R. A. (1982). Evolution of Black-Tipped Tails in Weasels : Predator Confusion. The American Naturalist, 119(1), 126–131. https://doi.org/10.1086/283897
- Protas, M. E., Hersey, C., Kochanek, D., Zhou, Y., Wilkens, H., Jeffery, W. R.,… Tabin, C. J. (2006). Genetic analysis of cavefish reveals molecular convergence in the evolution of albinism. Nature Genetics, 38(1), 107–111. https://doi.org/10.1038/ng1700
- Prum, R. O. (2012). Aesthetic evolution by mate choice : Darwin’s really dangerous idea. Philosophical Transactions of the Royal Society B : Biological Sciences, 367(1600), 2253–2265. https://doi.org/10.1098/rstb.2011.0285
- Rohwer, S. (1978). Passerine Subadult Plumages and the Deceptive Acquisition of Resources : Test of a Critical Assumption. The Condor, 80(2), 173. https://doi.org/10.2307/1367916
- Roulin, A. (2009). Covariation between eumelanic pigmentation and body mass only under specific conditions. Naturwissenschaften, 96(3), 375–382. https://doi.org/10.1007/s00114-008-0489-2
- Rowland, H. M. (2011). The history, theory and evidence for a cryptic function of countershading. In Martin Stevens & S. Merilaita (Eds.), Animal Camouflage : from mechanisms to function. (pp. 53–72). https://doi.org/10.1017/CBO9780511852053.004
- Rowland, H. M., Mappes, J., Ruxton, G. D., & Speed, M. P. (2010). Mimicry between unequally defended prey can be parasitic : evidence for quasi-Batesian mimicry. Ecology Letters, 13(12), 1494–1502. https://doi.org/10.1111/j.1461-0248.2010.01539.x
- Santana, S. E., Lynch Alfaro, J., & Alfaro, M. E. (2012). Adaptive evolution of facial colour patterns in Neotropical primates. Proceedings of the Royal Society B : Biological Sciences, 279(1736), 2204–2211. https://doi.org/10.1098/rspb.2011.2326
- Seehausen, O., Terai, Y., Magalhaes, I. S., Carleton, K. L., Mrosso, H. D. J., Miyagi, R.,… Okada, N. (2008). Speciation through sensory drive in cichlid fish. Nature, 455(7213), 620–626. https://doi.org/10.1038/nature07285
- Senar, J. (2006). Color displays as intrasexual signals of aggression and dominance. In G.. Hill & K. McGraw (Eds.), Bird Coloration : Function and evolution (pp. 87–136). Harvard University Press.
- Skelhorn, J., Rowland, H. M., Speed, M. P., & Ruxton, G. D. (2010). Masquerade : Camouflage Without Crypsis. Science, 327(5961), 51–51. https://doi.org/10.1126/science.1181931
- Speed, M. P. (2000). Warning signals, receiver psychology and predator memory. Animal Behaviour, 60(3), 269–278. https://doi.org/10.1006/anbe.2000.1430
- Stevens, M., & Merilaita, S. (2009). Animal camouflage : current issues and new perspectives. Philosophical Transactions of the Royal Society B : Biological Sciences, 364(1516), 423–427. https://doi.org/10.1098/rstb.2008.0217
- Streelman, J. T., Alfaro, M., Westneat, M. W., Bellwood, D. R., & Karl, S. A. (2002). Evolutionary history of the parrotfishes : biogeography, ecomorphology, and comparative diversity. Evolution ; International Journal of Organic Evolution, 56(5), 961–971. https://doi.org/12093031
- Tanaka, Y. (1996). Social selection and the evolution of animal signals. Evolution, 50(2), 512–523. https://doi.org/10.1111/j.1558-5646.1996.tb03864.x
- Tibbetts, E. A., & Dale, J. (2004). A socially enforced signal of quality in a paper wasp. Nature, 432(7014), 218–222. https://doi.org/10.1038/nature02949
- Wagner, C. E., Harmon, L. J., & Seehausen, O. (2012). Ecological opportunity and sexual selection together predict adaptive radiation. Nature, 487(7407), 366–369. https://doi.org/10.1038/nature11144
- Wagner, G. P., Pavlicev, M., & Cheverud, J. M. (2007). The road to modularity. Nature Reviews Genetics, 8(12), 921–931. https://doi.org/10.1038/nrg2267
- Wallace, A. R. (1877). The colours of animals and plants. The American Naturalist, 11(12), 713–728.
- Wallace, A. R. (1895). Natural selection and tropical nature, 2nd edn. New York, NY : Macmillan and Co.
- Wolf, J. B., Brodie III, E. D., & Moore, A. J. (1999). Interacting Phenotypes and the Evolutionary Process. II. Selection Resulting from Social Interactions. The American Naturalist, 153(3), 254–266. https://doi.org/10.1086/303168
- Zahavi, A. (1975). Mate selection-a selection for a handicap. Journal of Theoretical Biology, 53(1), 205–214. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/1195756
- Zahavi, A. (1977). The cost of honesty (further remarks on the handicap principle). Journal of Theoretical Biology, 67(3), 603–605. Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/904334