Le prix Nobel de Chimie 2003 récompense Peter Agre et Roderick MacKinnon pour leurs travaux sur les canaux transmembranaires, ayant menés à la découverte des aquaporines, et à l’élucidation de la structure tridimensionnelle et du fonctionnement du canal potassium.
Le prix Nobel de Chimie 2003 a été décerné à Peter Agre (université Johns Hopkins, Baltimore, USA) et à Roderick MacKinnon (université Rockefeller, New York, USA). Ce prix récompense leurs travaux sur les canaux transmembranaires, ayant menés à la découverte des aquaporines, et à l’élucidation de la structure tridimensionnelle et du fonctionnement du canal potassium.
Peter Agre a découvert en 1988-1991 l’existence d’une protéine servant de canal pour l’eau : l’aquaporine (AQP1). Chez l’homme, au moins 11 aquaporines différentes sont maintenant connues. Elles se révèlent d’une importance considérable en permettant un transport d’eau important à travers la membrane. Les variations de leur expression permettent ainsi de contrôler ces mouvements d’eau. Chez l’homme, les aquaporines jouent ainsi un rôle fondamental dans les mouvements d’eau au niveau des tubules rénaux. La structure tridimensionnelle précise de la protéine AQP1 est connue depuis 2000-2001. La découverte, totalement inattendue, de Peter Agre a ainsi révolutionné en à peine 10 ans l’étude des flux d’eau à travers la membrane.
Roderick MacKinnon a réussi à élucider en 1998 la structure tridimensionnelle du canal potassium de Streptomyces lividans, KcsA. Cette structure montre un filtre de sélection qui permet la fixation d’ions K+ tout en rejetant les ions plus petits. Ce filtre de sélection se compose d’une série de sites de fixations qui, en mimant l’hydratation de l’ion K+, permettent de fixer des ions K+ sans leur couronne d’hydratation (voir la figure ci-dessous). Des comparaisons de structures ont permis à MacKinnon de montrer que des changements de conformation des hélices membranaires de ces canaux permettent de les ouvrir ou de les fermer.
Ces découvertes ont posé les bases de nombreuses études en cours et à venir sur la compréhension moléculaire de nombreux mécanismes neuronaux, musculaires et cardiaques.
Figure 1 : Représentation schématique du canal potassium KcsA.
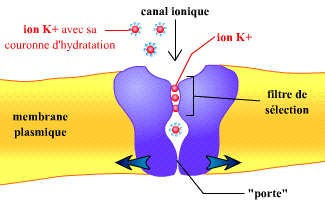 Noter la présence d'un filtre de sélection où les ions K+ se fixent sans leur couronne d'hydratation, et l'ouverture modulable par des changements de conformations de la porte du canal. Noter la présence d'un filtre de sélection où les ions K+ se fixent sans leur couronne d'hydratation, et l'ouverture modulable par des changements de conformations de la porte du canal. |
Plus d'informations :
- Télécharger le fichier PDB de AQP1 : 1FQY.pdb (155 Ko) - 1FQY.zip (compréssé - 34 Ko)
- Télécharger le fichier PDB de KcsA : 1BL8.pdb (155 Ko) - 1BL.zip (compréssé - 34 Ko)
- Communiqué de presse officiel (en Anglais)
- Site complet du Nobel e-Museum (en Anglais)







