L'épithélium olfactif est spécialisé dans la perception des odeurs et, comme les autres épithéliums, sa fonction pourrait être modifiée par le microbiote. Des études réalisées chez la souris montrent que la fonction de l'épithélium olfactif est altérée chez des animaux sans microbiote. De plus, l'attrait des souris pour différentes odeurs change en fonction du microbiote qu'elles hébergent, ce qui pourrait avoir un effet sur leurs comportements, aussi bien alimentaires que sociaux.
Microbiote et épithéliums
Nous sommes colonisés par un à deux kilogrammes de microorganismes. Ces bactéries, virus et champignons sont présents sur toute la surface de notre corps et forment le microbiote. Même si la majorité de ces microorganismes est présente dans notre intestin, on en trouve également dans nos alvéoles pulmonaires, et au contact de toutes nos muqueuses. L’étude de l’influence du microbiote sur l’épithélium intestinal a connu un développement considérable depuis sa caractérisation génétique (Gill et coll., 2006). Il est désormais bien admis que cette influence s’étend sur la plupart des grandes fonctions, allant d’implications dans la régulation de la pression artérielle à la prise alimentaire en passant par des troubles cognitifs tels que l’autisme (Buffington et coll., 2016).
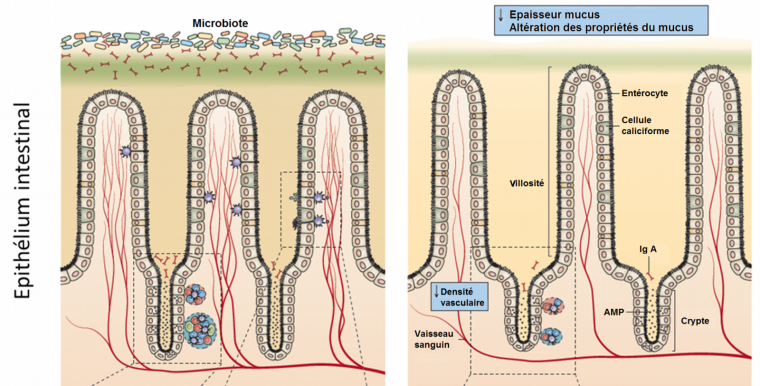
Les premières études sur des animaux axéniques, c'est-à-dire dénués de microbiote, montrent que leur épithélium intestinal est profondément modifié par rapport aux animaux témoins. Chez les animaux axéniques, la couche de mucus est réduite, les villosités intestinales plus fines, plus longues et moins richement vascularisées. Enfin, les zones de développement du système immunitaire (plaques de Peyer) sont réduites (Figure 1).
En l’absence de microbiote (à droite), l’épithélium est profondément altéré. Les villosités sont plus longues, plus fines et moins vascularisées. La couche de mucus est également plus fine. Les plaques de Peyer, où se développe le système immunitaire en lien avec l’épithélium intestinal, sont également réduites.
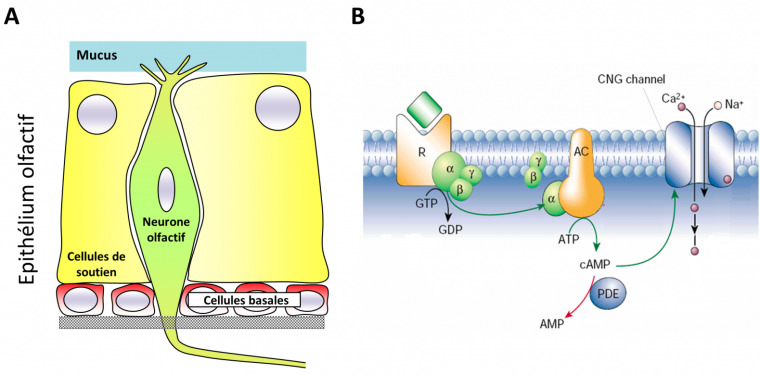
De manière étonnante, alors que les recherches sur les relations entre microbiote intestinal et physiologie sont très avancées (Sommer et Backhed, 2013), très peu d’études se sont focalisées sur les autres épithéliums. Parmi eux, on trouve notamment l’épithélium olfactif qui a été complètement négligé. Cet épithélium est en contact direct avec l’environnement et donc avec le microbiote, et réalise la première étape de la détection des odeurs (Figure 2A). Brièvement, chez les Vertébrés aériens, les molécules odorantes arrivent dans la cavité nasale et sont solubilisées dans le mucus secrété par des cellules de soutien, probablement à l’aide de protéines (OBP pour odorant-binding proteins) capables de lier ces molécules hydrophobes. Ces odorants activent les neurones olfactifs en se liant aux récepteurs olfactifs exprimés au niveau de leurs cils (Figure 2B). Ces récepteurs activent ensuite une protéine G particulière (Golf) qui à son tour active une adénylate cyclase (ACIII) produisant le second messager AMPc. Cette élévation d’AMPc permet d’augmenter la probabilité d’ouverture de canaux ioniques (CNGa2) conduisant à la dépolarisation neuronale. Le signal se termine via la dégradation des molécules odorantes dans le mucus et en parallèle l’hydrolyse de l’AMPc par une phosphodiestérase (PDE).
(A) Cet épithélium est principalement composé de cellules neuronales dont les dendrites sont modifiées en cils sensoriels contenant les protéines de la cascade de transduction. Ces cils baignent dans un mucus dont la composition est entre autre dépendante de l’activité de cellules de soutien et comporte des protéines OBP liant les molécules odorantes. Ce neuroépithélium se renouvelle régulièrement à partir de cellules basales pluripotentes. (B) Selon leur affinité pour les récepteurs olfactifs (R), les molécules odorantes (carré vert) se retrouvant dans le mucus peuvent s’y fixer. Ceci entraîne une modification de la structure du récepteur olfactif qui aboutit à l’activation d’une protéine Golf conduisant à la séparation des unités αßϒ. La sous unité α va à son tour activer l’adénylate cyclase III (AC), enzyme produisant de l’AMPc qui augmentera la probabilité d’ouverture de canaux cationiques (CNG). Cette augmentation aboutira à l’activation neuronale par dépolarisation. Elle prendra fin après élimination des odorants dans le mucus par des enzymes de détoxication et l’hydrolyse de l’AMPc par la phosphodiestérase (PDE).
Microbiote et épithélium olfactif ?
En 2016, aucune étude n’avait été réalisée afin d’élucider si le microbiote pouvait agir sur l’épithélium olfactif. Formulant tout d’abord l’hypothèse que le microbiote pourrait altérer la structure de l’épithélium olfactif comme il le fait au niveau intestinal, nous avons réalisé une étude comparée anatomohistologique et fonctionnelle entre souris axéniques (sans microbiote) et conventionnelles (témoins) (Francois et coll., 2016). Nous avons tout d’abord montré qu’il existait chez les animaux conventionnels un microbiote au niveau de l’épithélium olfactif dont la composition est assez proche de ce qu’on peut trouver dans le reste des voies aériennes.
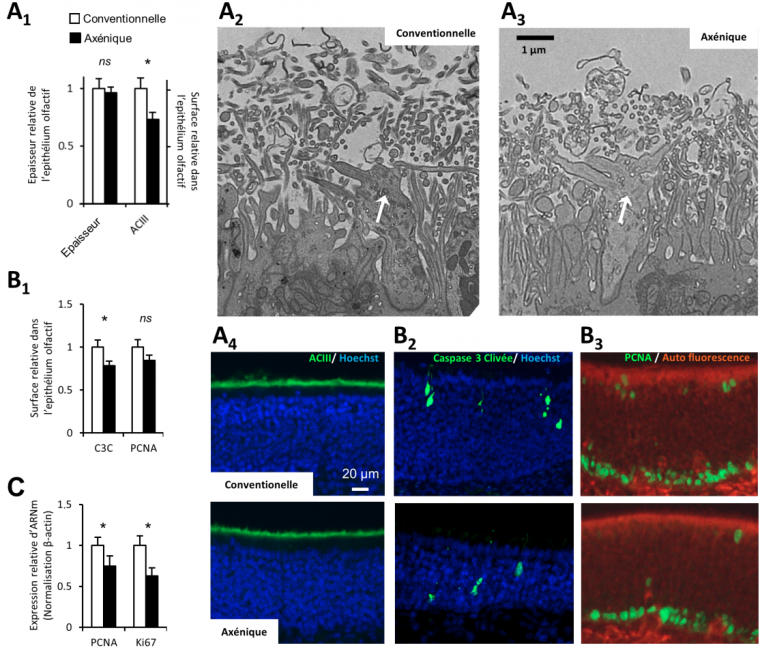
Nous avons pu montrer que l’absence globale de microbiote ne modifiait pas la structure de l’épithélium olfactif de manière drastique comme il le fait au niveau de l’épithélium intestinal. Son épaisseur n’est pas modifiée, mais son renouvellement est ralenti (Figure 3).
Contrairement à ce qui se passe au niveau intestinal, en absence de microbiote, l’épithélium olfactif n’est pas fortement altéré. Son épaisseur n’est pas différente entre animaux conventionnels et axéniques. Par contre la couche de cils est réduite. (A1) Moyenne relative de l’épaisseur de l’épithélium et moyenne relative de la surface des cils, visualisée par immunohistomarquage dirigé contre l’ACIII (± ESM – écart standard à la moyenne, n = 8). Exemple d’images des boutons dendritiques (flèches blanches) des neurones olfactifs portant les cils en microscopie électronique à transmission (× 2000) chez une souris conventionnelle (A2) ou axénique (A3). Exemple de marquage des cils par la localisation immunohistochimique de l’ACIII. Les noyaux sont marqués par un agent intercalant fluorescent (Hoechst) (A4). Le renouvellement cellulaire est également ralenti chez les axéniques. (B1) Surface de marquage immunohistochimique de la caspase 3 clivée (C3C), enzyme clef de la voie majeure de l’apoptose dans la muqueuse olfactive et de PCNA, protéine présente dans les cellules en division. Les valeurs sont les moyennes relatives de surface marquées (± ESM, n = 8). Exemple de marquage de la caspase 3 clivée (B2) et de PCNA (B3). La baisse de la prolifération cellulaire dans l’épithélium olfactif des souris axéniques a été confirmée par mesure de l’expression de l’ARNm codant pour PCNA et Ki67, autre protéine exprimée dans les cellules en division (C). Les valeurs représentent la moyenne relative de l’expression de l’ARNm mesurée en PCR quantitative (± ESM, n = 7).*P < 0,05.
L’épithélium olfactif est un tissu particulièrement dynamique sur le plan cellulaire avec une régénération continue des neurones olfactifs (neurogenèse). Afin de maintenir l’homéostasie du tissu, la prolifération de l’épithélium est proportionnelle aux dégâts qu’il subit. La baisse du renouvellement de l’épithélium observée chez les animaux axéniques est donc probablement en lien avec la baisse de la toxicité environnementale suite à la disparition des microorganismes habituellement présents dans la cavité nasale.
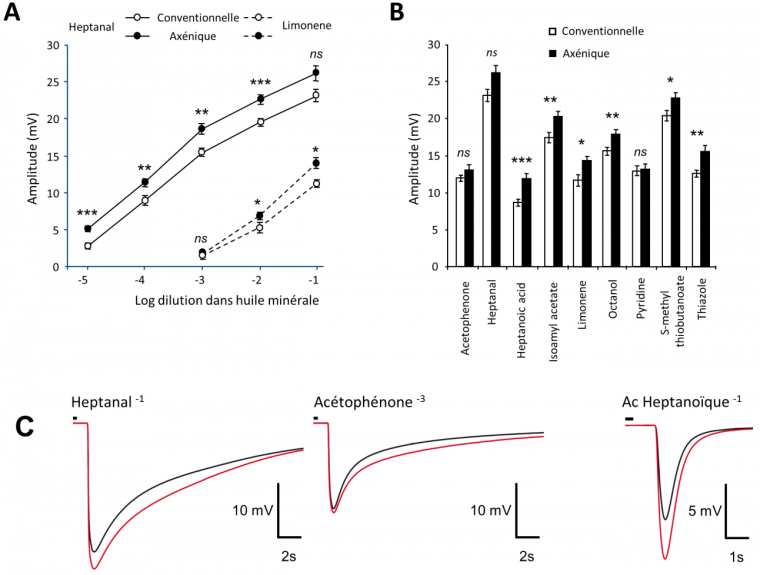
Nous observons de plus que chez les animaux axéniques, la couche ciliaire des neurones olfactifs où se déroule la détection des odorants est plus mince. Paradoxalement, les signaux électriques neuronaux générés par l’arrivée des odorants sont plus intenses chez les animaux axéniques (Figure 4).
Dose réponse à des stimulations croissantes d’heptanal et de limonène, deux odorants classiquement utilisés (A), et à des molécules odorantes de structures variées (B). Les valeurs représentent l’amplitude moyenne ± ESM (n = 12) (*P < 0,05; **P < 0.01; ***P < 0.001, ns : non significatif). (C) Tracés moyennés d’enregistrements lors de stimulation avec différentes molécules odorantes (noir : souris conventionnelles / rouge : souris axéniques). La petite barre au-dessus des enregistrements représente le temps de la stimulation (200 ms). Ces enregistrements extracellulaires sont réalisés en potentiel de champs. Les signaux résultent de la sommation des potentiels récepteurs d’une population de neurones olfactifs à proximité de l’électrode d’enregistrements.
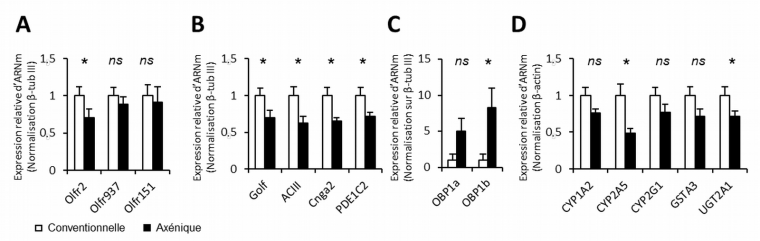
Autre paradoxe, on observe une baisse de l’expression de la plupart des gènes associés à la détection des odorants chez ces mêmes animaux axéniques, ce qui devrait se traduire par une détection des odorants moins efficace et donc des signaux électriques neuronaux plus faibles en réponse aux odorants (Figure 5). De manière étonnante, nous observons une forte augmentation de l’expression des gènes codant les OBP. Ce résultat pourrait être en fait lié à un rôle inattendu observé récemment pour ces protéines qui auraient une action antibiotique (Bianchi et coll., 2019) en lien avec l’immunité innée. Or les animaux axéniques sont connus pour avoir un dérèglement dans l’expression des gènes liés à l’immunité.
Expression relative des gènes codant pour trois récepteurs olfactifs (A), pour les éléments de la transduction olfactive (B), pour les protéines supposées lier les molécules odorantes dans le mucus (C) et pour quelques enzymes de détoxification impliquées dans le métabolisme des molécules odorantes (D). Les valeurs représentent la moyenne relative de l’expression de l’ARNm mesurée en PCR quantitative (± ESM, n = 7).*P < 0,05
Chez la souris, le microbiote modifie les préférences olfactives…
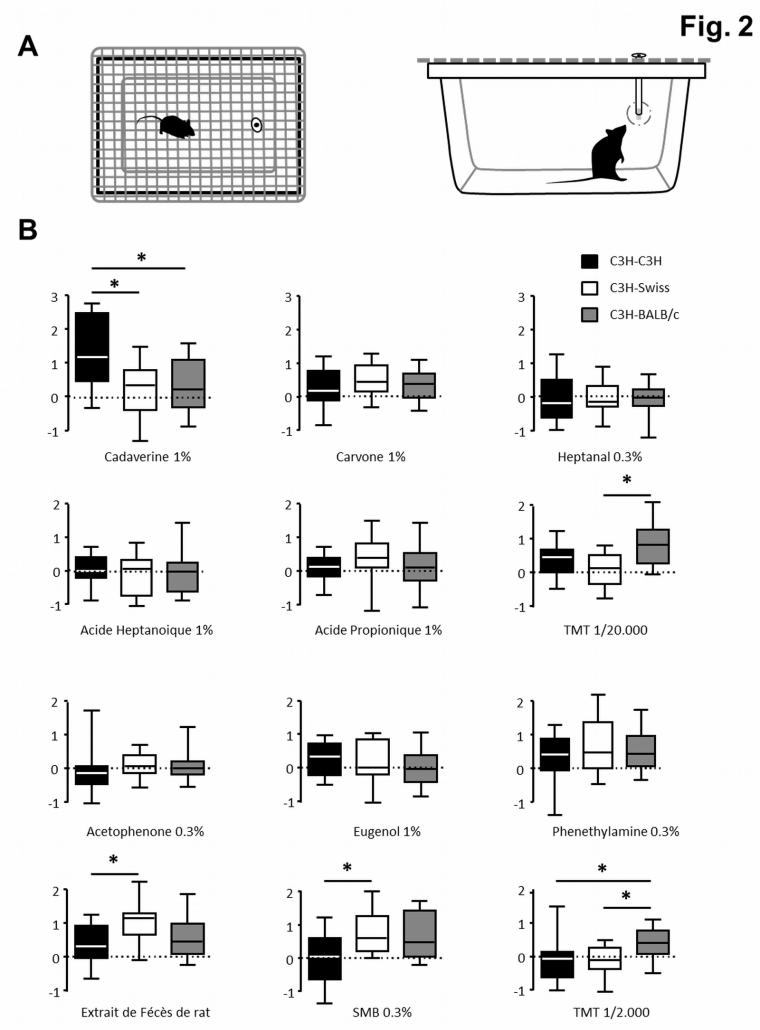
Malgré ces paradoxes, notre première étude montre clairement que le microbiote peut influencer le fonctionnement de l’épithélium olfactif, notamment la première étape de détection des odorants, et donc moduler l’olfaction, fonction sensorielle majeure chez les animaux. Afin d’étudier l’influence du microbiote sur les préférences olfactives des souris, nous avons réalisé une nouvelle série d’expériences. Nous avons colonisé des souris axéniques (souche C3H) avec des microbiotes provenant de souris de fonds génétiques différents ou identiques (souris Swiss, Balb/c et C3H). Selon la nature du microbiote transplanté, ces souris ayant le même fond génétique se sont intéressées différemment à un panel de molécules odorantes (Figure 6).
Trois groupes de souris différentes sont testées. Toutes ont le même fond génétique C3H mais sont issues de parents axéniques ayant cohabité avec des souris conventionnelles de fond génétique différents (Swiss, Balb/c et C3H donnant respectivement les groupes C3H-Swiss, C3H-Balb/C, C3H-C3H). Or il a été montré que le fond génétique des souris influence la nature du microbiote qu’elles abritent. Comme les souris sont naturellement coprophages et de nature très sociales, les souris de fond génétique C3H vont être colonisées par des microbiotes de nature différente. (A) Lors du test, la souris, isolée dans une cage propre, est mise en présence d’un papier odorisé et on mesure le temps qu’elle passe à sa proximité. (B) Ce temps est ensuite normalisé par rapport au temps total d’exploration de la souris vis-à-vis de toutes les odeurs qu’elle a testées et au temps passé à explorer le solvant inodore (huile minérale). Une valeur de zéro indique donc une exploration similaire à un papier inodore, une valeur supérieure/inférieure un(e) intérêt/répulsion potentiel(le) pour cette odeur (si la différence est statistiquement validée). La médiane est représentée par une ligne au milieu d’une boite dont les côtés représentent les interquartiles. Les barres représentent les valeurs minimales et maximales. *P < 0.05.
Nous avons observé que ces souris s’intéressent de manières différentes à un panel d’odeurs selon la nature de leur microbiote. Par exemple, les souris colonisées par un microbiote C3H se montrent plus intéressées par l’odeur de la cadavérine, tandis que les souris colonisées par un microbiote BALB/c sont significativement plus attirées par le TMT que celles colonisées par les deux autres types de microbiote.
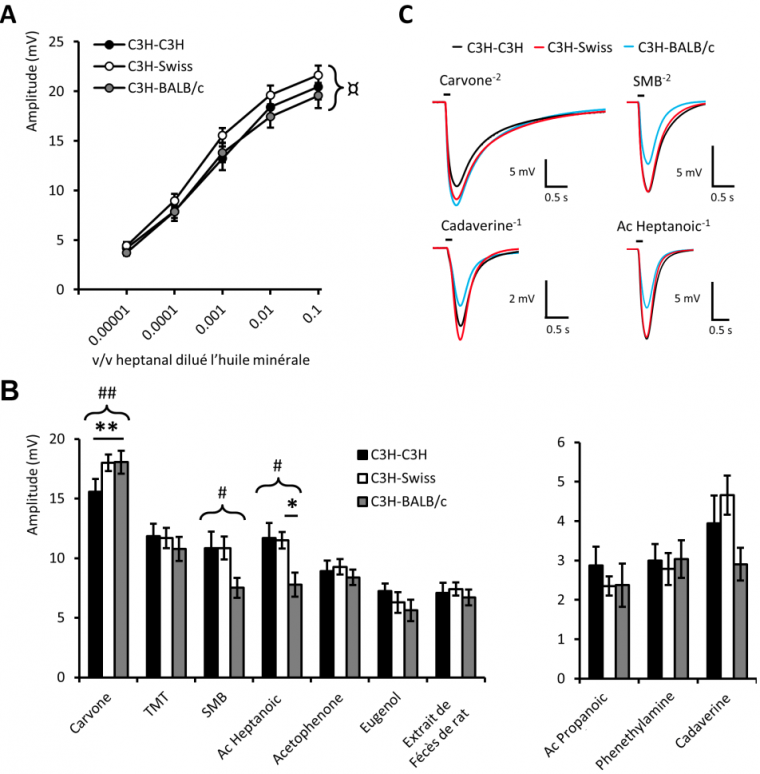
De plus, si on enregistre l’activité électrique de leur épithélium olfactif en réponse aux odeurs testées, on observe là encore des différences en fonction du microbiote qui colonise les souris (Figure 7).
Dose réponse à des stimulations croissantes d’heptanal (A) et à des molécules odorantes de structures variées (B). Les valeurs représentent l’amplitude moyenne ± ESM (n = 8) (ANOVA unidirectionnelle portant sur les 3 groupes de souris, #P < 0,05 ; ##P < 0,01 suivie par un test post-hoc de Bonferroni *P < 0,05 ; **P < 0,01 ; *P < 0,05 ; **P < 0,01 ; ***P < 0,001 ; ns : non significatif). (C) Traces moyennées d’enregistrements lors de stimulation avec différentes molécules odorantes. La petite barre au-dessus des enregistrements représente le temps de la stimulation (200 ms).
De manière intrigante, ce ne sont pas les mêmes odeurs qui sont détectées de manière différentielle en comportement et au niveau de l’activité électrique qu’ils engendrent dans l’épithélium. Ainsi, les stimulations avec la carvone induisent des réponses plus faibles dans le groupe C3H (Figure 7B) alors que les souris s’y intéressent de manière similaire en comportement (Figure 6B). Comme le comportement de la souris résulte de l’intégration de nombreuses structures cérébrales recevant l’information de l’épithélium olfactif, ce dernier résultat suggère que la nature du microbiote influence la manière dont sont interprétées les odeurs chez la souris. Comment cela pourrait-il se produire ? Le microbiote et le monde des odeurs sont en fait très liés puisque la majorité de nos odeurs corporelles sont issues du métabolisme de nos bactéries. Il en est de même chez les rongeurs où l’odeur corporelle va donc être dépendante du microbiote. Or, de nombreuses études récentes chez les rongeurs montrent que les préférences olfactives sont très dépendantes des odeurs de l’environnement pendant le développement cérébral et ce dès le développement utérin. Ainsi, il n’est pas étonnant que la manière dont la souris apprécie son environnement odorant une fois adulte puisse être influencée par son microbiote.
Nos résultats montrent donc que la nature du microbiote influence la façon dont les souris perçoivent les odeurs et s’y intéressent. Qu’en est-il alors de l’influence du microbiote sur les relations sociales des rongeurs sachant que l’odeur de ceux-ci dépend des molécules produites en grande partie par… leur microbiote ?
… ce qui relativise les résultats d’autres études utilisant ce modèle
Chez la majorité des Mammifères, l’olfaction a un rôle fondamental dans les interactions sociales. Ainsi, des souris rendues génétiquement anosmiques – sans odorat – perdent notamment tout comportement reproducteur, de défense de leur territoire ou de leurs petits. Si le microbiote affecte le fonctionnement du système olfactif des souris alors les résultats d’études comportementales liées au microbiote effectuées chez les rongeurs doivent être reconsidérés sous cet angle. Ainsi, une étude récente montre que la nature du microbiote joue un rôle majeur dans le comportement « autiste » de souris modèles de cette maladie (Buffington et coll., 2016). Or les auteurs de cette étude n’envisagent pas que le comportement des souris puisse être simplement affecté par leur microbiote, qui modifie la manière dont celles-ci appréhendent les odeurs de l’environnement. Si c’est le cas, ces souris représenteraient alors un très mauvais modèle d’autisme vis-à-vis des critères de cette pathologie chez l’Homme dont les relations sociales ne sont pas majoritairement basées sur la reconnaissance des odeurs corporelles ! De la même manière, ceci pourrait relativiser certains résultats obtenus sur des modèles de maladies neurologiques où le microbiote est impliqué mais l’hypothèse d’une atteinte des capacités olfactives jamais envisagée (voir l’article publié dans The Conversation). Par contre, si comme chez le rongeur, notre microbiote modifie notre manière d’appréhender notre environnement odorant, il est tout à fait envisageable que nos choix alimentaires, qui eux sont grandement influencés par notre odorat, puissent être affectés par notre microbiote !
Références
- Bianchi, F., Flisi, S., Careri, M., Riboni, N., Resimini, S., Sala, A., Conti, V., Mattarozzi, M., Taddei, S., Spadini, C. et al. (2019). Vertebrate odorant binding proteins as antimicrobial humoral components of innate immunity for pathogenic microorganisms. PLoS One 14, e0213545.
- Buffington SA, Di Prisco GV, Auchtung TA, Ajami NJ, Petrosino JF, Costa-Mattioli M (2016) Microbial Reconstitution Reverses Maternal Diet-Induced Social and Synaptic Deficits in Offspring. Cell 165 :1762-1775.
- Firestein S (2001) How the olfactory system makes sense of scents. Nature 413 :211-218.
- Francois A, Grebert D, Rhimi M, Mariadassou M, Naudon L, Rabot S, Meunier N (2016) Olfactory epithelium changes in germfree mice. Scientific reports 6 :24687.
- Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE (2006) Metagenomic analysis of the human distal gut microbiome. Science 312 :1355-1359.
- Naudon, L., Francois, A., Mariadassou, M., Monnoye, M., Philippe, C., Bruneau, A., Dussauze, M., Rue, O., Rabot, S. and Meunier, N. (2020). First step of odorant detection in the olfactory epithelium and olfactory preferences differ according to the microbiota profile in mice. Behav Brain Res, 112549.
- Sommer F, Backhed F (2013) The gut microbiota--masters of host development and physiology. Nature reviews Microbiology 11 :227-238.