Auteur : Didier Pol
Table des matières
- Protocole de dissection
- Isolement du coeur
- Enregistrement vidéo de l'activité du coeur
- Liquides physiologies pour coeur isolé
- Coloration du coeur d'escargot in situ
1. Protocole dissection
Il est possible d'observer le cœur d'escargot in situ après ouverture de la coquille ou de l'isoler in vitro pour montrer l'automatisme cardiaque ou pour tester l'action de divers facteurs sur la fréquence cardiaque. On aura avantage à utiliser l'escargot de Bourgogne, Helix pomatia plutôt que le petit-gris, Helix aspersa, qui est plus petit ce qui rend l'opération plus délicate.
- Préparer du liquide physiologique pour cœur d'escargot selon les indications ci-dessous.
- Briser la coquille au dessus de son orifice (par exemple avec une pince plate tenue par les mors) à l'endroit indiqué sur la photo ci-dessous par une croix noire.
 |
- Agrandir la brèche à la pince en direction du sommet en faisant attention à ne pas déchirer les tissus.
 |
- Enlever les débris de coquille jusqu'à exposer le rein (organe de Bojanus) repérable par sa couleur gris-jaune. Le cœur est situé en dessous de sa partie postérieure. Repérer l'emplacement du cœur visible par ses contractions et ouvrir le péricarde avec des ciseaux fins pour le faire apparaître. Sur les photos ci-dessous, un fil a été passé sous l'oreillette pour faciliter le repérage du cœur.
 |
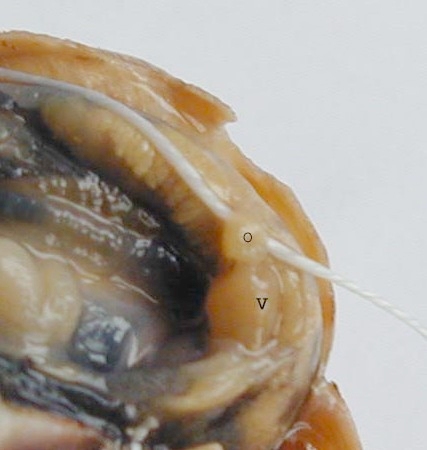 O : oreillette ; V : ventricule O : oreillette ; V : ventricule
|
2. isolement du coeur
- Passer deux fils sous le cœur, l'un sous la jonction entre veine pulmonaire et oreillette, l'autre sous la jonction entre ventricule et aorte.
- Ligaturer l'oreillette avec le premier fil.
- Sectionner l'oreillette en amont de la ligature.
- Ligaturer l'aorte qui prolonge le ventricule et la sectionner en aval de la ligature
- Placer le cœur isolé dans du liquide physiologique
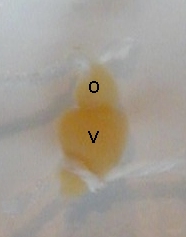 O : oreillette ; V : ventricule O : oreillette ; V : ventricule
|
3. Enregistrement vidéo de l'activité du coeur
Après isolement du cœur d'escargot, l'organe est placé dans un petit cristallisoir rempli de liquide physiologique.
L'activité cardiaque peut être filmée avec un appareil photo numérique comportant une fonction vidéo, avec un camescope ou avec une simple webcam. On peut aussi envisager de réaliser diverses mesures sur les images avec des logiciels appropriés tels que Mesurim téléchargeable sur le site de l'Académie d'Amiens.
L'animation suivante montre le résultat obtenu.
 Cliquer sur l'image pour lancer l'animation. Cliquer sur l'image pour lancer l'animation.
|
4. Liquides physiologiques pour coeur isolé
Liquides physiologiques pour cœur d'escargot isolé (quantités pour 1 L d'eau distillée neutre) :
|
Masse en g pour 1 L (Concentration molaire finale) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Eau | 1 L | 1 L | 1 L |
5. Coloration du coeur d'escargot in situ
Il est possible d'injecter le cœur d'escargot in situ avec un produit coloré pour étudier son organisation anatomique, notamment pour montrer que, contrairement à celui des vertébrés, le cœur d'escargot est une pompe unique ne comportant que deux cavités, oreillette et venticule. L'injection permet également d'identifier l'aorte en continuité avec l'unique ventricule.
5.1. Protocole
- Préparer le colorant d'injection selon les indications ci-dessous.
- Ouvrir la coquille pour mettre à nu le cœur
- Réaliser avec des ciseaux fins une boutonnière au niveau de la jonction entre veine pulmonaire et oreillette.
- Injecter lentement le colorant par la boutonnière avec une seringue jusqu'à ce que le cœur et l'aorte se remplissent.
5.2 Résultat
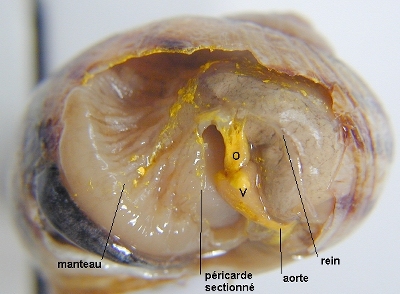
Le cœur et les vaisseaux remplis du colorant se distinguent alors aisément des autres organes.
 |
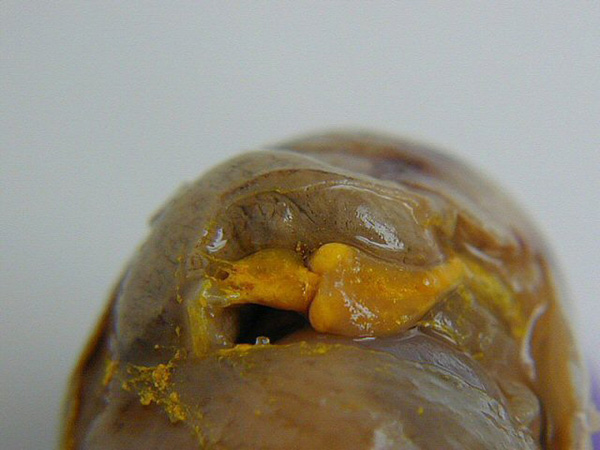 |
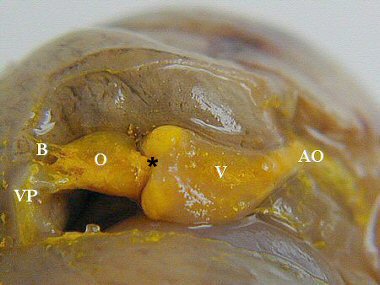 VP : veine pulmonaire ; B : boutonnière pour l'injection ; VP : veine pulmonaire ; B : boutonnière pour l'injection ;O : oreillette ; V : ventricule ; AO : aorte ; * : emplacement de la valve auriculo-ventriculaire. |
5.3. Préparation du colorant d'injection
Le colorant est à préparer extemporanément :
- Préparer une solution d’acétate de plomb à saturation dans 20 mL d'eau distillée (utiliser un agitateur magnétique et ajouter progressivement l'acétate de plomb jusqu'à ce qu'il ne se dissolve plus).
- Dissoudre 2 g de bichromate de potassium dans la solution d'acétate de plomb.
- Attendre quelques minutes la formation du précipité jaune.
- Récupérer le précipité avec une seringue sans aiguille
NB : Il s’agit de substances toxiques à ne pas laisser manipuler par de jeunes élèves et à éliminer selon les normes de sécurité en vigueur.





