Auteur : Marie Jeanne Pellerin
Marie Jeanne Pellerin enseigne au Lycée Charles le chauve de Roissy en Brie
Table des matières
1. Objectifs
1.1. Objectifs cognitifs
1.1.1 Observer les éléments d'un appareil circulatoire
- La pompe, le coeur.
- Les conduits , les veines et les artères omphalomésentériques.
- La zone d'échange, le réseau capillaire de la zone extrembryonnaire.
1.1.2. Découvrir l'automatisme cardiaque
- Au niveau de l'organisme: le coeur dans l'embryon.
- Au niveau de l'organe: le coeur isolé dans le boite à fond noir.
- Au niveau cellulaire: les fragments de coeur dans la salière.
On en déduit que l'automatisme cardiaque est une propriété cellulaire.
1.1.3. Comprendre que des facteurs issus de l'environnement peuvent faire varier ce rythme
- Température.
- Substances chimiques, adrénaline et acétylcholine.
- Choc mécanique, massage cardiaque à l'aide de la pipette Pasteur boutonnée.
Ceci permettra de comprendre qu'in vivo, des cellules nerveuses puissent faire varier le rythme cardiaque.
1.2. Objectifs techniques
La microdissection consiste à travailler sous une loupe binoculaire. avec des microinstruments. Elle requiert une forte concentration et une excellente précision des gestes. c'est une technique de plus en plus utilisée en chirurgie humaine.
Ce qui s'est passé vraiment
Je pensais travailler avec mes élèves sur l'automatisme cardiaque et nous avons débouché directment sur la vie et la mort. En effet lorsque le coeur de l'embryon s'arrêtait de battre, les élèves m'ont dit :
- "Il est mort."
- J'ai dit : "mettez-le dans l'étuve à 37°C." Le coeur s'est remis à battre.
- "Alors il n'était pas mort ?" ont dit les élèves ?
- "Madame c'est quoi la vie ? C'est quoi la mort ?"
Ce fut pour moi le TP le plus bouleversant de l'année.
2. Matériel
-
Des oeufs d'oiseaux (poule ou caille) mis à couver depuis 4 ou 5 jour. Nous les avons achetés à la ferme pédagogique située près de notre lycée. Sinon on peut se faire envoyer par la poste des oeufs de caille fécondés en s'adressant à des fournisseurs spécialisés.
Les oeufs d'oiseaux fécondés se conservent à 10-12°C (température de la cave à vin). On peut sans dommage les conserver 15 jours. Au-delà de 15 jours de conservation le pourcentage d'oeufs qui se développent diminue fortement.
On les met à couver au fur et à mesure des besoins pour la date prévue du TP. Si le début de l'incubation tombe un dimanche (où les lycées sont fermés), on installe les oeufs à couver le samedi. Pour les autres jours de la semaine, on utilise des oeufs couvés de 4 jours. Au-delà de 5 jours d'incubation les embryons sont très formés et cela peut choquer les élèves de tuer un être vivant. qui ressemble déjà beaucoup à un oiseau. A 4 jours ou 5 jours l'embryon est petit et ne ressemble pas encore à un oiseau. Les élèves ne manifestent aucune réticence. Je leur signale que ces oeufs fécondés ou pas sont normalement destinés à l'omelette. Nourrir intellectuellement deux élèves avec un oeuf est bien aussi noble qu'en nourrir physiquement un seul avec deux oeufs ! - Une étuve ou un incubateur. N'importe quelle petite étuve qui exisitent dans de très nombreux lycées suffisent pour incuber ces oeufs durant 4 jours. Les oeufs de caille présentent l'avantage d'être de petite taille et on peut sans problème en mettre 20 à couver dans une même étuve.
- Liquide physiologique de Tyrode (sérum physiologique tamponné).
- De l'adrénaline.
- De l'acétylcholine.
- Pots de yaourt en verre (pour jeter les débris de coquille).
- Pots de crème dessert en verre (petit récipient pour faire couler le contenu de l'oeuf).
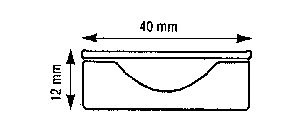
- Rince-doigt (récipient très peitit pour rincer l'embryon).
- Boîtes de Pétri de 5 cm de diamètre dans lesquelles on a coulé de la parafine et du charbon afin de réaliser un fond noir ou du rhodorsil coloré en noir. Le colorant noir est du charbon en poudre.
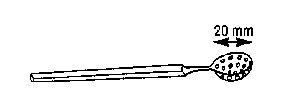
- Salières en verre (très petit récipient pour receuillir le coeur de l'embryon).
- Paires de ciseaux pour découper la coquille.
- Pêchettes pour récupérer l'embryon. Nous utilisons des cuillères perforées en inox qui sont vendues pour les ophtalmologistes afin de prélever des cornées humaines. Ces outils sont très fragiles et très onéreux (400F pièce TTC). Je n'ai pas trouvé jusqu'ici une bonne solution de remplacement. à ce mini écumoires (les petites cuillers en plastique dans lesquelles on fait des trous avec une aiguille chauffée ont l'inconvénient d'être non mouillables et on a bien du mal à attrapper l'embryon avec.
- Des microscalpels qui sont des mandrins dans lesquels on introduit des aiguilles à coudre que l'on affûte à la pierre à huile pour les rendre tranchantes. On peut avantageusement les remplacer par des aiguilles montées affûtées de même à la pierre à huile. C'est moins onéreux et surtout moins fragile.
- Des épingles à insectes de taille 00 pour épingler l'embryon.
- Des pipettes Pasteur en verre munies de compte-goutte.
- Des loupes binoculaires et leur éclairage.
Le plan de travail doit être organisé de façon à ce que les récipients soient alignés les uns à la suite des autres dans l'ordre de leur utilisation soit : du plus grand au plus petit : (pot de yaourt, pot de crème, rince-doigt, boite à fond noir, salière).
 |
 |
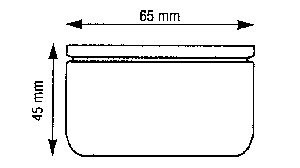
| 1. Salière | 2. Péchette |
 |
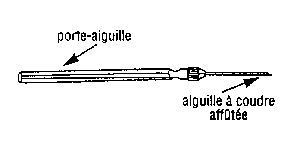 |
| 3. Saladier "rince-doigts" | 4. Micro-scalpel |
 |
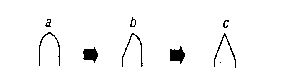 |
| 5. Récipient pour le liquide de Tyrode | 6. Affutage de la lame du micro-scalpel |
Tous les récipients sont remplis de liquide de Tyrode sauf le pot de yaourt.
3. Protocole suivi
 |
 |
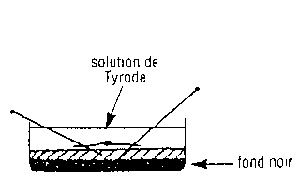
| Comment ouvrir l'oeuf ? | L'oeuf dans la solution de Tyrode |
 |
 |
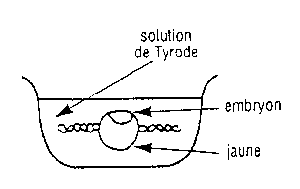
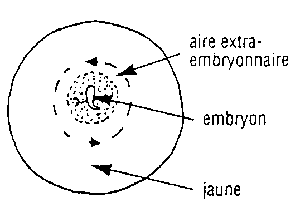
| Repérer l'aire extra-embryonnaire | L'embryon dans la boite de Petri à fond noir |
- Ouvir le petit bout de l'ouf à l'aide des ciseaux. Jeter la coquille dans le pot de yaourt vide. Si un embryon est présent le blanc est trouble et on observe une tache rouge sur le jaune: c'est l'embryon.
- Verser doucement le jaune dans le pot de crème en évitant de le crever. L'embryon remonte sur le dessus . S'il ne le fait pas tourner très doucement le jaune à l'aide de la pêchette. Si on est un peu trop brusque, onperd corps et bien l'embryon au sein du jaune.
- Découper à l'aide des ciseaux l'aire extra embryonnaire. Récupérer l'embryon à l'aide de la pêchette et trnsférez-le dans le rince-doigt.
- Rincer doucement l'embryon pour éliminer le reste du jaune qui gène son observation.
- Transférer à l'aide de la pêchette l'embryon rincé dans la boite de Pétri à fond noir. Epingler-le par son aire extra embryonnaire. Observez-le à la loupe binoculaire.
- Découper le vaisseau cardiaque à ses deux extrémités à l'aide des microscalpels.
- Aspirer le coeur isolé à l'aide de la pipette Pasteur et le transférer dans la salière. Observer que le coeur bat toujours. S'il est arrêté, le remettre dans l'étuve quelques minutes ou bien stimulez-le doucement en le tapottant à l'aide de l'extrémité de la pipette Pasteur. L'élévation de température et les chocs remettent le coeur en route.
- Découpez le coeur à l'aide des microscalpels en quatre morceaux. Ils battent toujours. L'automatisme cardiaque est une propriété des cellules et non de l'organe lui-même.
- Testez sur ces morceaux les effets de l'acétylcholine et de l'adrénaline. (10ng d'adrénaline par ml de milieu).Des substances chimiques peuvent modifier le rythme cardiaque.
4. Activités proposées aux élèves
Répondre à une question : qu'est-ce qui fait battre "mon" coeur ?
Apprendre un savoir faire technique : réaliser une microdissection.
4.1. Observer un embryon d'oiseau
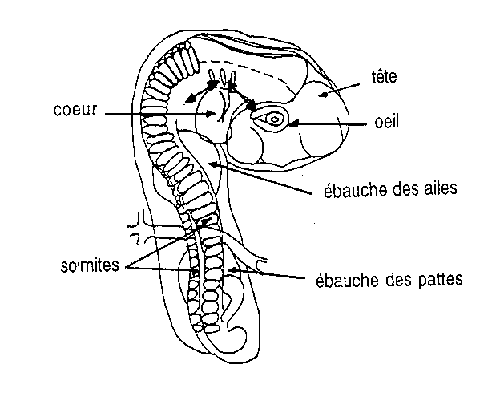 |
Ouvrir l'oeuf et rédigez le protocole suivi correspondant aux schémas.
4.2. Prélever le coeur d'un embryon
- A l'aide des microscalpels, isolez le coeur en sectionnant aux 2 endroits repérés par les flèches.
- A l'aide de la pipette Pasteur, aspirez le coeur et transférez-le dans la salière.
- Observez le coeur sous la loupe binoculaire.
- Le coeur bat-il toujours ?
Qu'en déduisez-vous quant au système qui fait battre le coeur ?
- A l'aide des microscalpels découpez le coeur en 3 à 4 morceaux. Que constatez-vous ?
Qu'en déduisez-vous quant au système qui fait battre le coeur ?
4.3. Etudier comment certains facteurs du milieu modifient le rythme cardiaque
4.3.1. Effets de la température
- Comptez durant 30 secondes le rythme de chacun des morceaux de coeur qui bat.
- Installez la salière dans l'étuve à 37°C durant 5 minutes.
- Comptez rapidement durant 30 secondes le rythme de chacun des morceaux de coeur. Que constatez-vous ?
| Morceaux | Nombre de battements en 30 secondes | |
| 22°C | 37°C | |
|
1 |
||
|
2 |
||
|
3 |
||
|
4 |
||
4.3.2. Effets de certaines substances chimiques
- Comptez durant 30 secondes le rythme de chacun des morceaux de coeur qui bat.
- Ajoutez 5 gouttes d'adrénaline. Attendez 30 secondes puis comptez le rythme de chacun des morceaux durant 30 secondes. Que constatez-vous ?
- Videz soigneusement à la pipette le liquide physiologique sans aspirer les morceaux de coeur. Ajoutez du liquide physiologique propre et comptez le rythme de chacun des morceaux.
- Ajoutez 5 gouttes d'acétylcholine. Attendez une minute puis comptez le rythme des morceaux qui battent durant 30 secondes. Que constatez-vous ?
| Morceaux | Nombre de battements en 30 secondes | |
| Initial | Avec adrénaline | |
|
1 |
||
|
2 |
||
|
3 |
||
|
4 |
||
| Morceaux | Nombre de battements en 30 secondes | |
| Initial | Avec acétylcholine | |
|
1 |
||
|
2 |
||
|
3 |
||
|
4 |
||
| Morceaux | Nombre de battements en 30 secondes | |
| Initial | Avec acétylcholine | |
|
1 |
||
|
2 |
||
|
3 |
||
|
4 |
||
Le truc du spécialiste : si le coeur cesse de battre, on peut le faire repartir grâce à un massage cardiaque (on comprime légèrement le coeur à l'aide de l'extrémité d'une pipette Pasteur non déboutonnée).
Bilan : Répondez à l'aide d'une phrase à la question posée par le titre





