Si l'ectoderme, le mésoderme et l'endoderme forment les trois feuillets embryonnaires des Bilatériens, les crêtes neurales pourraient bien, de part leur cohérence embryologique et fonctionnelle, constituer un quatrième feuillet embryonnaire, propre aux Vertébrés.
Cet article présente les mécanismes de formation des cellules des crêtes neurales, leurs devenirs, et discute de la place de ces cellules dans l'histoire évolutive des Vertébrés.
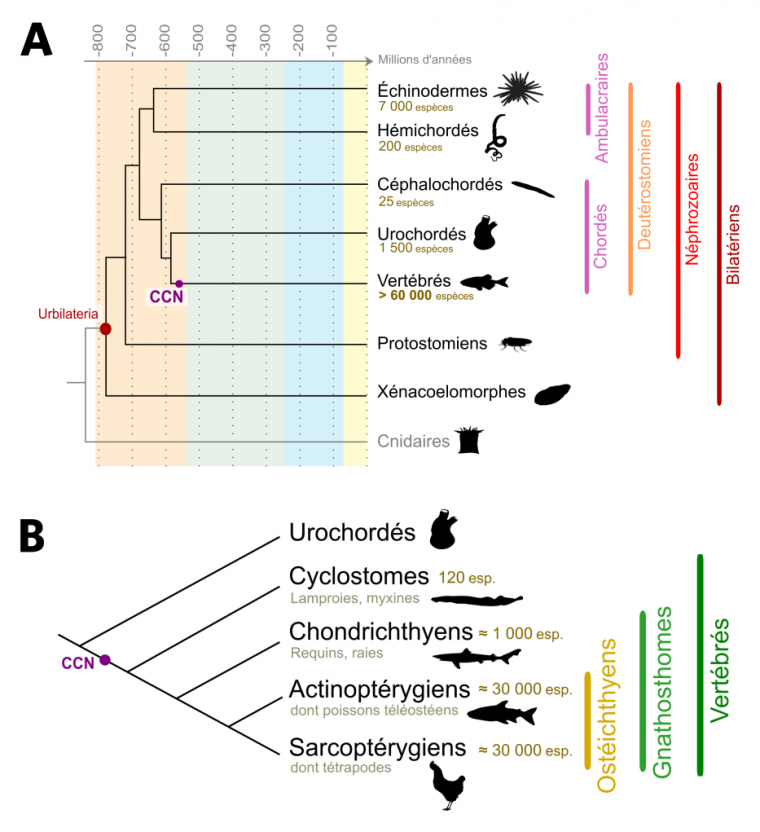
Les Vertébrés constituent un taxon d’animaux Bilatériens de plus de 60 000 espèces qui possèdent, à au moins un moment de leur développement, des vertèbres ou des rudiments de vertèbres [1]. Parmi celles-ci, environ 30 000 sont des poissons téléostéens quand les Mammifères ne représentent qu’entre 5 000 et 6 000 espèces (Fig. 1).
(A) Phylogénie simplifiée des organismes Bilatériens. L’ancêtre hypothétique des Bilatériens est appelé Urbilateria. Celui-ci a donné naissance aux Xénacoelomorphes, un groupe aujourd’hui réduit et dont la position systématique est discutée, et aux Néphrozoaires, eux-mêmes divisés en Protostomiens et en Deutérostomiens. Nous-mêmes, Vertébrés, appartenons aux Deutérostomiens Chordés, et les Urochordés sont, chez les Chordés, nos plus proches cousins. Un des premiers Vertébrés connu est Myllokunmigia (faune de Chengjang, environ 520 millions d’années). Le nombre d’espèces de Deutérostomiens ainsi que l’apparition des cellules des crêtes neurales (CCN) sont indiqués. Les âges sont en millions d’années. D’après Cannon et al., 2016.
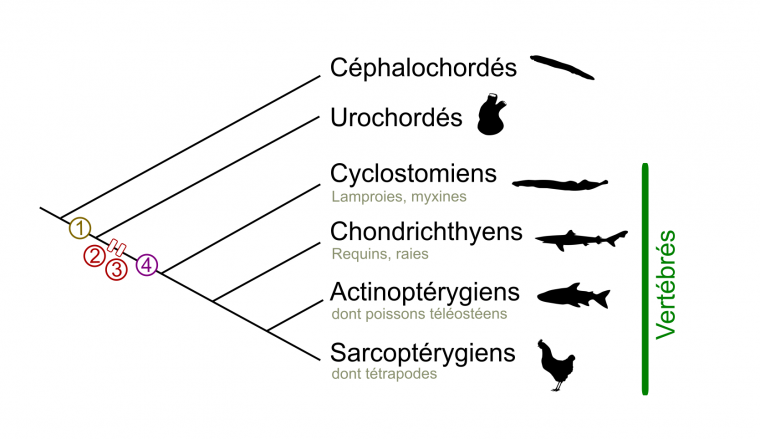
(B) Phylogénie simplifiée des Vertébrés. Les Vertébrés sont divisés en deux grands taxons : les Cyclostomes (aussi appelés Agnathes, ou Vertébrés sans mâchoire) et les Gnathostomes (Vertébrés avec mâchoire). Au sein des Gnathostomes, les Chondrichthyens (poissons cartilagineux) sont le groupe frère des Ostéichthyens (poissons osseux). Les Tétrapodes constituent la majorité des Sarcoptérygiens (Vertébrés à membres charnus), le groupe frère des Actinoptérygiens (poissons à nageoires rayonnées). Le nombre d’espèces ainsi que l’apparition des cellules des crêtes neurales (CCN) sont indiqués.
Les Vertébrés sont apparus il y a 500 millions d’années [3] et ont colonisé aujourd’hui tous les milieux de vie sur Terre, depuis les grands fonds marins (la donzelle Typhlonus nasus) jusqu’aux sommets des montagnes himalayennes (l’oie Anser indicus), depuis les déserts les plus arides (le lézard Apaurosaura anchieta) jusque dans les contrées les plus glaciales (le manchot empereur Aptenodytes forsteri).
D’après certains auteurs l’innovation évolutive ayant permis la radiation des Vertébrés et l’exploitation d’une aussi grande diversité de niches écologiques est un territoire cellulaire assez restreint, ne comptant que peu de cellules pendant l’essentiel du développement embryonnaire (comparé aux autres territoires) et se mettant en place assez tard pendant le développement : les cellules des crêtes neurales (CCN).
Par la suite nous présenterons en premier lieu ce que sont ces cellules, et ce qu’elles deviennent au cours du développement. Nous verrons ensuite quels sont les signaux qui les induisent et comment elles migrent et se différencient. Nous discuterons enfin de l’apport de travaux récents sur l’origine évolutive de ces cellules, intimement liées à l’histoire des Vertébrés – notre histoire.
Les crêtes neurales : des territoires cellulaires restreints aux dérivés multiples
Les crêtes neurales se forment à la bordure de la plaque neurale
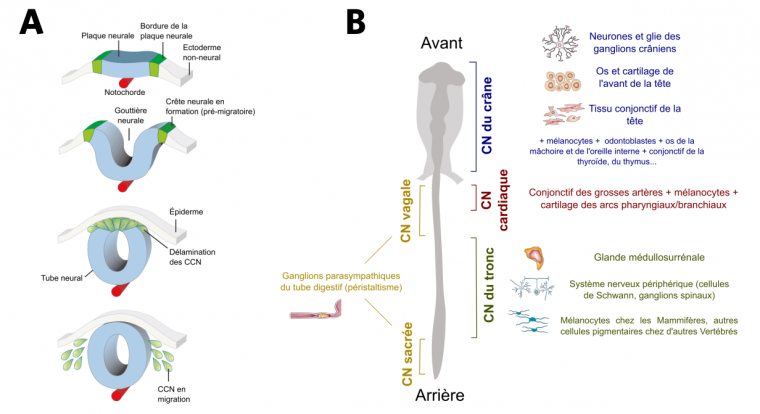
Durant le développement embryonnaire, le système nerveux central se met en place lors d’une étape appelée neurulation. Suite à l’invagination de la plaque neurale en gouttière neurale, les territoires adjacents à celle-ci se retrouvent en position haute et ont donc été appelés crêtes neurales. Après la fermeture du tube neural, les cellules des crêtes neurales se séparent de la partie dorsale de celui-ci – on parle de « délamination » – et commencent à migrer (Fig. 2A).
(A) Embryologie des cellules des crêtes neurales (CCN). Les CCN (en vert) sont originaires des bordures de la plaque neurale (un épaississement du neurectoderme, en bleu), qui, lorsqu’elles se replient au cours de la neurulation, forment des « crêtes » entourant la gouttière neurale. Après l’invagination du neurectoderme, les cellules de la partie dorsale du tube neural se détachent (délamination) et commencent à migrer : ce sont les cellules des crêtes neurales.
(B) Les différents domaines de la crête neurale (CN) ainsi que leurs principaux dérivés.
Adapté de Simoes-Costa et coll., 2015 et de Knecht et coll., 2002
Les crêtes neurales se forment tout le long du tube neural, de la partie antérieure de l’embryon (future tête) jusqu’à la partie postérieure de celui-ci (future queue). Plusieurs domaines sont distingués en fonction de leur devenir : les crêtes neurales du crâne, du cœur (parfois rattachées aux premières), du tronc et le regroupement des crêtes neurales vagales (du cou) et sacrées (Fig. 2B). Ces domaines se chevauchent partiellement et des cellules provenant de la même région peuvent avoir des devenirs distincts (exemple des crêtes neurales cardiaques et vagales).
Les crêtes neurales forment des types cellulaires et des structures diverses
Les cellules des crêtes neurales ne sont présentes qu’à l’état embryonnaire, et se différencient (après migration) en de multiples types cellulaires au cours du développement (ces cellules sont dites « multipotentes »). Les dérivés de ces cellules diffèrent quelque peu selon la position de celles-ci dans l’embryon (Fig. 2B). Par exemple, les cellules de la région vagale et sacrée ont des potentialités assez restreintes et deviennent principalement les ganglions parasympathiques du tube digestif (importants pour le péristaltisme, c’est-à-dire les contractions musculaires synchronisées des viscères). Les cellules des crêtes neurales du tronc ont des devenirs plus variés, tandis que la palme est remportée par celles du crâne qui peuvent tout à la fois permettre la formation de différents tissus conjonctifs – tissus adipeux (adipocytes), cartilage (chondroblastes) et tissu osseux (ostéoblastes) – mais aussi de tissu musculaire (myocytes), de glandes sécrétrices (thyroïde, parathyroïde), de cellules nerveuses (neurones et cellules gliales) et de cellules pigmentaires (mélanocytes). On peut par ailleurs noter que ces dernières sont produites par toutes les régions de la crête neurale (crête neurale sacrée et vagale exceptées) [6].
Les cellules des crêtes neurales partagent donc une même origine développementale, des capacités migratoires et une multipotence élevée [7]. Elles sont donc caractérisées par une certaine « cohérence embryologique » qui les distinguent en cela des trois autres feuillets embryonnaires des Bilatériens : endoderme, mésoderme et ectoderme. Cela a conduit certains auteurs à les qualifier de « quatrième feuillet embryonnaire ».
Les feuillets embryonnaires
Les feuilles embryonnaires correspondent aux territoires cellulaires mis en place au cours de la gastrulation, au nombre de trois (ectoderme, mésoderme et endoderme) chez les animaux triploblastiques, de deux (ectoderme et endoderme) chez les animaux diploblastiques. Ils donneront naissance à l’ensemble des tissus et organes. Les cellules des crêtes neurales sont parfois considérées comme un quatrième feuillet.
Qui plus est, une théorie postule que l’acquisition des cellules des crêtes neurales et de leurs dérivés aurait permis le passage d’une physiologie de « filtreur benthique », caractéristique de l’ancêtre des Chordés (et que l’on retrouve encore actuellement chez les Céphalochordés et les Urochordés), à une physiologie « active », éventuellement prédatrice, chez l’ancêtre des Vertébrés :
- acquisition d’une vraie tête portant de nombreux organes sensoriels et, souvent, des mâchoires ;
- de cellules pigmentaires impliquées dans le camouflage et les relations inter et intraspécifiques ;
- d’une glande médullosurrénale libérant des hormones de stress permettant l’ajustement du métabolisme à un milieu changeant rapidement…
À la cohérence embryologique évoquée plus haut se doublerait donc une cohérence « fonctionnelle » des crêtes neurales, justifiant encore davantage de les reconnaître en tant que quatrième feuillet embryonnaire [8].
Certains auteurs refusent cependant cette dénomination dans la mesure où la mise en place des crêtes neurales se fait bien plus tardivement que celle des trois autres feuillets. « Quatrième feuillet » ou non, c’est une question de nomenclature qui ne doit pas éclipser le rôle primordial de ces cellules dans la physiologie et l’écologie des Vertébrés.
Induction, migration et différenciation des cellules des crêtes neurales
La spécification des cellules des crêtes neurales met en jeu différents signaux
Les crêtes neurales ne sont distinguables morphologiquement qu’à partir de la formation de la gouttière neurale. Auparavant, elles ne constituent qu’un territoire cellulaire qui ne peut être reconnu anatomiquement, à l’interface entre la plaque neurale et le futur épiderme. Quand la spécification de ce territoire cellulaire a-t-telle lieu ? Au moment de la neurulation et de la formation des crêtes neurales ou avant, dès le stade gastrula ?
Des expériences menées chez le poulet ont montré que des cellules de gastrula, explantées hors de l’embryon et cultivées seules, pouvait déjà se différencier en cellules pigmentaires produisant de la mélanine (mélanocytes) [9]. Cela signifie donc que la spécification des cellules des crêtes neurales a lieu avant même que la crête neurale ne soit distinguable dans l’embryon.
Spécification et détermination
Un territoire est dit spécifié si, lorsqu’on l’explante hors de l’embryon, il devient ce qu’il serait devenu en restant sur l’embryon : il conserve son devenir présomptif. Par contre, greffé ailleurs (hétérotopiquement) sur l’embryon, son devenir change et devient celui de sa nouvelle localisation.
Un territoire est dit déterminé s’il est spécifié et si, greffé sur un autre embryon (ou ailleurs sur le même), il conserve son devenir présomptif.
Ainsi, un territoire déterminé est spécifié, mais un territoire spécifié n’est pas pour autant déterminé.
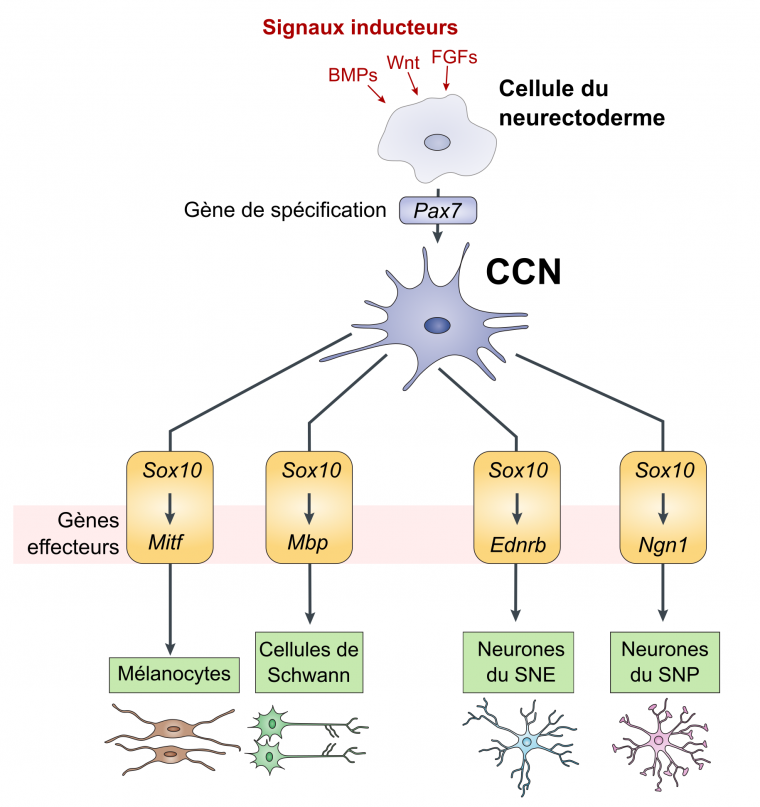
Les signaux moléculaires intervenant dans la spécification de la future crête neurale sont sécrétés par l’ectoderme dorsal ainsi que par certaines régions du mésoderme. Ce sont des protéines telles que les BMP (bone morphogenetic proteins), Wnt, et les FGF (fibroblast growth factors). Elles activent l’expression de gènes d’identité des crêtes neurales, tels que les facteurs de transcription Pax7 et Sox10 (Fig. 3).
D’après Basch et al., 2006, Sauka-Spengler et al., 2008 et Gilbert et al., 2014
La migration des cellules des crêtes neurales le long de l’axe dorso-ventral
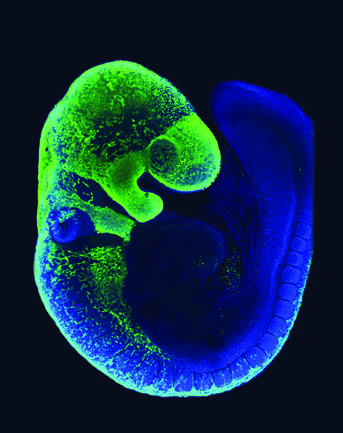
Les CCN ont été marquées par fluorescence verte (protéine fluorescente verte, ou GFP). On peut observer qu’elles forment une bande continue du côté dorsal, depuis laquelle émergent des files de cellules qui se déplacent ventralement. La tête est en particulier recouverte de CCN, soulignant le rôle essentiel que ces cellules jouent dans la formation de la tête des Vertébrés (os et cartilage, tissu conjonctif, ganglions crâniens…). Cette image a été fournie par Amanda Barlow et Paul Trainor, Stowers Institute for Medical Research
Toutes les cellules des crêtes neurales effectuent des migrations. Celles-ci peuvent être suivies en fusionnant un gène marqueur de ces cellules (par exemple, Pax7) avec un gène codant la GFP (green fluorescent protein, ou protéine fluorescente verte). Ainsi, les cellules exprimant Pax7 seront fluorescentes. Les résultats montrent que les cellules des crêtes neurales migrent depuis le côté dorsal (position du tube neural chez les Vertébrés) vers le côté ventral de l’organisme (Fig. 4).
Comment des cellules qui étaient situées dans la crête neurale, et donc intégrées au sein d’un tissu embryonnaire (le neurectoderme), acquièrent-elles des propriétés migratrices et se déplacent-elles jusqu’à leur position finale dans l’organisme ? Ce processus migratoire est constitué de plusieurs étapes : (1) le détachement du tissu initial (2) l’acquisition de capacités migratoires par la cellule (3) la réception de signaux indiquant vers où migrer (4) la migration per se et (5) la réception de signaux indiquant que la destination est atteinte et que la migration doit s’arrêter.
Toute perturbation d’une seule de ces étapes peut causer des défauts de migration et des maladies. Par exemple, le défaut de migration des cellules des crêtes neurales à l’origine des futurs ganglions nerveux du tube digestif peut provoquer un dysfonctionnement du péristaltisme du côlon et causer la maladie de Hirschprung, dont les principaux symptômes sont une mauvaise évacuation des selles et une constipation. Cette maladie est, chez certaines espèces, parfois associée à des défauts de pigmentation du pelage, indiquant que les mélanocytes (d’autres dérivés des cellules des crêtes neurales) sont également affectés.
Détachement du neurectoderme et acquisition des propriétés migratoires
Alors qu’elles sont encore intégrées dans la partie dorsale du tube neural, les cellules des crêtes neurales reçoivent des signaux inducteurs de ce dernier – signaux déjà à l’origine de la spécification de ces cellules – les BMP et Wnt. Ceux-ci activent des gènes cibles qui induisent une diminution de l’expression des cadhérines (des molécules d’adhérence en surface de la cellule) et la dissociation des cellules du tissu.
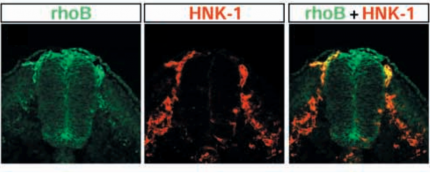
Les cellules des crêtes neurales en migration expriment la protéine de surface HNK-1 (au milieu, en rouge), alors que les CCN en préparation pour la migration, dans la partie dorsale du tube neural, expriment fortement rhoB (à gauche, en vert). Les cellules du tube neural, plus ventrales, ainsi que d’autres types cellulaires expriment également rhoB, mais faiblement. La fluorescence jaune (à droite) traduit la colocalisation des deux protéines. On constate que les cellules qui migrent vers le côté ventral de l’embryon perdent l’expression de rhoB. Cette protéine est nécessaire à la ré-organisation du cytosquelette en préparation à la migration des CCN.
Par ailleurs, Wnt active l’expression de petites protéines GTPases (qui hydrolysent le GTP) de la famille des Rho GTPases. Ces protéines permettent de réorganiser le cytosquelette d’actine, nécessaire à la future migration cellulaire (Fig. 5). Le signal qui déclenche la migration est quant à lui original : les cellules des crêtes neurales se repoussent en effet les unes les autres par inhibition de contact (« je t’aime » / « moi non plus »). Dès qu’elles se touchent, les deux partenaires repartent à l’opposé l’une de l’autre. Chaque cellule voulant éviter les autres, cela provoque une « fuite en avant » et un mouvement en masse de ce type cellulaire, en direction ventrale, depuis le tube neural.
La transition épithélio-mésenchymateuse
La perte d’adhérence entre les cellules d’un épithélium et l’acquisition par celles-ci de propriétés migratoires est un événement qualifié de transition épithélio-mésenchymateuse (TEM). Ce processus a lieu de manière normale au cours du développement, par exemple dans le cas des cellules des crêtes neurales ou lors de la gastrulation, mais peut également avoir lieu de manière anormale dans certains cancers dont les cellules prolifèrent et se mettent à migrer (métastases) [13]. L’étude de la TEM est donc un champ d’investigation actuellement très actif.
Les cellules des crêtes neurales empruntent différentes voies de migration
Les tissus que les cellules des crêtes neurales traversent sont formés de cellules possédant dans leur membrane des signaux moléculaires spécifiques (éphrines, sémaphorines) auxquels chaque CCN répond différemment. Selon son état de différenciation et les molécules de surface qu’elle-même porte, elle continue son chemin dans le tissu ou elle l’évite. La combinaison des facteurs tissulaires et propres aux CCN est donc à l’origine des voies de migration empruntées.
Les modalités de migration des cellules des crêtes neurales sont variables et diffèrent selon les espèces de Vertébrés, selon la temporalité de leur migration (plus ou moins précoce) et selon leur position le long de la crête neurale (plus ou moins antérieure). Toutefois, deux voies principales de migration sont classiquement distinguées : une voie ventrale (les CCN se dirigent d’abord ventralement, à l’opposé du tube neural), et une voie dorso-latérale (les CCN se dirigent le long du futur dos).
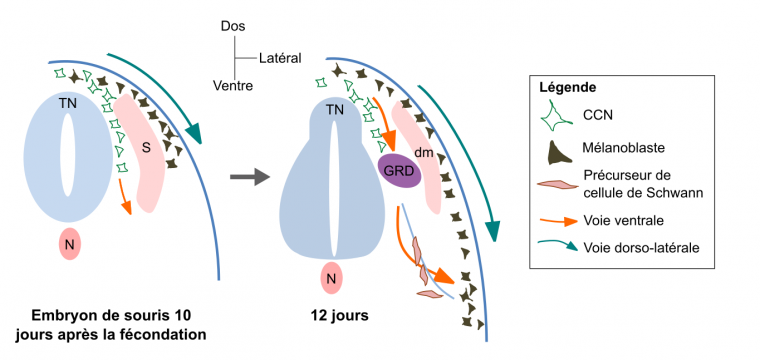
Il n’est pas possible de détailler ici toutes les voies empruntées par chacun des dérivés de CCN (elles sont trop nombreuses). Nous présentons donc ici les principales voies migratoires empruntées par les mélanoblastes (précurseurs des mélanocytes) au cours du développement chez la souris Mus musculus (Fig. 6). Une première voie dorso-latérale est empruntée, entre les somites et l’épiderme en développement. Plus tard au cours du développement, les mélanoblastes rejoignent l’épiderme chez les Mammifères. Les mélanocytes adultes ont toutefois chez la souris une deuxième origine : ils peuvent en effet être issus de la différenciation de cellules précurseures des cellules de Schwann, qui constituent chez les Vertébrés la gaine de myéline des prolongements des neurones du système nerveux périphérique [14]. Ces cellules précurseures empruntent quant à elles une voie de migration ventrale.
Les CCN précurseurs des mélanocytes empruntent soit une voie dorsolatérale directe, soit une voie ventrale indirecte. Dans ce second cas, les mélanocytes proviennent alors de la différenciation de précurseurs des cellules de Schwann qui migrent le long des nerfs (représentés par un trait bleu clair). S = somite ; dm = dermomyotome (partie des somites qui forme le derme et les muscles du dos et des membres) ; N = notochorde ; TN = tube neural ; GRD = ganglion de la racine dorsale. Adapté de Mort et al., 2015.
La différenciation des cellules des crêtes neurales en de multiples types cellulaires
Après leur migration, des combinaisons spécifiques de facteurs de transcription restreignent peu à peu le destin des cellules des crêtes neurales en activant l’expression de gènes effecteurs. Par exemple, les cellules exprimant le facteur de transcription Mitf (produit du gène microphtalmia), en plus de Sox10, deviendront des mélanocytes. Les cellules exprimant la neurogénine 1, un autre facteur de transcription, deviendront quant à elles des neurones sensoriels du système nerveux périphérique [10] (Fig . 3). C’est une combinaison de facteurs de transcription qui peu à peu permet une restriction des destins cellulaires jusqu’à un type cellulaire différencié.
Cependant, les potentialités d’un précurseur sont-elles intrinsèques à celui-ci (détermination autonome), déterminées par l’environnement cellulaire ou influencées par ces deux facteurs ?
Des expériences de transplantation ont montré que quand des cellules des crêtes neurales du tronc (ne donnant normalement pas de cartilage) sont transplantées au niveau de la crête neurale du crâne, elles migrent et atteignent les sites de formation de cartilage mais ne se différencient jamais en cartilage. Cependant, elles peuvent former des mélanocytes, des neurones ou de la glie. Ainsi, les cellules des crêtes neurales du tronc semblent être privées d’un potentiel de formation de cartilage (le tissu osseux est également concerné). Cela est lié à leur position initiale dans l’embryon : plus postérieures, l’expression des gènes Hox y est différente, et leurs capacités de formation de tissu cartilagineux et osseux est perdue. D’ailleurs, si des explants de CCN du tronc sont cultivés en présence de facteurs qui leur font perdre l’expression de Hoxd10 (qu’elles expriment normalement), ces cellules se différencient sur le long terme, en deux semaines, en chondroblastes – les cellules à l’origine du cartilage [16].
Les cellules de la crête neurale du crâne peuvent quant à elles donner du cartilage en plus de tous les autres dérivés issus de la crête neurale du tronc. Toutefois, transplantées au niveau du tronc, elles se différencient dans tous les types cellulaires de cette région de l’embryon mais pas en cellules osseuses ni cartilagineuses : elles manquent donc des signaux qui induiraient leur différenciation en ces types cellulaires, et leur détermination est donc partiellement environnementale.
L’origine évolutive des cellules des crêtes neurales éclaire l’évolution des Vertébrés
Les dérivés de CCN sont, on l’a vu, partout ! Il semble qu’il n’y ait pas un endroit du corps où, en cherchant à quelques cellules alentour, on ne tombe sur un dérivé de CCN… Mais comment les organismes faisaient-ils « avant » la crête neurale ? En d’autres termes, si ce type cellulaire semble être une innovation majeure apparue à la base des Vertébrés, existe-t-il des cellules leur ressemblant ailleurs chez les Chordés ? Chez les Bilatériens (Fig. 1) ? Quels sont les événements ayant pu provoquer l’apparition d’un nouveau type cellulaire ? Et enfin, existe-t-il des variations de ce « quatrième feuillet embryonnaire » caractéristique des Vertébrés ?
Des cellules ayant des caractères de cellules des crêtes neurales chez des Chordés autres que les Vertébrés
Les CCN sont une innovation évolutive des Vertébrés et la question de leur origine évolutive interpelle. Sont-elles un nouveau type cellulaire apparu ex nihilo ? À l’inverse, trouve-t-on des cellules qui partagent quelques caractéristiques de CCN chez les autres Chordés ? Enfin, si les dérivés de CCN sont parfois des types cellulaires nouveaux (par exemple, les odontoblastes produisant la dentine), ils ressemblent souvent à des types cellulaires déjà existants (adipocytes, chondroblastes, fibroblastes, neurones, myocytes…). Il serait donc possible d’imaginer que ces types cellulaires aient pu se retrouver à l’emplacement de la crête neurale et aient acquis des propriétés migratrices. Auquel cas la crête neurale ne serait pas vraiment une « innovation évolutive » mais plutôt le rassemblement d’une mosaïque d’éléments déjà présents. L’étude des cellules des autres Chordés, dont les Urochordés, permet d’éclairer ces questions.
Les autres Chordés partagent un plan d’organisation similaire : un système nerveux central en position dorsale ; une notochorde ; un tronc segmenté. Cependant, jusqu’à ces dernières années, aucune lignée cellulaire équivalente aux CCN n’avait été trouvée chez ces organismes.
En 2012, une étude a montré que chez l’Urochordé Ciona intestinalis certaines cellules pigmentées mélaniques trouvent leur origine au bord de la plaque neurale et migrent ensuite… mais très peu, sur une distance de l’ordre de quelques cellules seulement ! L’expression artificielle d’un seul gène, twist, peut cependant induire une migration plus importante de ces cellules [17].
En 2015, une deuxième étude a montré, toujours chez C. intestinalis, qu’il existait un type de neurones sensoriels, appelés neurones bipolaires à queue (bipolar tail neuron, ou BTN, en anglais), qui (1) proviennent de cellules de la bordure de la plaque neurale, (2) migrent, (3) se différencient en neurones sensoriels entre des cellules sensorielles épidermiques et des moto-neurones [18]. On s’approche ici de la définition de cellule de crête neurale !
Les auteurs proposent donc que l’ancêtre commun aux Urochordés et aux Vertébrés avait déjà une plaque neurale dont les bords produisaient des cellules pigmentaires (cf. étude de 2012) ainsi que des cellules ayant déjà des potentialités migratrices (cf. étude de 2015). Les auteurs concluent que la crête neurale a évolué par l’acquisition d’un progéniteur multipotent « en amont » de progéniteurs multiples qui étaient déjà présents dans la plaque neurale mais qui avaient des devenirs plus restreints (Fig. 7).
1. Acquisition de cellules possédant quelques caractères de cellules des crêtes neurales (ces cellules proviennent de la bordure de la plaque neurale, migrent mais ne se différencient qu’en quelques types cellulaires). 2. 1R : première duplication du génome. 3. 2R : seconde duplication du génome. 4. Acquisition de cellules des crêtes neurales au sens strict : ces cellules donnent des dérivés beaucoup plus nombreux que ceux retrouvés chez les Urochordés.
Les recherches n’ont pour l’instant pas montré l’existence de cellules des crêtes neurales chez les autres Deutérostomiens (Céphalochordés y compris) : de nombreux types cellulaires ayant des similitudes partielles ont été discutés au sein de la communauté scientifique, et peut-être que les années à venir éclaireront ce point sous un jour nouveau.
L’étude de l’origine des CCN est un champ de recherche actuellement très actif ; ainsi, aujourd’hui, on ne cherche plus uniquement les cellules qui, chez les « invertébrés » (Bilatériens non-Vertébrés), pourraient ressembler aux CCN, mais des gènes, ou plutôt des réseaux de régulation génique (gene regulatory network = GRN) impliqués dans la différenciation de ce type cellulaire (un réseau de régulation génique est un ensemble de régulateurs moléculaires qui interagissent entre eux et avec d’autres molécules pour contrôler l’expression de gènes). Il a ainsi été récemment démontré que les cellules de la bordure de la plaque neurale expriment presque les mêmes gènes chez tous les Bilatériens, qu’ils soient Protostomiens ou Deutérostomiens. Les mécanismes moléculaires nécessaires à la spécification de la bordure de la plaque neurale en neurones périphériques étaient donc déjà probablement présents chez l’ancêtre des Bilatériens (« Urbilateria ») [19]. De plus, dans l’ensemble, les gènes de spécification des CCN en d’autres types cellulaires sont présents chez tous les Bilatériens.
En conclusion, il est vraisemblable que les CCN soient issues de la cooptation de divers programmes génétiques de différenciation (en neurones, mélanocytes, cellules gliales…) par des cellules aux potentialités migratrices. Ces programmes de différenciation auraient été rajoutés, tels des « plug-ins », à un programme de spécification de progéniteur de crête neurale [20].
La cooptation
La cooptation correspond à l'acquisition par un gène ou un réseau de gène de nouvelles fonctions, différentes de leurs fonctions ancestrales. Par exemple, si les gènes Hox sont utilisés dans la spécification de l’axe antéro-postérieur chez les Bilatériens, ils ont été « réutilisés » pour la détermination de la polarité proximo-distale des membres des Tétrapodes.
Les événements évolutifs ayant permis la formation de cellules des crêtes neurales
La formation d’un nouveau type cellulaire nécessite des modifications majeures des réseaux de régulation génique : des groupes entiers de gènes (modules), encodant une fonction donnée (par exemple, la différenciation en neurone), doivent être mis en lien avec des modules de migration cellulaire et des modules de multipotence, pour qu’une seule cellule puisse assurer toutes ces fonctions. Si on assimile un module fonctionnel à une « boîte », cela nécessite donc de ré-agencer et connecter des boîtes originellement indépendantes (et mises en œuvre dans des types cellulaires différents), en un ensemble de boîtes cohérent dans une seule cellule… Pas si simple !
L’origine de tels remaniements des réseaux de régulation génique fait toujours débat, mais la double duplication de génome à la base des Vertébrés est un événement majeur ayant pu conduire à de tels changements.
En effet, après la séparation des lignées Urochordés / Vertébrés, une double duplication de génome a eu lieu au sein de la lignée des Vertébrés. Cette double duplication de génome (appelée 1R/2R, pour « premier round puis second round de duplication »), encore imparfaitement comprise, a eu pour conséquence de multiplier par deux, puis encore par deux (donc par quatre) l’ensemble des gènes de notre ancêtre. Aujourd’hui, 500 millions d’années plus tard, nombre de ces gènes ont été perdus, mais il reste dans notre génome des gènes paralogues (deux gènes sont dits paralogues s’ils sont issus de la duplication d’un gène ancestral) issus de ces deux duplications. Par exemple, la portion de chromosome contenant les gènes homéotiques est présente en une seule copie chez les Ciones (Ciona sp., Urochordés), contre 4 chez les Vertébrés.
Les Vertébrés et les duplications de génome
Au cours de l’évolution des Vertébrés, il n’y a pas eu que deux événements de duplication de génome. Par exemple, au sein des tétrapodes, chez les Amphibiens, la lignée des xénopes a elle aussi été marquée par une duplication de génome (lire à ce propos L’histoire évolutive du xénope révélée par son génome). De même, à la base des poissons Téléostéens, une duplication de génome a eu lieu il y a environ 350 Ma, et au sein même de ce groupe, il y a encore eu des événements de duplication de génome, par exemple chez les Salmonidés (saumons, truites…) il y a 100 Ma [21]. Ainsi, les duplications de génomes n’ont pas eu lieu uniquement à la base des Vertébrés mais ont concerné de nombreux taxons au cours de l’évolution.
Le lien entre ces duplications et les réseaux de régulation génique n’est pas clair, mais un mécanisme proposé serait que le quadruplement de l’ensemble des gènes d’un organisme ait pu permettre la modification en profondeur des interactions entre les gènes des différents modules, voire même mettre des modules sous contrôle d’autres modules. En somme, l’ensemble des gènes issus d’une duplication de génome serait un « substrat » à partir duquel la variation serait possible : l’une des copies d’un gène serait libre de varier, tandis que l’autre copie pourrait garder la fonction ancestrale du gène (ou également varier) [22]. Cela est non seulement vrai pour les séquences codantes mais également pour les séquences régulatrices.
Un scénario possible à l’origine des cellules des crêtes neurales serait donc que des copies de gènes originellement indépendants (dans des modules différents) passent sous le contrôle de séquences régulatrices similaires et deviennent ainsi co-régulés (Fig . 8).
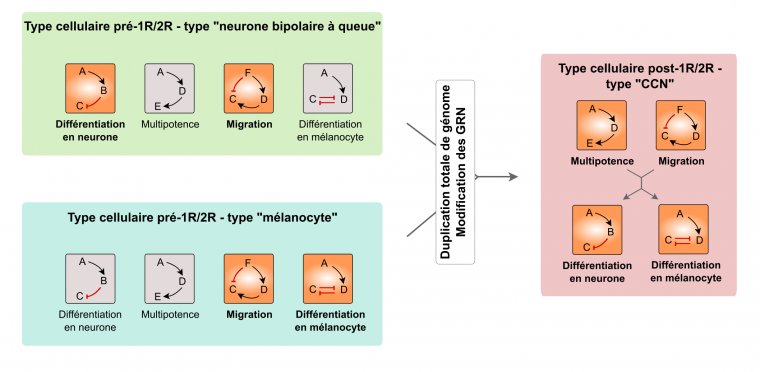
Des types cellulaires ancestraux (deux sont représentés, en vert et en bleu) avaient chacun des potentialités différentes en fonction des modules de gènes exprimés (représentés en orange ; les modules inactifs sont en gris). Chaque module est constitué de plusieurs gènes, représentés par des lettres, qui sont impliqués dans la même fonction cellulaire, avec des interactions propres entre les gènes d’un même module : activation (flèche noire) ou inhibition (flèche rouge). On note qu’un gène peut être impliqué dans plusieurs voies et donc être présent dans plusieurs modules (par exemple, le gène A). Les modules activés diffèrent selon le type cellulaire. Par exemple, les cellules précurseures des neurones bipolaires à queue ont deux modules activés : « migration » et « différenciation en neurone ». Lors du double événement de duplication de génome à la base des Vertébrés (1R/2R), les relations entre les modules ont pu être modifiées et certains modules ont été activés ou se sont retrouvés sous le contrôle d’autres modules. Par exemple, le module « multipotence » a été activé et les modules de différenciation ont été mis sous le contrôle des modules « multipotence » et « migration ». C’est une explication possible (certes théorique et difficile à tester) pour l’apparition d’un nouveau type cellulaire. CCN : cellules des crêtes neurales.
L’évolution des cellules des crêtes neurales au sein des Vertébrés
La crête neurale des Vertébrés, si elle est une de leur spécificité, n’est pas pour autant une entité immuable au sein de ce groupe. Les types cellulaires produits par les crêtes neurales des différents taxons de Vertébrés ne sont pas toujours les mêmes. Par exemple, chez les poissons téléostéens, il existe de multiples types de cellules pigmentaires, en plus des mélanocytes : des cellules iridescentes (iridophores), rouge-orange (érythrophores et xanthophores) et des cellules blanches (leucophores). Ces cellules dérivent toutes d’un même précurseur mais accumulent des pigments différents [23] (Fig. 9).
Les cellules des crêtes neurales sont à l’origine des cellules pigmentaires. Alors que les Mammifères n’en ont qu’un seul type (les mélanocytes), les poissons téléostéens peuvent en compter plusieurs. Par exemple, chez certaines larves de poissons coralliens (ici une espèce indéterminée de Gobiidae), on peut observer quatre types de cellules pigmentaires : des mélanocytes noirs, à l’instar des Mammifères, mais également des xanthophores (jaune-orange), des érythrophores (rouges) et des iridophores (argentés). La larve mesure environ 2 cm de longueur totale (1 cm visible sur le cliché) ; barres d’échelles des encarts : 50 µm.
Assemblage par Thibault Lorin à partir des sources suivantes :
- Photographie de larve de Gobiidae : Germain Boussarie ; licence CC-BY-NC.
- Encadré « iridophores » : Frohnhöfer et al. 2013, Development ; reproduction autorisée dans un contexte éducatif et non commercial.
- Encadré « M/X » : Cortesy et al., 2016, Journal of Experimental Biology ; reproduction autorisée dans un contexte éducatif et non commercial.
- Encadré « érythrophore » : Yang et al., 2016, SpringerPlus ; licence CC-BY.
En particulier, on l’a vu, la crête neurale du tronc a un devenir plus restreint que la crête neurale du crâne et n’est pas capable de produire de l’os et du cartilage… ou plutôt, elle ne le seraitplus. Certains auteurs (et c’est là encore discuté) affirment ainsi que les CCN du tronc ont perdu leur capacité à produire des tissus durs chez la majorité des Vertébrés, et que les plaques dermiques de certains Vertébrés fossiles, comme les « ostracodermes » (groupe non-monophylétique) et les placodermes, auraient pu provenir des crêtes neurales thoraciques [24]. L’avantage évolutif d’une telle perte, s’il y en a un, n’est pas documenté. Des travaux récents sur les Chondrichthyens (« poissons cartilagineux ») montrent que la dentine des denticules dermiques (petites dents sur le corps des requins et des raies) provient d’odontoblastes issus de cellules des crêtes neurales du tronc [24]. Ainsi, ces cellules paraissent avoir conservé une fonction ancestrale de production de dentine uniquement chez les requins et raies.
Enfin, chez les lamproies (des Cyclostomes), les ganglions digestifs semblent être issus des cellules des crêtes neurales du tronc et non des vagales et sacrées comme chez les Gnathostomes [25]. Les auteurs suggèrent que les CCN vagales ont acquis cette fonction à la base des Gnathostomes, montrant là encore une différence entre CCN des différentes lignées de Vertébrés.
Conclusion
L’étude des cellules des crêtes neurales et de leurs dérivés est donc à l’interface entre la biologie cellulaire et du développement, l’évolution et l’écologie, et s’avère assez fascinante. Ces cellules, par leurs potentialités migratrices et les multiples dérivés qu’elles génèrent (multipotence), ont pu contribuer à l’acquisition de structures développementales propres aux Vertébrés : crâne, mâchoire, glandes hormonales (surrénales), structures sensorielles (oreille interne)… Celles-ci ont alors permis à ces organismes d’exploiter de nouvelles niches écologiques. Des variations de ces structures ont permis l’adaptation des populations aux caractéristiques (physico-chimiques et biologiques) de leur milieu, fournissant en cela le substrat permettant la diversification et, à terme, la spéciation au sein du clade des Vertébrés. C’est à ce titre que certains auteurs ont qualifié les cellules des crêtes neurales de « seule chose intéressante chez les Vertébrés » (the only interesting thing about vertebrates) (Thorogood, 1989), et qu’on parle parfois aujourd’hui pour désigner ce territoire cellulaire de « quatrième feuillet embryonnaire ».
L’évolution des cellules des crêtes neurales est complexe et semble être due à des changements de réseaux de régulation génique provoqués par les événements de duplication de génome survenus à la base des Vertébrés. Ces événements ont pu induire l’acquisition, par un seul type cellulaire, de modules fonctionnels qui étaient ancestralement présents dans des types cellulaires différents. L’évolution des cellules des crêtes neurales est toutefois toujours en cours, et celles-ci ne possèdent pas les mêmes spécificités au sein des grandes lignées de Vertébrés.
On ne saurait toutefois résumer le succès évolutif des Vertébrés à ce seul groupe de cellules [26]. En particulier, les placodes ectodermiques crâniennes constituent un autre type cellulaire dont dérivent certaines structures sensorielles de la tête (nerfs olfactifs, oreille interne, bourgeons du goût, cristallin). Ces structures, embryologiquement proches des cellules des crêtes neurales (également issues de la bordure de la plaque neurale, mais, elles, ectodermiques, et non pas neurectodermiques), ont probablement elles aussi joué un rôle dans la diversification de notre lignée et dans l’adaptation aux multiples niches écologiques.
Lexique
Taxon : groupe d’espèces qui partage un ancêtre commun exclusif (monophylétique). Un taxon peut contenir de nombreuses espèces (le taxon des Bilatériens contient plusieurs millions d’espèces) ou restreint (le taxon des Hominidés ne contient que six espèces).
Poisson : le terme « poisson » regroupe tous les animaux à nageoires capables de se déplacer activement dans l’eau. Ce terme ne désigne pas un groupe monophylétique mais plutôt une réalité écologique. Les Téléostéens, en revanche, constituent un taxon exclusivement représenté par des poissons et représentent la moitié des espèces de Vertébrés.
Gènes homéotiques : les gènes homéotiques (ou gènes Hox) sont des gènes impliqués dans le développement et l’agencement relatif des grandes structures de l’organisme/
Facteur de transcription : Une protéine possédant un domaine de fixation à l’ADN et influant sur la transcription d’au moins un gène cible.
Références
- Janvier P. Comparative Anatomy: All Vertebrates Do Have Vertebrae. Curr. Biol. [Internet]. 2011;21:R661–3. Available from: http://linkinghub.elsevier.com/retrieve/pii/S0960982211007834
- Cannon JT, Vellutini BC, Smith J, Ronquist F, Jondelius U, Hejnol A. Xenacoelomorpha is the sister group to Nephrozoa. Nature [Internet]. 2016;530:89–93. Available from: http://www.nature.com/articles/nature16520
- Janvier P. Facts and fancies about early fossil chordates and vertebrates. Nature [Internet]. 2015;520:483–9. Available from: http://www.nature.com/articles/nature14437
- Simoes-Costa M, Bronner ME. Establishing neural crest identity: a gene regulatory recipe. Development [Internet]. 2015;142:242–57. Available from: http://dev.biologists.org/cgi/doi/10.1242/dev.105445
- Knecht AK, Bronner-Fraser M. Induction of the neural crest: a multigene process. Nat. Rev. Genet. [Internet]. 2002;3:453–61. Available from: http://www.nature.com/articles/nrg819
- Cichorek M, Wachulska M, Stasiewicz A, Tymińska A. Skin melanocytes: biology and development. Adv. Dermatology Allergol. [Internet]. 2013;1:30–41. Available from: http://www.termedia.pl/doi/10.5114/pdia.2013.33376
- Hall BK, Gillis JA. Incremental evolution of the neural crest, neural crest cells and neural crest-derived skeletal tissues. J. Anat. [Internet]. 2013;222:19–31. Available from: http://doi.wiley.com/10.1111/j.1469-7580.2012.01495.x
- Gans C, Northcutt RG. Neural Crest and the Origin of Vertebrates: A New Head. Science (80-. ). [Internet]. 1983;220:268–73. Available from: http://www.sciencemag.org/cgi/doi/10.1126/science.220.4594.268
- Basch ML, Bronner-Fraser M, García-Castro MI. Specification of the neural crest occurs during gastrulation and requires Pax7. Nature [Internet]. 2006;441:218–22. Available from: http://www.nature.com/doifinder/10.1038/nature04684
- Sauka-Spengler T, Bronner-Fraser M. A gene regulatory network orchestrates neural crest formation. Nat. Rev. Mol. Cell Biol. [Internet]. 2008;9:557–68. Available from: http://www.nature.com/doifinder/10.1038/nrm2428
- Gilbert SF. Developmental biology. Sunderland, editor. Sinauer; 2014.
- Liu JP, Jessell TM. A role for rhoB in the delamination of neural crest cells from the dorsal neural tube. Development [Internet]. 1998;125:5055–67. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9811589
- Brabletz T, Kalluri R, Nieto MA, Weinberg RA. EMT in cancer. Nat. Rev. Cancer [Internet]. 2018;18:128–34. Available from: http://www.nature.com/doifinder/10.1038/nrc.2017.118
- Jessen KR, Mirsky R, Lloyd AC. Schwann Cells: Development and Role in Nerve Repair. Cold Spring Harb. Perspect. Biol. [Internet]. 2015;7:a020487. Available from: http://cshperspectives.cshlp.org/lookup/doi/10.1101/cshperspect.a020487
- Mort RL, Jackson IJ, Patton EE. The melanocyte lineage in development and disease. Development [Internet]. 2015;142:620–32. Available from: http://dev.biologists.org/cgi/doi/10.1242/dev.106567
- Abzhanov A, Tzahor E, Lassar AB, Tabin CJ. Dissimilar regulation of cell differentiation in mesencephalic (cranial) and sacral (trunk) neural crest cells in vitro. Development [Internet]. 2003;130:4567–79. Available from: http://dev.biologists.org/lookup/doi/10.1242/dev.00673
- Abitua PB, Wagner E, Navarrete IA, Levine M. Identification of a rudimentary neural crest in a non-vertebrate chordate. Nature [Internet]. 2012;492:104–7. Available from: http://www.nature.com/articles/nature11589
- Stolfi A, Ryan K, Meinertzhagen IA, Christiaen L. Migratory neuronal progenitors arise from the neural plate borders in tunicates. Nature [Internet]. 2015;527:371–4. Available from: http://www.nature.com/doifinder/10.1038/nature15758
- Li Y, Zhao D, Horie T, Chen G, Bao H, Chen S, et al. Conserved gene regulatory module specifies lateral neural borders across bilaterians. Proc. Natl. Acad. Sci. [Internet]. 2017;114:E6352–60. Available from: http://www.pnas.org/lookup/doi/10.1073/pnas.1704194114
- Green SA, Simoes-Costa M, Bronner ME. Evolution of vertebrates as viewed from the crest. Nature [Internet]. 2015;520:474–82. Available from: http://www.nature.com/doifinder/10.1038/nature14436
- Berthelot C, Brunet F, Chalopin D, Juanchich A, Bernard M, Noël B, et al. The rainbow trout genome provides novel insights into evolution after whole-genome duplication in vertebrates. Nat. Commun. [Internet]. 2014;5. Available from: http://www.nature.com/doifinder/10.1038/ncomms4657
- Kassahn KS, Dang VT, Wilkins SJ, Perkins AC, Ragan MA. Evolution of gene function and regulatory control after whole-genome duplication: Comparative analyses in vertebrates. Genome Res. [Internet]. 2009;19:1404–18. Available from: http://genome.cshlp.org/cgi/doi/10.1101/gr.086827.108
- Kimura T, Nagao Y, Hashimoto H, Yamamoto-Shiraishi Y -i., Yamamoto S, Yabe T, et al. Leucophores are similar to xanthophores in their specification and differentiation processes in medaka. Proc. Natl. Acad. Sci. [Internet]. 2014;111:7343–8. Available from: http://www.pnas.org/cgi/doi/10.1073/pnas.1311254111
- Gillis JA, Alsema EC, Criswell KE. Trunk neural crest origin of dermal denticles in a cartilaginous fish. Proc. Natl. Acad. Sci. [Internet]. 2017;114:13200–5. Available from: http://www.pnas.org/lookup/doi/10.1073/pnas.1713827114
- Green SA, Uy BR, Bronner ME. Ancient evolutionary origin of vertebrate enteric neurons from trunk-derived neural crest. Nature [Internet]. 2017;544:88–91. Available from: http://www.nature.com/doifinder/10.1038/nature21679
- Shimeld SM, Holland PWH. Vertebrate innovations. Proc. Natl. Acad. Sci. [Internet]. 2000;97:4449–52. Available from: http://www.pnas.org/cgi/doi/10.1073/pnas.97.9.4449