La chromatographie est une technique permettant de séparer plusieurs constituants d'un mélange en les faisant migrer, sur une phase immobile, par une phase liquide ou gazeuse. Cet article présente les principaux types de chromatographie, avec leur principe de séparation et leurs principales indications. Il propose, en dernière partie, une comparaison de ces différentes techniques.
Présentation de la technique
La chromatographie est une technique séparative analytique et/ou préparative. Elle consiste à faire migrer les constituants à séparer sur une phase stationnaire immobile, à l’aide d’une phase mobile, liquide ou gazeuse, de nature différente. Chaque molécule sera plus ou moins rapidement entraînée selon son affinité pour, respectivement, la phase stationnaire et la phase mobile, permettant la séparation des différents constituants présents.
À partir de ce principe très général, il existe de très nombreux types de chromatographie en fonction de la nature de la phase stationnaire, de la nature de la phase mobile, et de la nature des interactions entre ces phases et les molécules à purifier. En effet, selon les cas, les facteurs physico-chimiques qui interviennent comme critère de séparation sont totalement différents : ce peut être la masse moléculaire, la charge, l’hydrophilie/hydrophobicité, la structure tridimensionnelle, etc. Évidemment, le choix est effectué au cas par cas en fonction des besoins. Il n’est d’ailleurs pas rare d’utiliser successivement plusieurs types de chromatographies différentes au cours d’une même purification.
Cet article présente les principaux types de chromatographie, leur principe séparatif, les conditions générales de mise en œuvre, et les principales indications d’utilisation.
La chromatographie d’exclusion
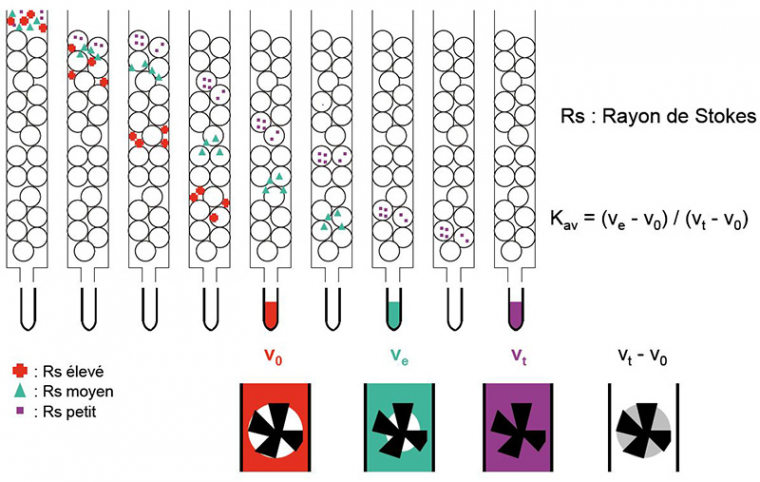
Ce type de chromatographie, également appelé tamisage moléculaire ou gel-filtration, vise à séparer les molécules en fonction de leur masse moléculaire, bien que la forme intervienne également.
La séparation des constituants va se faire selon leur rayon de Stokes ou rayon hydrodynamique, noté $R_{s}$. Ce rayon peut être calculé selon la relation suivante :
$$R_{s} = \frac{k_{B}T}{6πηD}$$ avec
- $k_{B}$ : constante de Boltzmann
- $T$ : température en Kelvin
- $η$ : viscosité du milieu (ici du tampon)
- $D$ : coefficient de diffusion
Le principe consiste à faire migrer l’échantillon à analyser au milieu de billes poreuses. Les molécules suffisamment petites pour passer par les pores des billes seront ralenties dans leur progression, alors que les molécules trop grosses pour entrer dans les billes progresseront plus rapidement en passant entre les billes (voir figure 1).
Rs correspond au rayon de Stokes (ou rayon hydrodynamique). On constate qu'un Rs élevé ne permet l'accès qu'au volume correspondant aux espaces séparant les billes (couleur rouge). Plus le Rs est faible, plus les molécules ont accès aux espaces situés à l'intérieur des billes (couleurs verte et violette), donc plus la progression dans la colonne est lente.
Dans ce type de chromatographie, la phase stationnaire est donc solide (les billes) et la phase mobile est liquide (un tampon dont le flux entraîne les molécules). Selon la taille des pores des billes, on peut séparer efficacement des molécules dont la masse moléculaire est comprise dans une fourchette différente. La figure 2 donne quelques exemples classiques de résines commerciales.
| Type de résine | Fractionnement efficace (Da) |
| Sephadex G15 | 0 - 1 500 |
| Sephadex G50 | 1 500 - 30 000 |
| Séphadex G200 | 5 000 - 800 000 |
| Biogel P-2 | 100 - 1800 |
| Biogel P-10 | 1 500 - 20 000 |
| Biogel P-100 | 5 000 - 100 000 |
| Biogel P-300 | 60 000 - 400 000 |
| Sepharose 6B | < 4.106 |
| Sepharose 2B | 2.106 - 40.106 |
| Selon la nature chimique de la résine et sa réticulation (qui déterminent la taille des pores) on dispose de la capacité à séparer des molécules extrêmement différentes en terme de masse moléculaire. Il faut donc choisir une résine adaptée à la molécule à purifier, ce qui est déterminé au cours de la mise au point de la méthode de purification. Nature chimique des différentes résines citées : Séphadex G : Dextran réticulé (épichlorohydrine) Biogel P : Acrylamide/bisacrylamide Sépharose : Agarose |
|
C’est une technique très simple à mettre en œuvre, peu onéreuse, qui est très peu destructrice pour les constituants à séparer, mais dont la résolution (capacité à séparer des molécules dont les caractéristiques sont proches) est modeste.
La chromatographie échangeuse d’ions
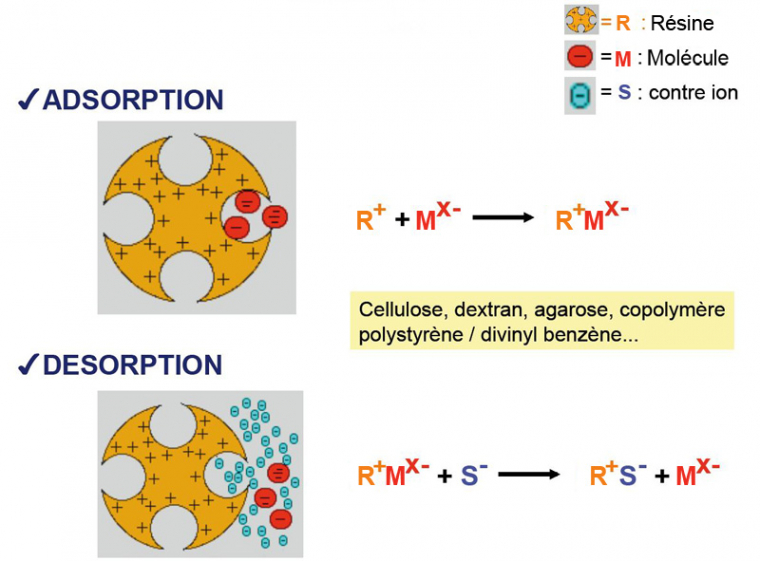
Dans la chromatographie échangeuse d’ions, le paramètre qui va permettre la séparation des différents constituants est la charge nette. Pour cela, on utilise des résines chargées positivement (chromatographie échangeuse d’anions) ou négativement (chromatographie échangeuse de cations).
Les principaux groupements utilisés pour fabriquer des résines chargées sont :
| Résines échangeuses d'anions (chargées positivement) |
|
| Faible (Pka ≈ 10 d'où pH ≤ 9) |
Fort (Pka élevé) |
Diéthylaminoéthyl (DEAE)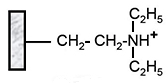 |
Diéthyl(2 hydroxypropyl)aminoéthyl (QAE)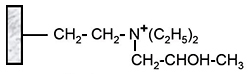 |
| Résines échangeuses de cations (chargées négativement) |
|
| Faible (Pka ≈ 4 d'où pH ≥ 5) |
Fort (Pka ≈ 2) |
Carboxyméthyl (CM)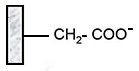 |
Sulphopropyl (SP)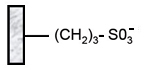 |
Si on prend l’exemple de la chromatographie échangeuse d’anions, la résine étant chargée positivement, seules les molécules chargées négativement vont se fixer sur celle-ci. Les molécules neutres ou chargées positivement ne vont pas s’accrocher et vont donc être éluées immédiatement (c’est le « non-fixé »). Il convient bien entendu que la résine soit la plus neutre possible pour éviter tout autre type d’interaction avec les molécules (hormis les interactions électrostatiques). Il peut s’agir de cellulose, de dextran, d’agarose, de copolymères polystyrène/divinyl benzène, etc.
L’élution des molécules fixées peut alors être réalisée de différentes manières. On peut utiliser un tampon d’élution contenant des ions négatifs qui vont entrer en compétition avec les molécules fixées pour les charges positives portées par la résine. On peut, soit utiliser directement un tampon contenant une forte concentration en ions (pour éluer toutes les molécules d’un coup), ou, au contraire, augmenter progressivement la concentration ionique (on parle de gradient) ce qui permet de décrocher successivement les différentes molécules en fonction de la force de leurs interactions électrostatiques. Pratiquement dans ce dernier cas de figure, on utilise deux solutions tampon, l’une de faible concentration ionique et l’autre de forte concentration ionique. Deux pompes pilotées aspirent et mélangent ces deux solutions selon un rapport qui varie avec le temps (la proportion de solution de forte concentration ionique augmentant progressivement). Le produit de ce mélange est utilisé dans la colonne.
Un autre moyen consiste à modifier la charge de la ou des molécules fixées. L’un des moyens classiques pour obtenir un tel effet est de modifier le pH. En effet, de nombreux groupes ionisables sont sensibles au pH. En baissant le pH, on favorise l’ionisation des groupements basiques (chargés positivement) et on défavorise l’ionisation des groupements acides (chargés négativement). En baissant le pH, on favorise donc l’apparition d’une charge nette positive pour les molécules portant des groupes ionisables sensibles au pH. La transition entre une charge nette négative et une charge nette positive se fait à la valeur du pHi. Encore une fois, on peut choisir d’appliquer directement un tampon au pH très bas, ou d’utiliser un gradient de pH. Dans les deux cas, chaque espèce moléculaire se détache de la résine lorsque le pH de la solution devient égal ou inférieur au pHi de la molécule. Pratiquement, pour appliquer un gradient de pH, on procède de la même manière que pour appliquer un gradient de concentration ionique (mélange variables de deux solutions, l’une basique et l’autre acide).
Bien entendu le principe est exactement le même pour la chromatographie échangeuse de cations, à ceci près que les espèces moléculaires retenues étant celles qui sont positives, il faut augmenter le pH pour les décrocher.
La chromatographie de partage
Principe
Dans la chromatographie de partage, le principe de la séparation provient d’un paramètre appelé coefficient de partage. Une molécule a généralement une affinité différente selon les milieux. On pense en particulier à une molécule polaire qui a une affinité supérieure pour des milieux polaires, et une molécule apolaire qui a une affinité supérieure pour les milieux apolaires. Si ces milieux ne sont pas miscibles entre eux (exemple d’un liquide polaire comme l’eau et d’un liquide apolaire comme de l’huile), la molécule va se répartir entre ces deux milieux au prorata de son affinité respective pour chacun d’entre eux. On peut alors définir un coefficient de partage entre ces deux milieux. Ce coefficient est une constante tant que l’on reste dans les mêmes conditions (température, pression, etc.).
Dès lors, si on fait progresser un mélange de molécules avec comme phase stationnaire l’un des deux milieux et comme phase mobile l’autre milieu, chaque espèce moléculaire va se partager entre ces deux phases selon son coefficient de partage. Plus les molécules se partagent dans la phase mobile, plus elles progresseront rapidement, et moins il leur faudra de temps pour sortir de la colonne. On peut ainsi calculer les temps relatifs mis par les différentes molécules pour sortir de la colonne dans des conditions données (température, longueur de colonne, etc.). Cette information est à la base de l’identification des composants connus qui sont séparés par cette méthode.
Ce principe se décline essentiellement en deux types de chromatographies assez différentes dans leurs mise en œuvre : la chromatographie de partage en phase gazeuse et la chromatographie liquide de haute performance ou HPLC.
La chromatographie de partage en phase gazeuse
La chromatographie de partage en phase gazeuse utilise comme principe de séparation le partage différentiel des molécules à séparer dans les deux phases stationnaires et mobiles. Dans ce type de chromatographie, la phase stationnaire est un film liquide très fin qui recouvre la surface intérieure d’un tube (la colonne), et la phase stationnaire est un gaz (d’où son nom).
Cette technique nécessite de vaporiser l’échantillon à analyser avant son injection dans la colonne. Pour cela, l’échantillon doit être chauffé. Cela suppose que les molécules d’intérêt ne soient pas dégradées à la température utilisée pour vaporiser l’échantillon. En général, le gaz utilisé est le plus neutre possible. Le plus souvent, on utilise de l’hélium ou de l’azote. L’hydrogène possède également des caractéristiques très intéressantes, mais s’agissant d’un gaz dangereux (risque d’explosion), il est beaucoup moins utilisé.
Cependant, la chromatographie de partage de loin la plus utilisée est la HPLC.
La HPLC (chromatographie liquide de haute performance)
La HPLC (high-performance liquid chromatography pour chromatographie liquide de haute performance, anciennement appelée high-pressure liquid chromatography pour chromatographie liquide à haute pression) est largement utilisée comme technique analytique et préparative. Comme son nom l’indique, la phase mobile est liquide, et non gazeuse comme dans le type de chromatographie qui vient d’être présenté. Cela dit, le principe de la séparation reste le même, à savoir le partage différentiel des molécules à séparer dans les deux phases stationnaires et mobiles. Il existe deux possibilités : soit la phase stationnaire est polaire (on parle de HPLC en phase normale), soit elle est apolaire (on parle de HPLC en phase inverse ou RP-HPLC pour reverse phase – high performance liquid chromatography). La figure 4 donne les caractéristiques comparées de chacune.
| HPLC en phase normale | HPLC en phase inverse | |
| Phase stationnaire | Polaire | Apolaire |
| Phase mobile (mode gradient) | Gradient de plus en plus polaire | Gradient de plus en plus apolaire |
| Elution des composés | Les plus polaires sont élués en dernier | Les plus apolaires sont élués en dernier |
En phase normale, les colonnes sont souvent constituées de fines particules (augmentation de la surface de contact) de gel de silice, qui portent des fonctions silanols polaires (-OH). Ce matériau a cependant un inconvénient : il se dégrade avec le temps, ce qui impacte la reproductibilité des résultats. En phase inverse, on utilise souvent de fines particules de gel de silice mais sur lesquelles on a greffé, sur les groupements – OH, des chaînes apolaires (alkyles en C4, C6, C8, C18, Phényl, Cyano, etc.). Outre le fait que cela rend le support apolaire, cela permet également de le stabiliser dans le temps. En fonction des chaînes greffées, on obtient des colonnes plus ou moins hydrophobes que l’on choisira selon la nature des molécules à séparer.
Concernant la phase mobile, comme solvant polaire, on utilise le plus souvent l’eau. Les solvants apolaires sont beaucoup plus nombreux et seront choisis en fonction des molécules à séparer. Ils sont plus ou moins apolaires selon les cas (voir figure 5). L’hydrophilie/hydrophobicité recherchée est obtenue par un mélange de ces différents solvants dans des proportions choisies. La phase mobile peut être binaire (eau + un solvant organique) ou ternaire (eau + deux solvants organiques). La colonne peut être éluée avec un mélange qui ne varie pas au cours du temps (on parle de mode isocratique) ou au contraire qui varie au cours du temps (mode gradient), en modifiant les proportions relatives des solvants polaire et apolaire.
| Solvants polaires | - Eau - DMSO (diméthylsulfoxyde) - Acétonitrile - Acide acétique |
| Solvants de polarité moyenne | - Méthanol - Ethanol - Chloroforme - Propan-2-ol - THF (tetrahydrofurane) - Propanol |
| Solvant fortement apolaire | - Fluorobenzene - Bromoethane - Chloroethane - Cyclohexane |
| Ces solvants sont classés du plus polaire au plus apolaire. | |
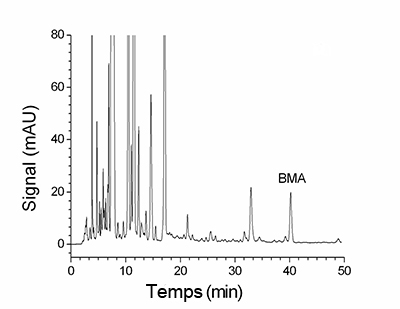
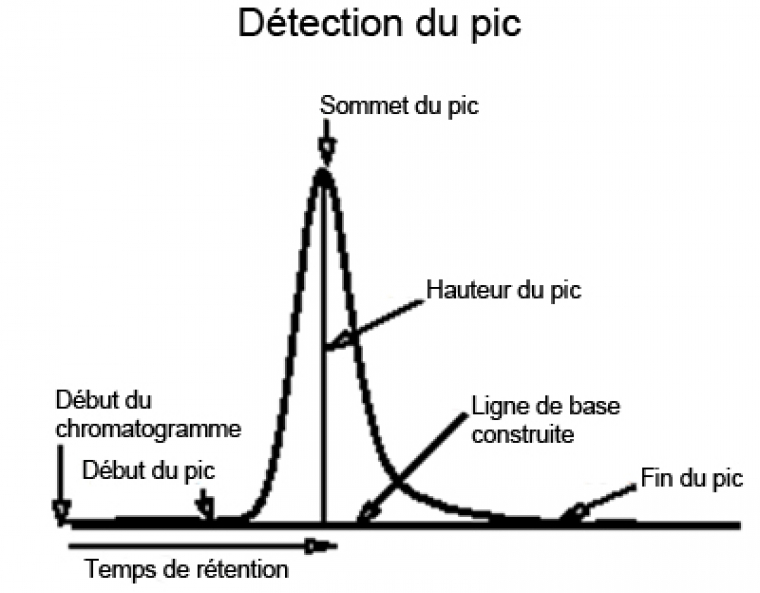
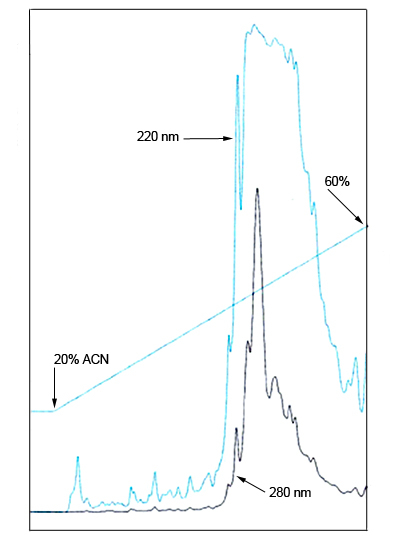
En sortie de colonne, un détecteur mesure en continu l’absorbance du liquide à une longueur d’onde choisie en fonction de la molécule recherchée, ce qui permet de suivre la sortie des différentes molécules de la colonne. On obtient un tracé correspondant à la variation de l’absorbance de l’éluant en sortie de colonne en fonction du temps (figure 6). Chaque pic correspond dans l’idéal à la sortie d’une unique espèce moléculaire qui modifie l’absorbance de l’éluant. Le temps qui s’écoule entre l’injection du mélange dans la colonne et le sommet d’un pic correspond au temps de rétention de la molécule (figure 7). Ce temps est caractéristique d’une molécule pour un ensemble donné de paramètres (nature et taille de la colonne, nature et débit de l’éluant, pression, température, etc.).
On distingue différents pics qui sont trop rapprochés pour être totalement individualisés.
ACN = Acétonitrile
Les différentes molécules présentes dans un mélange initial ayant chacune un temps de rétention différent, on obtient une série de pics étalée dans le temps. Bien entendu, il arrive souvent que les temps de rétention de deux ou plusieurs molécules différentes soient trop proches pour que leurs pics respectifs soient totalement séparés (figure 8). On a alors un mélange de deux ou plusieurs molécules, plus ou moins enrichi pour chacune d'entre elles.
Dans une HPLC analytique, on peut récupérer séparément, en sortie de colonne, le liquide correspondant à chaque pic et l’analyser pour déterminer la nature de chaque molécule. Dans une HPLC préparative, on peut se contenter de récupérer en sortie de colonne le liquide du pic dans lequel se trouve la molécule d’intérêt. Il suffit pour cela de récupérer le liquide qui sort de la colonne après un temps t correspondant au temps de rétention de la molécule d’intérêt. Bien entendu, il est nécessaire d’avoir déterminé au préalable ce temps de rétention.
La chromatographie d’affinité
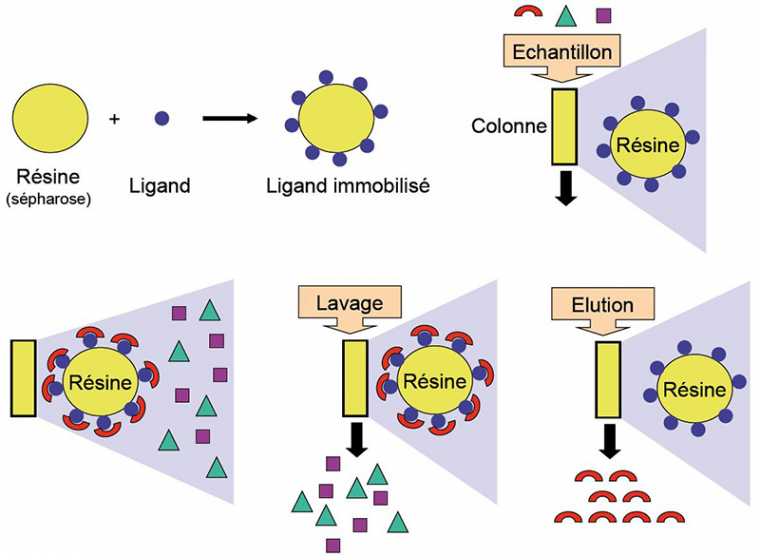
Dans la chromatographie d’affinité, la séparation des molécules va se faire selon leur capacité à se lier à un ligand spécifique fixé sur une résine. Toute la subtilité de la technique consiste à choisir judicieusement le ligand qui est utilisé. Un exemple classique est l’utilisation d’un anticorps qui reconnaît spécifiquement la molécule à purifier. Lors du dépôt du mélange contenant la molécule à purifier, seules les molécules possédant de l’affinité pour le ligand attaché à la résine vont se lier (dans l’idéal, une seule espèce moléculaire). Il faut, bien sûr, que la résine porteuse soit la plus neutre possible, pour éviter la fixation non spécifique d’autres espèces moléculaires. Après avoir éliminé le « non-fixé » en lavant la résine avec le tampon de fixation, la molécule d’intérêt peut être éluée, par exemple en utilisant un tampon d’élution de haute force ionique, de pH différent, ou comportant une forte concentration d’une molécule possédant également de l’affinité pour le ligand (libération de la molécule d’intérêt par compétition pour les sites de fixation). Voir la figure 9.
L’avantage de cette technique est sa très grande sélectivité potentielle, à tel point que son utilisation peut parfois permettre une purification suffisante en une seule étape, ce qui est rarement le cas avec les autres types de chromatographie.
L’inconvénient de cette technique provient de la nécessité de posséder un ligand adapté, lui-même suffisamment purifié. Il faut donc, dans une première étape, trouver un ligand suffisamment spécifique (ce qui détermine la sélectivité de la purification) et qui possède pour la molécule d’intérêt une affinité ni trop faible (il faut une interaction suffisante pour que cette molécule soit retenue), ni trop forte (car il faut pouvoir la décrocher). Une fois la « perle rare » trouvée, il faut, dans une seconde étape, purifier ce ligand avant de le coupler à une résine porteuse. La purification du ligand est nécessaire car l’utilisation d’un mélange entraînerait une forte probabilité de fixer des molécules autres que celle d’intérêt. Le couplage est, lui, généralement simple, des matériels et techniques bien rodés étant disponibles.
La chromatographie d’affinité est donc très puissante par sa sélectivité importante, mais souvent plus lourde et plus onéreuse à mettre en œuvre que d’autres types de chromatographie. Par ailleurs, elle n’est pas adaptée à la purification de grandes quantités de molécules. En effet, la capacité est fonction du nombre de sites disponibles sur la résine : lorsque ceux-ci sont saturés, les molécules en surnombre ne seront pas purifiées.
Conclusion
La chromatographie est une technique qui se décline selon de multiples variantes pour séparer des constituants dans un but soit analytique, soit préparatif. Cet ensemble de techniques, parfois très différentes dans leur mise en œuvre, est très utilisé en laboratoire comme dans les établissements scolaires (la chromatographie des chlorophylles d’un végétal est un grand classique). S’agissant de séparer des molécules pouvant être très variées dans leur composition, poids moléculaire ou forme, la chromatographie nécessite le plus souvent une étape de mise au point pour trouver le protocole adapté. Il est également rare de pouvoir purifier convenablement une molécule en une seule étape, et il est généralement nécessaire de réaliser successivement plusieurs types de chromatographies, ou de coupler cette technique avec d’autres techniques de purification (centrifugation, électrophorèse, précipitation, etc.). Vous trouverez, dans la figure 10, une comparaison entre les différents types de chromatographie.
| Type de chromatographie | Exclusion | Echangeuse d'ions | HPLC | Affinité |
| Concentration | Ne concentre pas l'échantillon | Concentre l'échantillon | Concentre l'échantillon | Concentre l'échantillon |
| Résolution | Résolution modérée | Résolution modérée à élevée | Bonne résolution | Très bonne résolution |
| Capacité | Capacité modérée | Haute capacité | Capacité modérée | Haute capacité |
| Récupération de l'activité | Bonne récupération de l'activité | Bonne récupération de l'activité | Dénaturation possible des protéines par les phases mobiles organiques | Bonne récupération de l'activité |
| Observations diverses | Utilisable pour changer de tampon Compatibilité avec les détergents |
Très bonne sélectivité |
Technique simple |
Très bonne sélectivité |