Cet article présente des techniques d'observation extemporanées de cellules de foie utilisables en classe. Il fournit également quelques images d'observation d'hépatocytes à différents grossissements.
Introduction
Si les préparations extemporanées de cellules et tissus végétaux sont faciles à réaliser et si les sources de matériel biologique approprié sont nombreuses et variées, il n’en est pas de même lorsque l’on veut observer des cellules animales. En particulier, l’interdiction d’utiliser des produits du corps humain (voir note de service n°93-077 du 12 janvier 1993, BO n° 3 du 21 janvier 1993) empêche depuis plusieurs années d’avoir recours aux cellules de la muqueuse buccale ou aux cellules sanguines humaines qui ont constitué pendant des années le matériel de choix pour réaliser des préparations microscopiques extemporanées de cellules animales vivantes. Or, le programme de seconde comporte un chapitre intitulé « La cellule, unité de base du vivant » pour lequel il peut être intéressant d’observer des cellules animales vivantes à côté des observations habituelles sur l’épiderme interne d’écaille de bulbe d’oignon.
Un matériel pratique pour l’observation microscopique des cellules est constitué par le foie frais. On trouve chez les bouchers du foie de porc, mouton, génisse, veau, poulet ou lapin et le foie de toutes ces espèces peut être utilisé indifféremment. La seule contrainte dont il faut tenir compte est que le foie ne doit pas avoir été congelé. De plus, étant donné que le programme de première S prévoit désormais l’étude de l’homéostat glucidique, il peut être intéressant dans cette classe d’observer les hépatocytes. En effet, ces cellules constituent la principale cible des systèmes de régulation impliqués dans le contrôle de la glycémie et il est également possible d’y mettre en évidence la présence de glycogène. Enfin, le glycogène peut également être extrait du même foie pour être caractérisé chimiquement.
Protocole
-
Couper un petit morceau de foie et gratter avec une spatule la surface de la section de façon à déposer sur une lame de microscope un échantillon de la taille d’une lentille au maximum.
-
Dissocier au mieux les cellules avec la spatule puis recouvrir d’une goutte de bleu de méthylène.
-
Laisser agir environ une minute.
-
Déposer une goutte de glycérol et bien mélanger avec la spatule.
Le glycérol rend possible l’observation de la préparation pendant une longue durée sans risquer l’évaporation du milieu de montage. -
Poser une lamelle sur l’échantillon et placer l’ensemble sur une feuille de papier essuie-tout.
-
Utiliser une autre feuille pour presser fermement sur la lamelle de façon à dissocier les cellules en prenant garde de ne pas casser la lamelle.
Le papier sert à essorer le trop plein de liquide qui s’échappe lors du pressage. -
Essuyer soigneusement la surface de la lamelle et observer au microscope.
-
Rechercher les régions de la préparation où les cellules sont dissociées et suffisamment colorées pour faciliter leur observation.
Le même protocole peut être appliqué pour colorer la préparation avec du Lugol (eau iodée) qui colore le glycogène en brun acajou. Noter que, selon l’origine du foie, la quantité de glycogène présent dans les hépatocytes est extrêmement variable.
Résultats
Une fois dissociés, les hépatocytes qui ont une forme grossièrement cubique in situ, prennent une forme arrondie due à l’absence des contraintes exercées par les cellules voisines dans le parenchyme hépatique normal.
Les cellules dissociées ont un diamètre moyen d’une trentaine de µm, mais on observe des variations de taille considérables, certaines cellules atteignant à peine une vingtaine de µm alors que d’autres mesurent plus de 50 µm.
En règle générale, les cellules les plus petites possèdent un seul noyau tandis que les plus grandes possèdent deux voire trois noyaux, ce qui est en accord avec le fait bien connu que les cellules du foie des mammifères sont souvent polyploïdes.
Les noyaux colorés par le bleu de méthylène sont arrondis et présentent le plus souvent plusieurs nucléoles.
Diverses granulations sont présentes dans le cytoplasme mais leur dimension, à la limite du pouvoir de résolution du microscope optique, ne permet pas de les identifier formellement. On sait cependant que la microscopie électronique a révélé la richesse de l’hépatocyte en organites divers, mitochondries, peroxysomes, reticulum endoplasmique lisse et granulaire, etc.
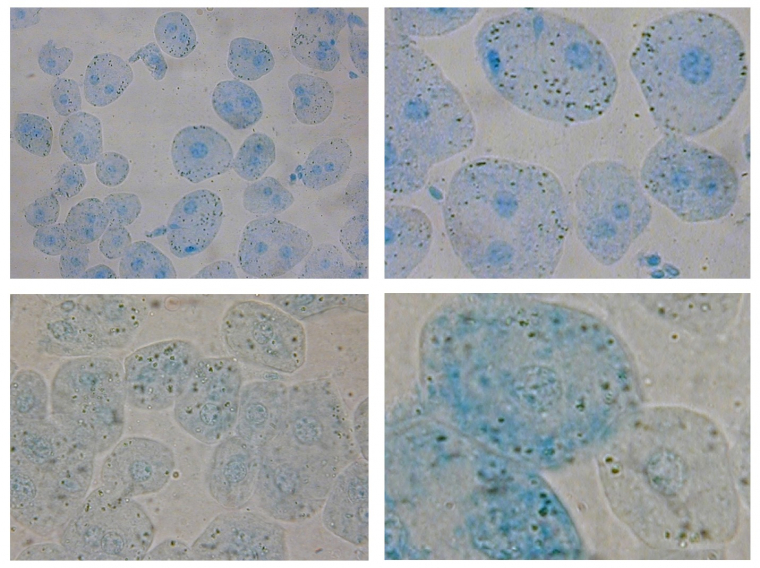
Après coloration au bleu de méthylène, ces cellules de foie de lapin sont observées à différents grossissements
- en haut à gauche : x400
- en haut à droite : x400 et zoom numérique x2
- en bas à gauche : objectif à immersion x1000
- en bas à droite : objectif à immersion x1000 et zoom numérique x2
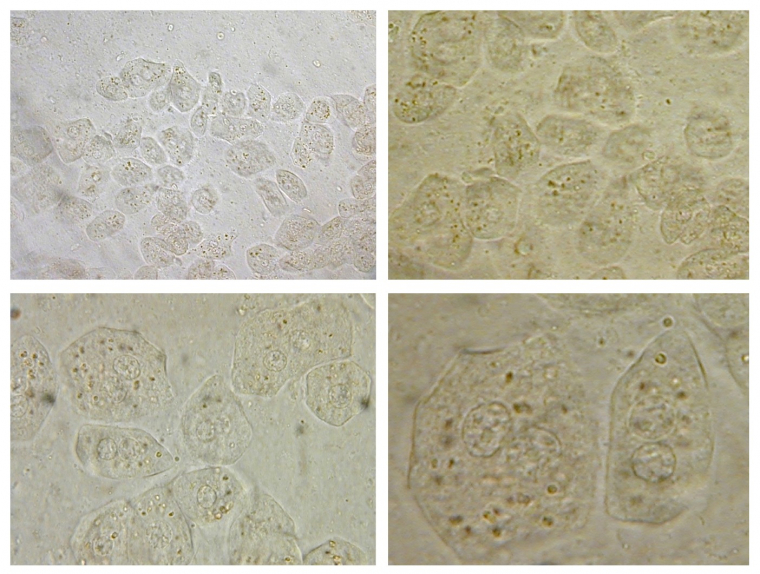
Après coloration au Lugol, ces cellules de foie de lapin sont observées à différents grossissements
- en haut à gauche : x400
- en haut à droite : x400 et zoom numérique x2
- en bas à gauche : objectif à immersion x1000
- en bas à droite : objectif à immersion x1000 et zoom numérique x2
Solutions
-
Bleu de méthylène
-
Dissoudre 100 mg de bleu de méthylène en poudre dans 100 mL d’eau distillée.
-
-
Lugol (eau iodée)
-
Dissoudre 2 g d’iodure de potassium dans un peu d’eau distillée.
-
Ajouter progressivement 1 g d’iode tout en agitant la solution sur agitateur magnétique.
-
Compléter à 20 mL avec de l’eau distillée (il faut du Lugol très concentré pour colorer le glycogène in situ).
-