Au programme de l'actualité biologique du mois de décembre : l'influence discutée des mutations synonymes sur la valeur sélective, une explication à la résistance des chauves-souris aux virus, une mise en lumière des relations entre le microbiote intestinal, le cerveau et le système immunitaire et, pour finir, des loups manipulés par l'agent de la toxoplasmose.
Les mutations synonymes sont-elles neutres ?
Depuis quelques années, le paradigme consistant à dire qu’une mutation synonyme – ou silencieuse1 – n’a pas d’effet sur l’organisme est remis en cause. En effet, il a été prouvé que certaines maladies génétiques sont liées à la présence d’une mutation synonyme dans le génome. Il a également été montré que ces mutations agissent non pas sur la qualité des protéines produites (qui sont identiques), mais sur leur quantité.
Dans un travail publié dans Nature, Xukang Shen et ses collaborateurs ont déterminé l’influence des mutations synonymes chez les levures Saccharomyces cerevisiae en comparant la valeur adaptative (fitness) de souches sauvages avec celle de souches porteuses d’une mutation synonyme et celle de souches porteuses d’une mutation faux-sens 2. Les mutations portaient sur 21 gènes non essentiels. La valeur adaptative de chaque souche a été estimée à partir de la fréquence des génomes sauvage et mutants dans une culture mixte après 30 générations. Les résultats ont montré que les trois quarts des mutants portant une mutation synonyme se reproduisaient moins efficacement que les sauvages. De plus, les mutations synonymes diminuaient autant la valeur adaptative que les mutations faux sens.
Le taux de mutation synonymes séparant deux lignées est utilisé comme horloge moléculaire, pour dater la divergence entre ces lignées. Ce principe suppose que les mutations synonymes s’accumulent au même rythme dans des taxons proches, car elles n’ont pas d’effet sur la valeur sélective. Si les résultats obtenus chez Saccharomyces étaient reproduits chez d’autres vivants, les dates de divergence entre lignées produites selon le principe de l’horloge moléculaire seraient à remettre en question.
Cependant, il est important de noter que les résultats de Shen ont suscité de nombreux commentaires dans la communauté scientifique, en particulier à propos des témoins utilisés, qui ne seraient pas adaptés. Dans une prépublication mise en ligne sur la plateforme bioRxiv, Kruglyak et ses collaborateurs notent qu’un « réexamen des données de Shen et coll. suggère fortement qu’elles sont entièrement cohérentes avec la prévision que la plupart des mutations non synonymes et presque toutes les mutations synonymes n'ont pas d'effets détectables sur la valeur sélective » 3.
Protéine kinase R et résistance des chauves-souris aux virus
Les chauves-souris ont la particularité de résister à de nombreux virus, un phénomène rare chez les mammifères qui intéresse d’autant plus les scientifiques que ces êtres vivants peuvent héberger des virus transmissibles aux êtres humains. Pour comprendre les mécanismes sous-jacents, une équipe de chercheurs s’est intéressée au gène EIF2AK2 codant la protéine kinase R (PKR) 4. Cette enzyme, présente chez tous les mammifères, joue un rôle fondamental dans la réponse immunitaire antivirale innée. En effet, d’une part, elle reconnaît le matériel génétique viral présent dans le cytoplasme d’une cellule infectée et déclenche la synthèse d’interférons de type I. D’autre part, sa synthèse dans les cellules voisines, sous l’effet des interférons, permet de stopper la traduction du matériel génétique viral et donc de bloquer la multiplication du virus.
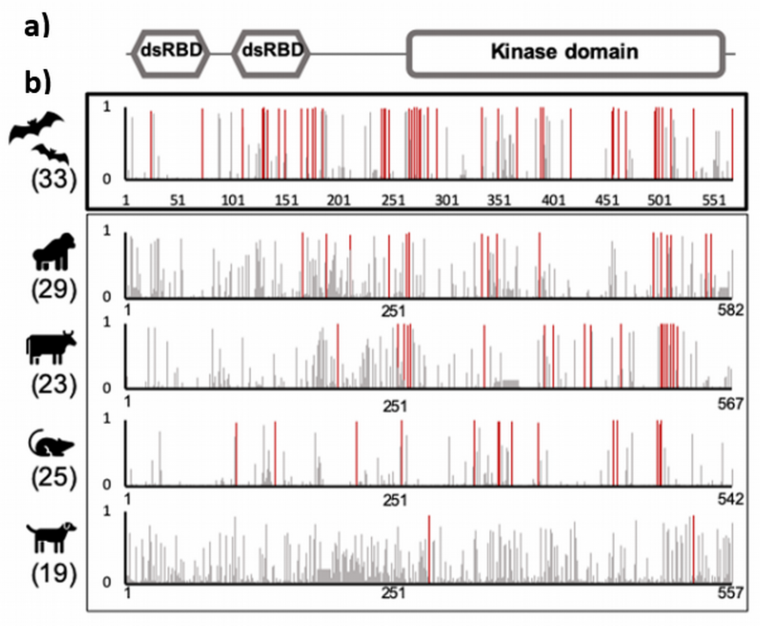
L’étude révèle que les chauves-souris possèdent plusieurs copies fonctionnelles du gène EIF2AK2 contrairement aux autres mammifères qui n’en ont qu’une. Toutes sont issues d’un gène ancestral commun. La comparaison de la séquence de ce gène chez différentes espèces de mammifères a permis de mettre en évidence des sites à évolution rapide. Cependant, alors que ces sites sont généralement regroupés dans le domaine kinase de la protéine (une région essentielle à la transduction du signal), ils sont dispersés chez les chauves-souris et se retrouvent à la fois dans le domaine kinase ainsi que dans le domaine de liaison à l’ARN viral. Les mutations affectant ces régions diffèrent selon les espèces et auraient permis de contourner les mécanismes d’échappement mis en place par les virus. Ces mutations auraient donc été sélectionnées positivement. Leur accumulation, combinée aux duplications du gène EIF2AK2, auraient ainsi permis aux chauves-souris de présenter une réponse immunitaire innée efficace face à un large éventail de virus. L’acquisition de leur multirésistance serait donc le fruit d’une longue coévolution avec les virus, auxquels elles sont confrontées depuis leur apparition, il y a environ 60 millions d’années.
a) Mise en évidence des domaines qui composent le gène EIF2AK2. dsRBD correspond au domaine de liaison à l’ARN double brin et kinase domain à la région responsable de la transduction du signal.
b) Localisation des sites à évolution rapide (en rouge) dans le gène EIF2AK2 de différents groupes de mammifères. Les valeurs entre parenthèses correspondent aux nombres d’espèces étudiées dans chaque groupe.
Garantir l’homéostasie de l’organisme grâce à un triptyque à bichonner tout au long de sa vie !
Depuis les découvertes novatrices de relations étroites entre déséquilibre du microbiote intestinal et problèmes de santé (développement du diabète par exemple), les interactions entre ces micro-organismes peuplant notre système digestif et les grands systèmes fonctionnels du corps humain ont été à maintes reprises étudiées et approfondies 1. La constatation du rôle fondamental joué par les micro-organismes présents à la surface et au sein d’un être vivant est à l’origine du concept d’holobionte, défini par Lynn Margulis au début des années 1990 23 puis développé par Zilber-Rosenberg et Rosenberg en 2008 4. Le terme d’holobionte désigne l’organisme associé à l’ensemble des espèces microbiennes avec lesquelles il interagit et établit un dialogue moléculaire.
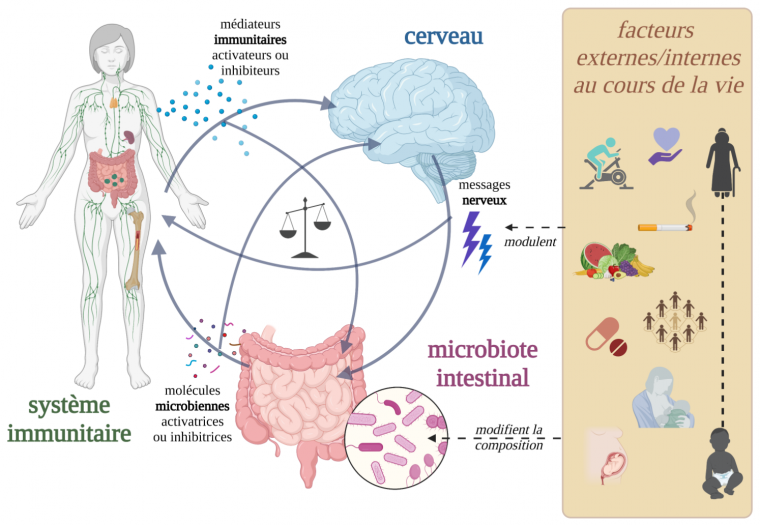
Chez l’être humain, de multiples liens entre le microbiote et son hôte restent encore à préciser, mais considérer le fonctionnement coordonné de l’axe microbiote intestinal-système immunitaire-système nerveux central semble dorénavant incontournable dans le cadre de nombreuses études thérapeutiques 5. En effet, tout au long de la vie de l’individu, le cerveau, le microbiote intestinal et le système immunitaire s’influencent mutuellement et permettent le maintien de l’homéostasie de l’holobionte.
Ainsi, des signaux émis par le microbiote symbiotique peuvent modifier le fonctionnement des cellules immunitaires en réponse à la présence de pathogènes par exemple. Cette interaction intestin-système immunitaire dépend de signaux internes et externes modulant la composition du microbiote intestinal, et par conséquent le type de molécules microbiennes produites, qui peuvent avoir un rôle activateur ou inhibiteur du système immunitaire. Par la suite, de nombreux médiateurs immunitaires comme certaines cytokines peuvent traverser la barrière hémato-encéphalique et produire des effets sur le système nerveux central, mais également avoir une rétroaction sur le microbiote intestinal. Une perturbation de l’équilibre entre ces trois systèmes pourrait engendrer des conséquences neurophysiologiques et/ou comportementales, telles que l’apparition de pathologies psychiques mais également d’allergies.
Les caractéristiques de l’équilibre de ce triptyque intestin-système immunitaire-cerveau sont déterminées tout au long de la vie d’un individu, et ce dès la gestation, par l’influence du mode de vie des deux parents (régime alimentaire, tabagisme, santé mentale, médication…). La composition taxonomique et fonctionnelle du microbiote intestinal se diversifie ensuite chez l’enfant et l’adolescent en fonction de multiples paramètres tels que le type d’accouchement, la prématurité, les étapes de diversification alimentaire, ou encore le régime alimentaire adopté par le jeune adulte. Au stade adulte, un microbiote diversifié et robuste se stabilise et n’est plus sensible qu’aux variations de masse corporelle, au type d’alimentation et à la consommation de drogues ou d’alcool par exemple, avant de retrouver une certaine sensibilité face aux perturbations extérieures lors du vieillissement de l’organisme. Les personnes âgées présentent en effet des différences immunitaires inter-individuelles plus marquées, caractéristiques d’une sénescence plus ou moins rapide de la fonction protectrice de la barrière intestinale notamment.
Il apparaît donc nécessaire de prendre en compte l’ensemble des composantes de l’axe microbiote intestinal-système immunitaire-système nerveux central pour mieux comprendre et traiter certaines maladies neurologiques ou inflammatoires 6.
Les interactions multiples entre système nerveux central, microbiote intestinal et système immunitaire au sein de l’holobionte humain sont soumises tout au long de la vie à des influences internes ou externes à l’organisme. L’équilibre des interactions entre ces trois acteurs assure l’homéostasie de l’holobionte. Image réalisée avec Biorender.
L’agent de la toxoplasmose modifie le comportement des loups de Yellowstone
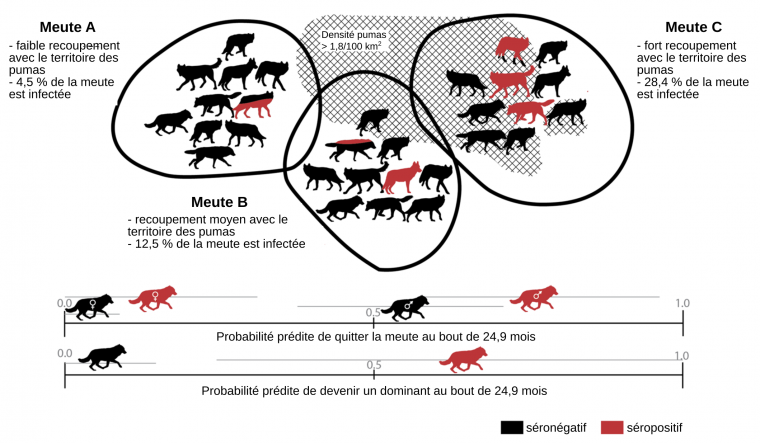
Toxoplasma gondii est un parasite intracellulaire obligatoire1 responsable de la toxoplasmose. Généraliste, il peut infecter divers organismes homéothermes, mais son hôte définitif lui permettant d’accomplir la partie sexuée de son cycle est nécessairement un félin. Dans le parc national de Yellowstone, ce sont les pumas (Puma concolor) qui constituent cet hôte définitif. Ce superprédateur partage une partie de son territoire avec d’autres carnivores, dont le loup gris (Canis lupus). Un suivi sérologique et observationnel sur 26 ans a permis de montrer une augmentation de la prévalence de la toxoplasmose chez les loups de Yellowstone, en particulier chez ceux qui partagent le plus de territoire commun avec les pumas 2. Cette proximité spatiale a pu favoriser le transfert du parasite par contact direct – consommation de viande de puma – ou indirect – ingestion d’oocystes du parasite libérés dans les urines et les fèces des pumas. Meyer et ses collègues de l’université du Montana ont montré par ailleurs une plus forte propension des loups infectés à exhiber des comportements risqués, tels le départ de la meute (« dispersers ») ou la lutte pour la dominance (« leaders »). Cette augmentation de la prise de risque pourrait favoriser la dissémination du parasite vers d’autres individus par reproduction des dominants, ou encore vers de nouveaux territoires par dispersion, et donc augmenter les chances du parasite de rencontrer son hôte définitif. De telles manipulations parasitaires du comportement ont déjà été décrites chez des rats, des hyènes ou des chimpanzés infectés qui montraient une plus grande proximité avec leurs prédateurs naturels félidés, respectivement des chats, des lions et des léopards. Il est probable que ces comportements soient pilotés par des bouleversements hormonaux, tels une augmentation de la sécrétion de testostérone favorisant l’agressivité et la témérité, et une altération de la perception du risque de prédation par des mécanismes anxiolytiques.
La zone en croisillon représente le territoire des pumas. Les zones entourées d'un trait noir représentent les territoires de trois meutes de loups. Les pourcentages d'infection prédits à partir du taux de recouvrement entre territoire des loups et territoires des pumas sont indiqués pour chaque meute.
Les auteurs et autrices remercient chaleureusement Olivier Tenaillon et Stéphanie Jacquet pour leurs relectures respectives des articles Les mutations synonymes sont-elles neutres ? et Protéine kinase R et résistance des chauves-souris aux virus.