La prolifération des cyanobactéries liée à l'eutrophisation des plans d'eau a de nombreuses conséquences. L'article présente ici la diversité de ces "algues bleu-vert" ainsi que leur mode de vie et les facteurs facilitant leur prolifération. Il s'intéresse ensuite aux diverses toxines qu'elles peuvent produire et leurs effets sur l'homme et les animaux. Il termine en présentant les textes réglementant la qualité des eaux de baignade et de consommation.
Introduction
La problématique des cyanobactéries ou « algues bleue-vert » a pris depuis plusieurs années une grande importance. En effet la prolifération de cyanobactéries liée à l’eutrophisation des plans d’eau, accélérée par l’activité humaine, a de nombreuses conséquences , notamment:
- Un aspect désagréable de l’eau, une odeur nauséabonde limitant l’utilisation des eaux récréatives ;
- La production de toxines pouvant conduire à un risque sanitaire pour les humains et les animaux ;
- La difficulté de traitement de l’eau contaminée (colmatage des filtres, élimination des toxines).
Cet article présente un certain nombre d’informations sur les cyanobactéries et les cyanotoxines, suivi de quelques aspects réglementaires concernant la qualité des eaux, en particulier concernant les cyanobactéries.
Les cyanobactéries
Les cyanobactéries sont des micro-organismes procaryotes photosynthétiques également appelées Cyanophytes ou Cyanophycées. Elles sont classées du point de vue systématique dans le règne des Eubactéries mais ont longtemps fait partie du règne végétal, car elles possèdent à la fois des caractéristiques :
- de bactérie ; absence de noyau et d’organites intracellulaires,
- d’algue ; présence de chlorophylle a et de phycobiliprotéines (pigments accessoires) et capacité à faire la photosynthèse.
Diversité morphologique
Les cyanobactéries présentent une diversité morphologique importante. En effet on les retrouve :
- Soit sous forme unicellulaire isolée ou en colonies (Fig. 1)
- Soit sous forme de trichome qui correspond à un enchaînement de cellules (thalle) sans gaine (Fig. 2)
- Soit sous forme de filament qui est un thalle avec gaine (Fig. 3)
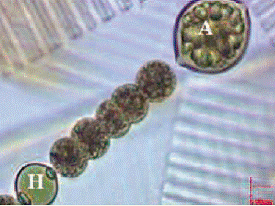
Les cyanobactéries sont généralement distinguées en fonction de leurs caractéristiques morphologiques (taille des cellules, présence de gaine, couleur). Cependant, ces caractéristiques peuvent varier en fonction des conditions environnementales, ce qui peut rendre l’identification des espèces difficile. Celle-ci peut cependant être aidée par la présence ou non d’hétérocystes (Fig. 4), cellules permettant la fixation de l’azote atmosphérique et donc conférant aux cyanobactéries la possibilité de se développer dans des milieux appauvris en azote inorganique.
Un autre type de cellule peut être observé, il s’agit d’akinètes. Ce sont des cellules de grande taille, à paroi épaisse et riche en réserves nutritionnelles. Les akinètes sont des formes de résistance qui permettent la survie des cyanobactéries sur les sédiments lorsque les conditions environnementales sont défavorables à leur maintien dans la colonne d’eau (Fig. 4).
Trichome de cyanobactérie présentant un hétérocyste (H) et un akinète (A)
Les cyanobactéries possèdent également des vacuoles de gaz qui leur permettent d’ajuster leur position dans la colonne d’eau en régulant leur flottaison. Ainsi dans la journée les cellules migrent en surface pour profiter au mieux de l’énergie lumineuse, alors que le soir elles vont plutôt avoir tendance à migrer en profondeur afin d’exploiter les nutriments qui s’y trouvent souvent en plus grande concentration. Cette variation de répartition est à prendre en compte lors de prélèvements. (Afssa/Afsset 2006 ; Lavoie et al., 2007 ; Chorus and J. Bartram, 1999)
Écologie
Grâce à leur grande capacité d’adaptation les cyanobactéries sont capables de coloniser un grand nombre de milieux terrestres et aquatiques (eaux douce et salée). Certaines espèces sont adaptées à des environnements extrêmes tels que glaciers, sources chaudes ou cendres volcaniques, car elles peuvent supporter des températures extrêmes, des pH faibles ou encore des conditions variables d’éclairement. En effet, les cyanobactéries sont photo-autotrophes c’est-à-dire qu’elles tirent leur énergie de la lumière par photosynthèse. Par conséquent, la lumière est un des facteurs essentiels à leur développement. Cependant certaines espèces peuvent survivre dans des conditions d’obscurité totale pendant de longues périodes.
En milieu aquatique, les cyanobactéries sont soit planctoniques ou encore pélagiques si elles prolifèrent en suspension dans une colonne d’eau, soit benthiques quand elles se développent fixées à un support. (Affsa/Afsset 2006 ;Lavoie et al., 2007 ; Chorus and J. Bartram, 1999)
Les pigments
La réalisation de la photosynthèse met en jeu un ensemble de pigments photosynthétiques. Le terme de « pigment » correspond au fait que ces molécules sont colorées, de par leur capacité à capter certaines radiations lumineuses. Les cyanobactéries synthétisent plusieurs types de pigments qui sont : la chlorophylle a, les caroténoïdes et des phycobiliprotéines ou pigments accessoires tels que la phycocyanine, la phycoerythrine et l’allophycocyanine. Cette composition en pigments, spécifique des cyanobactéries, leur permet d’exploiter le rayonnement solaire disponible sur une plus grande étendue de longueurs d’ondes, comparé aux autres algues, ainsi la photosynthèse est plus efficace même à faible intensité lumineuse. (Lavoie et al., 2007)
Croissance et prolifération
La multiplication des cyanobactéries est végétative, c’est-à-dire asexuée. Celle-ci s’effectue par bourgeonnement ou par divisions multiples. Dans des conditions environnementales favorables, les cyanobactéries peuvent connaître des phases de prolifération importante appelées efflorescence ou bloom. Le plus souvent il se forme alors en surface des agrégats flottants appelés « fleurs d’eau », écume ou mousse. Ces blooms sont souvent corrélés à un processus d’eutrophisation, c’est-à-dire à l’enrichissement du milieu en nutriments.
C’est pourquoi un des facteurs principaux favorisant ces proliférations est la présence de phosphore sous forme orthophosphate, d’azote et de fer en concentration élevée. En effet les cyanobactéries présentent plus d’affinités pour le phosphore que les autres algues. De plus elles sont capables de le stocker. Concernant l’azote, les cyanobactéries peuvent fixer l’azote atmosphérique dans leurs hétérocystes ce qui les rend très compétitives par rapport aux autres algues lorsque l’azote est limitant (Blais 2002).
Les autres facteurs influençant les proliférations sont :
- La stabilité des colonnes d’eau
- Les conditions météorologiques : température (air, eau à 15-30 °C) et luminosité (intensité lumineuse modérée).
- Les conséquences de l’eutrophisation. En effet lors de ce processus, certaines cyanobactéries sont capables d’utiliser le sulfure d’hydrogène qui se forme et qui est toxique pour la plupart des organismes. Elles peuvent également survivre dans des conditions de faible oxygénation et de faible disponibilité en lumière, conditions défavorables aux autres algues. Il survient alors un déséquilibre dans la composition du phytoplancton qui laisse place aux cyanobactéries (Lavoie et al., 2007).
La prolifération des cyanobactéries a de multiples conséquences au niveau de l’environnement qui sont :
- Une coloration inhabituelle de l’eau avec un dégagement olfactif important.
- Une perturbation de l’écosystème à plusieurs niveaux :
- déséquilibre entre les différentes communautés de phytoplancton,
- mortalité des poissons à cause de leur toxine, de la diminution en oxygène du milieu et de la hausse du pH. Ces mêmes toxines sont responsables de la mortalité d’oiseaux et d’animaux domestiques ou sauvages par abreuvement dans une eau contaminée ou par consommation d’aliments contaminés (mollusques, poissons).
Ces proliférations ont également un impact sur la santé humaine (les mécanismes de la toxicité sont explicités dans le paragraphe suivant). En effet, une exposition aux efflorescences de cyanobactéries peut entraîner des troubles de la peau ou des muqueuses et un risque sanitaire important en cas d’ingestion, d’inhalation ou d’exposition par dialyse aux toxines. Ainsi il a été décrit (Lefeuvre et al., 2004) :
- des cas de gastro-entérites, d’affections hépatiques, de troubles rénaux et une augmentation de l’incidence de cancers colorectaux et hépatiques lors d’une exposition par l’eau de boisson ;
- des cas d’éruption cutanée, d’allergies, de nausées, de vomissements, de diarrhées, de douleurs musculaires, de maux de tête, de pneumonie et de conjonctivites lors d’une exposition à l’occasion de baignades ou d’activités nautiques.
Enfin ces proliférations entraînent des difficultés dans le traitement de potabilisation de l’eau contaminée (colmatage des filtres, élimination des toxines).(Afssa/Afsset 2006 ; Chorus and J. Bartram, 1999).
Les cyanotoxines
Les cyanotoxines sont des molécules intracellulaires, de structures variées. Elles sont synthétisées par des cyanobactéries en phase de croissance et se retrouvent dans l’eau lors de la mort ou de la lyse cellulaire. Une même toxine peut être produite par des espèces différentes et une même espèce peut produire des toxines différentes (tableau ci-dessous). De plus, la quantité de toxine produite est très variable au sein d’une espèce et dépend des conditions environnementales.
|
Nom |
Toxine |
|
Anabaena circinalis |
Anatoxines, Saxitoxines, microcystines |
|
Anabaena planctonica |
Anatoxine a |
|
Aphanizomenon flos-aquae |
Anatoxine a, saxitoxines |
|
Cylindrospermopsis raciborskii |
Cylindrospermopsine, saxitoxines |
|
Lyngbya gracilis |
debromoaplysiatoxines |
|
Microcystis aeruginosa |
Microcystines |
|
Oscillatoria sp |
Anatoxines a |
|
Planktothrix agardhii |
Microcystines |
|
Planktothrix rubescens |
Microcystines |
|
Raphidiopsis sp. |
Cylindrospermopsine |
|
Woronichinia naegeliana |
Anatoxines a |
| Source : Affsa/Afsset, 2006. | |
Pourquoi cette production de toxines ?
Différentes théories sont actuellement en discussion. La production de ces toxines pourrait contribuer à augmenter l’avantage compétitif des cyanobactéries dans le « but » d’atteindre la dominance du monde aquatique. Ces toxines permettraient d’éliminer de potentiels compétiteurs pour les ressources ainsi que des prédateurs. La microcystine, par exemple, protégerait les cyanobactéries contre la prédation par le zooplancton. Mais les toxines auraient également des fonctions régulatrices du métabolisme cellulaire et interviendraient dans la croissance de la cellule. En effet, il semble que leur production soit liée au métabolisme primaire, directement corrélé à la croissance cellulaire. ( Lavoie et al., 2007)
Diversité des toxines
Il existe plusieurs types de toxines que l’on peut classer soit en fonction de leur mode d’action, soit en fonction de leur structure.
Les hépatotoxines
Ce sont les toxines les plus fréquemment rencontrées lors de proliférations. On distingue 3 grandes familles ( Affsa/Afsset 2006) qui sont :
-
Les microcystines, peptide cyclique de 7 acides aminés.
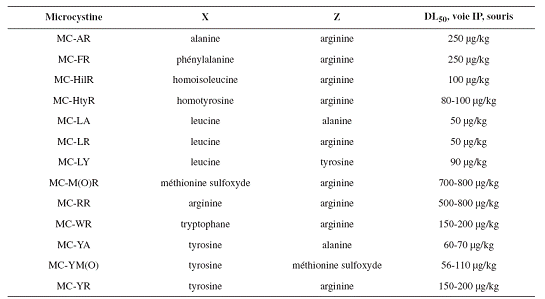
On distingue plus de 80 variants de masse moléculaire comprise entre 800 et 1100 daltons. Les variants proviennent majoritairement de substitution d’acide aminé en position 2 et 4 ou bien du retrait/ajout d’un groupement méthyle sur les acides aminés 3 et 7. Les microcystines sont solubles dans l’eau et très stable dans l’environnement. Comme le montre le tableau ci-dessous, la toxicité (ici exprimée en DL50 ; la dose létale pour 50 % est la quantité d’une matière, qui, administrée en une seule fois, cause la mort de la moité des animaux d’un groupe d’essai) est variable en fonction du type de microcystine. La microcystine LR (pour leucine en 2 et arginine en 4) étant la plus toxique par voie intrapéritonéale. Si l’on considère la voie orale, on obtient une DL50 chez la souris de plus de 5000 µg/kg.
IP = voie intrapéritonéale (Source: Jaeg JP, 2007)
-
Les nodularines sont des peptides cycliques de 5 acides aminés. On distingue 9 variants en fonction de la position des méthylations. Elles sont très proches des microcystines, même gamme de poids moléculaire et propriétés physico-chimiques identiques.
-
La cylindrospermopsine est un alcaloïde de 415 daltons. Il en existe 2 variants, un non toxique et un toxique avec une DL 50 après injection intrapéritonéale chez la souris de 2,1 mg/kg. C’est une molécule très polaire et soluble dans l’eau.
La toxicité des hépatotoxines peut s’expliquer selon le mécanisme suivant. Les microcystines et la nodularine, une fois ingérées, se retrouvent concentrées dans les hépatocytes par un mécanisme de transport d’anions organiques comme les acides biliaires. En effet les microcystines possèdent des propriétés physico-chimiques peu favorables à la diffusion passive à travers les membranes cellulaires, celle-ci étant possible mais assez faible. Après une administration orale, l’absorption des microcystines se fait surtout au niveau de l’iléon, partie du tube digestif riche en transporteurs d’anions organiques.
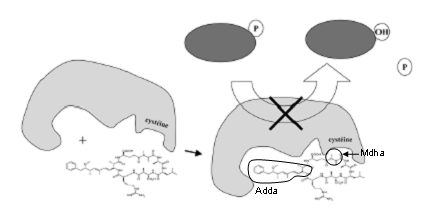
Une fois dans la cellule, les hépatotoxines se lient aux protéines phosphatases 1 et 2a, entraînant leur inhibition. La fixation des microcystines sur les protéines phosphatases se fait en 2 étapes (Fig. 7). Tout d’abord il y a formation d’interactions de faible énergie type Van der Waals et électrostatiques ce qui permet un rapprochement entre l’acide aminé Mdha (méthyldéhydro-alanine) de la toxine et la cystéine 273 de la PP1 ou 266 de PP2A. Ceux-ci vont alors réagir et former une liaison covalente. Suite à cette liaison, l’acide aminé Adda (acide 3-amino-9-méthoxy-2-6,8-triméthyl-10-phényldéca-4,6-dinéoïque) se retrouve dans un sillon hydrophobe de la partie catalytique de l’enzyme, ce qui entraîne son inactivation.
Les conséquences de cette inhibition sont nombreuses, car les PP1 et PP2A déphosphorylent des résidus sérine ou thréonine de nombreuses protéines dont l’actine et la cytokératine, protéines du cytosquelette de la cellule. L’hyperphosphorylation des protéines cellulaires entraîne donc la désorganisation du cytosquelette et la disparition des jonctions cellulaires ce qui se traduit au niveau macroscopique par :
- la destruction progressive de la structure des hépatocytes et du parenchyme hépatique, conduisant à la nécrose ;
- des hémorragies.
La microcystine est également responsable de l’apparition d’un stress oxydatif à l’intérieur des cellules, avec, pour conséquences, une diminution du glutathion réduit, une peroxydation des lipides et des cassures de l’ADN.
Au niveau clinique, une intoxication chronique par des hépatotoxines se traduit par des modifications histopathologiques du foie et une élévation des enzymes hépatiques. Des études épidémiologiques ont également mis en évidence une relation entre la présence de microcystine dans l’eau de boisson et le développement de cancers hépatiques et colorectaux. Ces résultats ont été confirmés par des études de cancérogenèse qui montrent que la microcystine serait un promoteur de tumeur plutôt qu’un initiateur. En effet la microcystine ne semble pas être directement génotoxique : les lésions d’ADN observées seraient la conséquence du stress oxydatif. De plus il a été démontré que les microcystines inhibent la réparation des lésions de l’ADN.
Il a également été montré, lors d’études sur la reproduction et le développement chez la souris, une embryotoxicité aux doses qui entraînent une toxicité sévère chez la mère. Cela se traduit au niveau du fœtus par une réduction de la taille du cerveau, une hydrocéphalie, un retard de croissance et d’ossification.
Si l’on considère la toxicité par inhalation, autre voie possible d’exposition de l’homme, il a été observé une nécrose de l’épithélium nasal suite à l’exposition à la microcystine LR.
En conclusion la toxicité des microcystines et des nodularines est assez complexe et s’exprime différemment en fonction de la structure et de la dose. Par exemple, à fortes doses, elles entraînent la mort cellulaire, alors qu’à faible dose elles provoquent plutôt une prolifération cellulaire (Jaeg, 2007 ;Groupe scientifique sur l’eau, 2004 ; Chorus and J. Bartram, 1999).
La cylindrospermopsine, quant à elle, inhibe la synthèse de protéines de façon non spécifique. Les organes les plus touchés sont les reins et le foie. Cependant d’autres organes peuvent être affectés comme les poumons, les surrénales, l’estomac, le pancréas et les intestins.
Neurotoxines
Elles sont regroupées en 3 familles qui sont (Afssa/Afsset 2006) :
- Les anatoxines, alcaloïdes parmi lesquels on trouve :
- L’anatoxine a, amine secondaire de 165 daltons, soluble dans l’eau, peu stable et rapidement dégradée dans l’environnement. Chez la souris sa DL50 est de 250 µg/kg en intrapéritonéale et de plus de 5000 µg/kg par voie orale.
- L’anatoxine a(s) est un ester de phosphate de 252 daltons, instable au pH alcalins et à la chaleur. Sa DL50 chez la souris par voie intrapéritonéale est de 20 µg/kg.
- Les saxitoxines qui forment une famille de 25 variants d’alcaloïdes à noyau tétrahydropurique. Leur poids moléculaire varie de 241 à 491 daltons. Elles sont très stables dans l’eau.
- La BMAA ou β-méthylamino-L-alanine, molécule de type acide aminé.
Les neurotoxines ciblent la jonction neuromusculaire avec un mode d’action spécifique à chaque famille.
L’anatoxine a est un agoniste des récepteurs à l’acétylcholine. L’acétylcholine étant le neurotransmetteur principal de la jonction neuromusculaire, l’anatoxine entraîne donc une dépolarisation de la jonction neuromusculaire qui se traduit par des fasciculations musculaires, des convulsions et l’apparition d’une détresse respiratoire. L’acétylcholine intervient également dans la transmission de l’influx nerveux au niveau de synapses du système nerveux central et périphérique. Elle subit normalement une dégradation permanente par l’acétylcholinestérase qui ne peut en revanche dégrader l’anatoxine a, entraînant alors son accumulation. Ceci a pour conséquence l’apparition d’un syndrome cholinergique et en particulier des troubles psychiques, une faiblesse musculaire et une activité sécrétoire excessive.
L’anatoxine a(s), quant à elle, inhibe spécifiquement l’acétylcholinestérase. L’acétylcholine n’est alors plus suffisamment dégradée. Elle s’accumule et provoque une stimulation excessive des récepteurs cholinergiques. Les effets induits sont similaires à ceux observés avec l’anatoxine a (syndrome cholinergique). L’anatoxine a(s) est cependant dix fois plus toxique pour l’animal que l’anatoxine a.
Les anatoxines n’ont pas montré d’effet embryotoxique lors d’études sur la reproduction, excepté aux doses entraînant une toxicité sévère chez la mère (retard de croissance et malformations)
Pour ce qui est des saxitoxines, celles-ci inhibent la transmission nerveuse en bloquant les canaux sodiques. Ce qui a pour conséquence un syndrome PSP (Paralytic Shellfish Poison). Les symptômes observés chez un animal intoxiqué sont des tremblements, une suffocation, des convulsions et un opisthotonos (état d’hyper-extension et de raideur, dans lequel la tête, le cou et la colonne vertébrale d'un individu forment un pont, Jaeg, 2007 ;Groupe scientifique sur l’eau, 2004 ; Chorus and J. Bartram, 1999).
Un autre mécanisme de neurotoxicité a été observé pour la BMAA qui agit comme un agoniste du récepteur glutamate. Le glutamate étant un neurotransmetteur excitateur, la BMAA entraîne également une excitation des neurones qui y répondent.
Les molécules à effets irritants
Il en existe de 2 types :
- Des alcaloïdes dermatotoxiques comme l’aplysiatoxine, la debroaplysiatoxine et la lyngbyatoxine-a. Ces molécules ont été identifiées dans les eaux de mer mais pas encore dans les eaux douces.
- Les lipopolysaccharides (LPS) constitutifs de la paroi cellulaire, présents dans toutes les espèces de cyanobactéries. Ils pourraient également être responsables d’effets gastro-intestinaux en cas d’ingestion ainsi que d’irritation et d’inflammation des voies aériennes supérieures (Blais 2002).
Facteurs influençant la production des toxines
La croissance cellulaire
Il semble qu’il y ait une corrélation linéaire entre le taux de division cellulaire et la concentration intracellulaire en microcystine chez M. aeruginosa. Le taux de microcystine serait maximal durant la phase exponentielle de croissance et diminuerait à la fin de celle-ci (Lavoie et al., 2007).
L’intensité lumineuse
Il existe une corrélation positive entre la lumière et la production de toxine. Tant que la lumière n’est pas en excès, elle stimule la croissance et donc la production de toxines jusqu’à un certain niveau d’éclairement. En effet, lorsque la lumière devient en excès cette production diminue. Une augmentation de l’intensité lumineuse peut également induire des changements dans la composition des microcystines. Ainsi il a été démontré que la variante la plus toxique (MC-LR) était produite en plus grande quantité par Planktothrix agardhii sous de fortes intensités lumineuses. Ces résultats pourraient être expliqués par le fait que la lumière contrôle la transcription du gènemcy, responsable de la production de toxines (Lavoie et al., 2007 ; Msagati et al., 2006).
Les nutriments et le fer
Le contenu cellulaire en microcystine serait plus fortement corrélé à la quantité d’azote total que de phosphore total. Une augmentation d’azote entraîne une augmentation de la concentration en microcystine ainsi qu’une augmentation du nombre de cyanobactéries toxiques. Le phosphore aurait donc une influence négligeable sur le contrôle des microcystines par les cellules, cependant les résultats des auteurs divergent, en particulier sur la détermination du ration N/P qui aurait une incidence sur la concentration de microcystines. Pour ce qui est du fer, les auteurs présentent également de résultats contradictoires (Lavoie et al., 200).
Effet du zooplancton
Il a été observé une augmentation de la production de microcystine par Microcystis lors d’une exposition directe au zooplancton (Lavoie et al., 2007).
Température, pH
La température optimale de production de toxines s’étend de 15 à 25 °C, selon les espèces. Par exemple aux températures inférieures à 25 °C, Anabaena sp. produit de la microcystine LR plutôt que de la microcystine RR, qui est préférentiellement produite à des températures supérieures (Lavoie et al., 2007 ; Msagati et al., 2006).
Aspects réglementaires de la qualité des eaux
Eaux de baignade
Au niveau de l’Union européenne, la qualité de l’eau des zones de baignade et sports nautiques est régie par la directive européenne 76/160/CEE adoptée en 1976 et transposée en droit français par le code de la santé publique (livre III, articles L1332). Cette directive ne comporte pas de cadre réglementaire pour la surveillance sanitaire des cyanobactéries ou cyanotoxines. En 2003 des recommandations de surveillance et de gestion de phénomènes de prolifération de cyanobactéries dans des eaux de baignade ont été publiées par la Direction générale de la santé (circulaire DGS/SD7A 2003/270(34), 2004/364(35), 2005/304(36)) sur la base d’un avis du Conseil supérieur d’hygiène publique de France (avis du CSHPF du 6 mai 2003). Cet avis reprend l’avis de l’OMS de 1999 qui prévoit 3 niveaux d’alerte relatifs aux cyanobactéries et les mesure à prendre pour chaque niveau (Tableau ci-dessous). Des précisions ont été apportées dans l’ avis du CSHPF du 6 juillet 2004.
Les gestionnaires de sites, ou le maire concerné, doivent mettre en place un système de surveillance renforcée pour les sites à risque (sensibles à l’eutrophisation, ayant déjà présenté des proliférations de cyanobactéries ou présentant une forte fréquentation) et un système de surveillance visuelle pour les autres sites (circulaire DGS/SD7A 2003/270, 2004/364, 2005/304).
La surveillance renforcée est basée :
- sur une observation visuelle ;
- sur la mesure de la turbidité ou observation au disque de Secchi ou la mesure du pH ;
- le dosage de chlorophylle a est possible mais utilisable que si les cyanobactéries sont majoritaires (confirmation par des observations microscopiques).
Tout changement des caractéristiques du milieu en faveur d’une prolifération doit conduire le gestionnaire du site à effectuer des prélèvements d’eau pour une observation microscopique. Si les cyanobactéries sont absentes ou présentes mais minoritaires, la surveillance renforcée est reconduite. Si les cyanobactéries sont présentes et majoritaires alors le dispositif décrit dans le tableau ci-dessous est déclenché.
| Niveau | Nombre de cyanobactéries et teneur en microcystine LR | Recommandations |
|---|---|---|
| Niveau 1 | Nombre < 20 000 cellules/ml ± 20% | Gestion : informations du public au niveau des zones d’écume ou d’efflorescence. Surveillance : journalière renforcée et réalisation d’un comptage et d’une identification au moins bimensuelle. |
| Nombre compris entre 20 000 et 100 000 cellules/ml ± 20% | Gestion : informations du public au niveau des zones d’écume ou d’efflorescence et des zones d’usages. Surveillance renforcée quotidienne, comptage et identification hebdomadaire. |
|
| Niveau 2 | Nombre de cellules > 100 000 cellules/ml ± 10% et taux de microcystine LR < 25µg/l | Gestion : limitation de la baignade dans les zones les plus concentrées, informations du public. Surveillance : poursuite du suivi hebdomadaire. |
| Nombre de cellules > 100 000 cellules/ml et taux de microcystine LR > 25µg/l | Gestion : interdiction de la baignade et limitation des activités nautiques, informations du public. Surveillance : poursuite du suivi hebdomadaire. |
|
| Niveau 3 | Présence de mousse ou d’écume | Gestion : interdiction de la baignade et de toutes les activités nautiques, prévenir tout contact de personnes ou d’animaux avec les écumes, informations du public. Surveillance : suivi de l’évolution des mousses ou écume et de leur localisation, poursuite du suivi hebdomadaire, suivi des concentrations en toxines au moins bimensuel. |
Eau potable
L’OMS propose une concentration maximale acceptable de 1 µg/l de microcystine LR. Dans un premier temps, cette valeur à été reprise en France dans le décret n°2001-1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine, à l’exclusion des eaux minérales naturelles, qui est la transcription de la directive européenne n°98/83/CE. Il y est indiqué que la recherche de microcystine LR doit être effectuée en cas de prolifération dans les eaux brutes.
Aujourd’hui, dans l’arrêté du 11 janvier 2007 relatif aux limites et références de qualité des eaux brutes et des eaux destinées à la consommation humaine mentionnées aux articles R. 1321-2, R. 1321-3, R. 1321-7 et R. 1321-38 du code de la santé publique, il est mentionné que c’est le « total microcystines », c’est-à-dire la somme de toutes les microcystines détectées et quantifiées, qui doit être inférieur à 1 µg/l pour les eaux destinées à la consommation humaine, à l’exclusion des eaux conditionnées.
Bibliographie
- Afssa/Afsset : Rapport commun sur les risques sanitaires liés à la présence de cyanobactéries dans l’eau. Juillet 2006.
- Avis du Conseil Supérieur d’Hygiène Publique de France du 6 mai 2003 relatif aux recommandations pour la gestion des situations de contamination d’eau de baignades et de zones de loisirs nautiques par prolifération de cyanobactéries.
- Avis du Conseil Supérieur d’Hygiène Publique de France du 6 juillet 2004 relatif aux recommandations pour la gestion des situations de contamination d’eau de baignades et de zones de loisirs nautiques par prolifération de cyanobactéries. Bilan national de la surveillance des proliférations de cyanobactéries lors de la saison balnéaire 2003.
- Blais S. La problématique des cyanobactéries (algues bleu-vert) à la baie Missisquoi en 2001. Agrosol. 2002, 13 (2) : 103-110.
- Chorus and J. Bartram, Toxic cyanobacteria in water. A guide to their public health consequences, monitoring and management, ed. by E&FN Spon on behalf of the World Health Organisation, 1999, pp.1-416.
- Groupe scientifique sur l’eau (2004) Cyanobactéries et cyanotoxines (eau potable et eaux récréatives). Dans : Fiches synthèses sur l’eau potable et la santé humaine, Institut national de santé publique du Québec, 18 p.
- Jaeg JP. Microcystines : intoxication des animaux domestiques et sécurité des aliments d’origine animale. Revue Méd. Vét., 2007,158, 2, 46-58.
- Lavoie, I., I. Laurion, A. Warren et W.F. Vincent,. Les fleurs d’eau de cyanobactéries, revue littéraire. INRS rapport n°916, xiii, 124p. 2007.
- Lefeuvre JL., Brient L., Marion L., Degradation de la qualité des eaux douces et marines : des risques pour la santé et la biodiversité. 2e journée de l’institut français de la biodiversité 2004. Session III, p54-62.
- Msagati TA, Siame BA, Shushu DD. Evaluation of methods for the isolation, detection and quantification of cyanobacterial hepatotoxins. Aquat Toxicol. 2006 Jul 20 ; 78(4) :382-97. Epub 2006 Apr 27.