Plasticité et formation des artères et des veines dans l'oeuf de Poulet
Auteur : Delphine Moyon (INSERM U36, Collège de France)
Table des matières
- Introduction
- Développement des vaisseaux : plasticité ou pré-détermination ?
- Observations in ovo
- Etude expérimentale
- Conclusion
1. Introduction
Le système sanguin des Vertébrés est composé de trois éléments : un liquide (le sang), une pompe (le coeur) qui permet de mettre ce liquide en mouvement, et des conduits (les vaisseaux). On distingue trois types de conduits, les artères, les veines et les capillaires, qui diffèrent aussi bien par leur fonction que par leur structure. Les capillaires, vaisseaux très ramifiés et de très faible diamètre, permettent les échanges entre le sang et les organes irrigués.
| Artères | |
| Fonction | Amènent le sang du coeur vers les organes périphériques.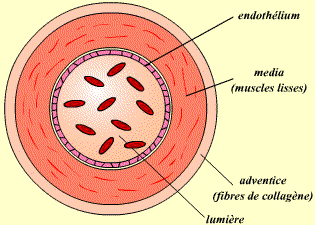 |
| Structure | La majorité des artères possède une paroi vasculaire importante, composée de cellules musculaires, qui leur permettent de conserver la pression sanguine lors du trajet du sang. |
| Veines | |
| Fonction | Ramènent le sang des organes vers le coeur.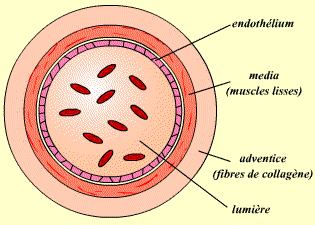 |
| Structure | Les veines présentent une paroi vasculaire plus mince, ce qui leur confère une grande élasticité. |
Artères et veines forment un réseau continu de vaisseaux sanguins, reliées par les capillaires et le coeur. Afin d'améliorer les traitements de certaines pathologies humaines, la question s'est posée de comprende comment se forment les artères et les veines. On peut en particulier se demander ce qui, au cours du développement embryonnaire, distingue ces deux types de vaisseaux sanguins.
Grâce aux techniques de biologie moléculaire, il est maintenant possible d'étudier la formation des artères et des veines aussi bien du point de vue des molécules présentes à la surface des vaisseaux que du point de vue de leur morphologie. En particulier, l'étude des capacités de plasticité du système vasculaire au cours de son développement ont ainsi pu être approfondies.
2. Développement des vaisseaux : plasticité ou pré-détermination ?
Au cours du développement embryonnaire, veines et artères se mettent en place progressivement à partir d'un plexus capillaire (une sorte de maillage de petits vaisseaux). Les vaisseaux sont tous semblables morphologiquement au début, leurs particularités ne sont visibles qu'une fois la circulation du sang bien établie. Il est possible d'étudier les marqueurs de ces vaisseaux : il s'agit de molécules exprimées spécifiquement par l'un ou l'autre type de vaisseau. On remarque que des marqueurs spécifiques des veines ou des artères sont décelables très précocement, avant même que ces vaisseaux diffèrent d'un point de vue morphologique.
| Dans un premier temps une différentiation moléculaire (présence de marqueurs, symbolisés ici par la coloration rouge ou bleue) est réalisée. Dans un deuxième temps, la différentiation morphologique se met en place. |
Le problème se pose donc de savoir quelle est l'importance de ces marqueurs. On peut en effet imaginer deux hypothèses :
- Tous les vaisseaux sont identiques dans un premier temps. Suite aux conditions de milieu (par exemple le flux sanguin qui les traverse), ils s'engagent dans une voie de différentiation de type veineux ou artériel. La première étape de cette voie de différentiation est alors d'exprimer les marqueurs "veines" ou "artères".
- Les vaisseaux sont séparés en deux populations, artérielle et veineuse, dès l'origine.
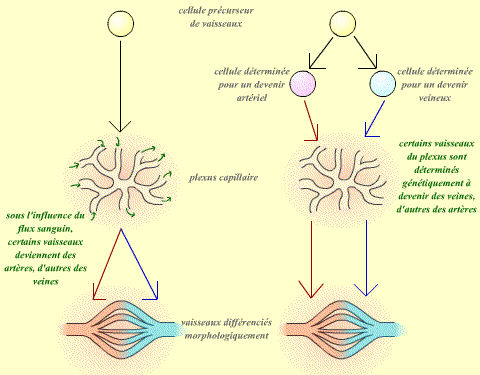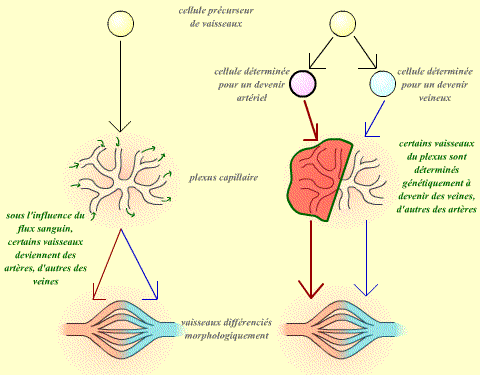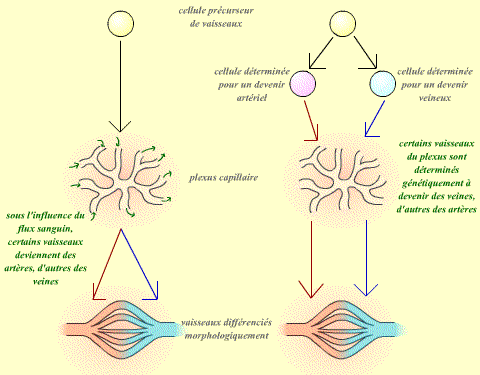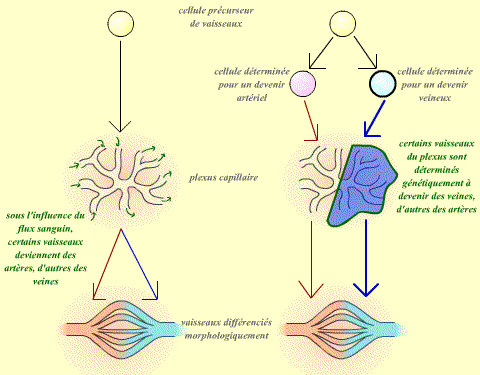 |
| Dans la première hypothèse (à gauche), ce sont les conditions du milieu qui déterminent le devenir des vaisseaux. Dans la deuxième hypothèse (à droite), les vaisseaux sont déterminés dès leur origine dans leur devenir. |
La première hypothèse suppose donc que le devenir des vaisseaux dépend de leur environnement : On peut donc supposer que si l'on modifie cet environnement, on modifiera alors leur spécificité (artère ou veine).
Au contraire, dans le cas de la deuxième hypothèse, on peut supposer que chaque vaisseau suivra exactement la même voie de différentiation, quelque soit son environnement.
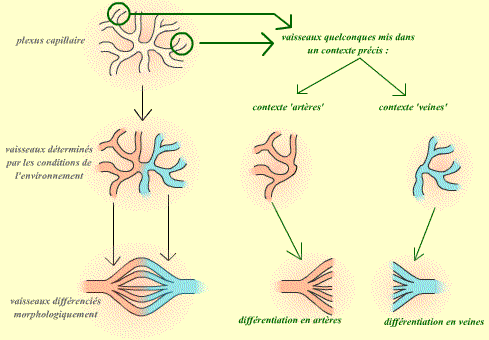 |
| Si la différentiation en artère ou veine dépend du contexte, alors il doit être possible d'influer sur le devenir d'un vaisseau : un vaisseau (quelque soit sa provenance) mis dans un contexte artériel donnant alors une artère, et un vaisseau mis dans un contexte veineux donnant une veine. |
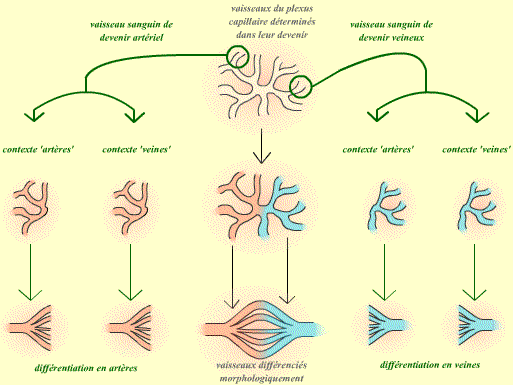 |
| Si la voie de différentiation d'un vaisseau est déterminée indépendemment de son environnement, alors un vaisseau qui aurait donné, à sa place d'origine, une artère donnera toujours une artère, même si on le place dans un contexte veineux. De même, un vaisseau qui aurait donné normalement une veine donnera alors toujours une veine : ces vaisseaux sont déterminés dans leur devenir. |
Les deux hypothèses émises correspondent donc à deux types de développement :
- Plasticité des cellules à l'origine des vaisseaux pour la première hypothèse.
- Pré-détermination (et donc absence de plasticité) pour le deuxième hypothèse.
3. Observations in ovo
Avant de réaliser des expériences permettant de choisir entre ces deux hypothèses, observons comment se mettent en place les artères et les veines.
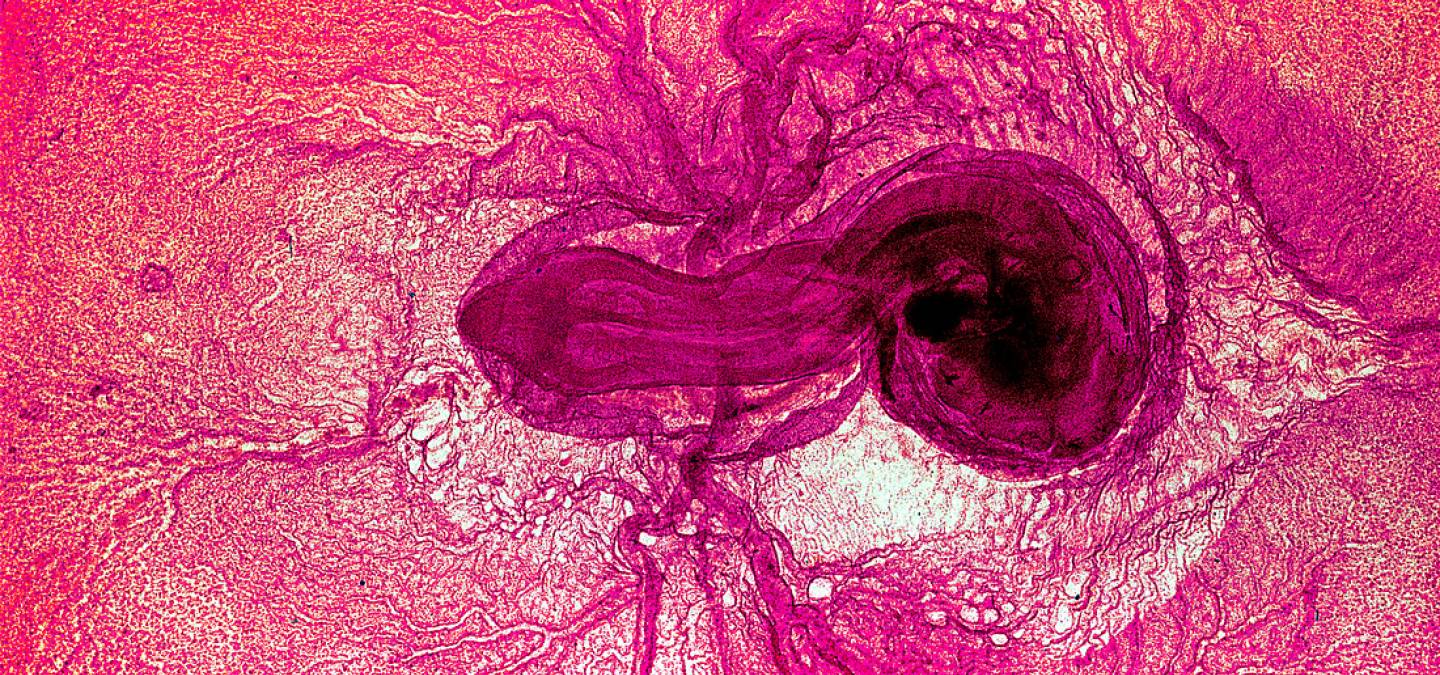
Pour réaliser ces observations (et les expériences par la suite), il est possible d'utiliser un modèle simple d'accès : l'embryon de poulet. En effet, celui-ci possède un réseau vasculaire extra-embryonnaire, qui lui permet de se nourrir à partir du vitellus (le "jaune" de l'oeuf).
L'intérêt de ce modèle est que cette observation est facile (il suffit d'ouvrir la coquille d'un oeuf de poule au bon stade de développement) et que les vaisseaux étant très accessibles, il est possible d'intervenir expérimentalement sur leur environnement. Par contre, le défaut de ce modèle est que le système vasculaire étudié ici est extra-embryonnaire : la différentiation des veines et des artères à l'intérieur du corps de l'embryon n'est donc pas accessible (nous reviendrons en conclusion sur les conséquences de cette nature extra-embryonnaire de ces vaisseaux).
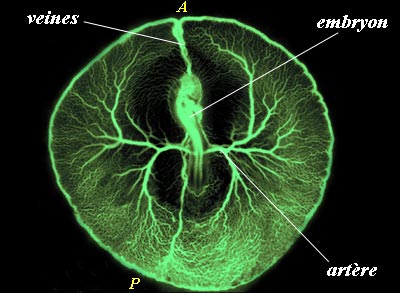
La formation des vaisseaux extra-embryonnaires se réalise en même temps que la circulation sanguine se met en place : à partir d'un ensemble de petits vaisseaux on observe leur fusion en deux gros vaisseaux de part et d'autre de l'embryon, les artères vitellines. Le remodelage du plexus capillaire autour de ces artères permet ensuite la formation des veines vitellines.
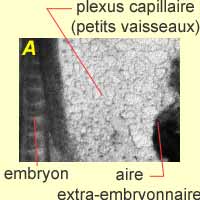 |
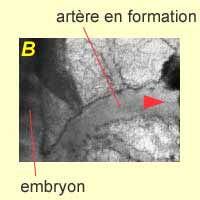 |
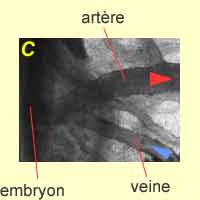 |
| Ces photos présentent trois étapes de processus : A. Plexus capillaire. B. Les artères se forment dans un premier temps. C. Artères et veines formées. | ||
| Les vaisseaux sanguins sont nettement visibles, tout d'abord sous forme d'un plexus capillaire, qui se résout progressivement en quelques vaisseaux de gros diamètre. |
| Les petits vaisseaux ne sont pas visibles ici. La croissance des gros vaisseaux est visible, en même temps que se met en place la circulation sanguine. |
4. Etude expérimentale
Afin de tester nos deux hypothèses, l'expérience suivante a été réalisée : la circulation sanguine a été stoppée dans l'artère vitelline droite. Pour cela, on a utilisé une pince de Stefan. Cet outil permet de soulever l'artère, ce qui entraîne l'obturation du conduit. Toute la partie droite du sac vitellin n'est alors plus irriguée.
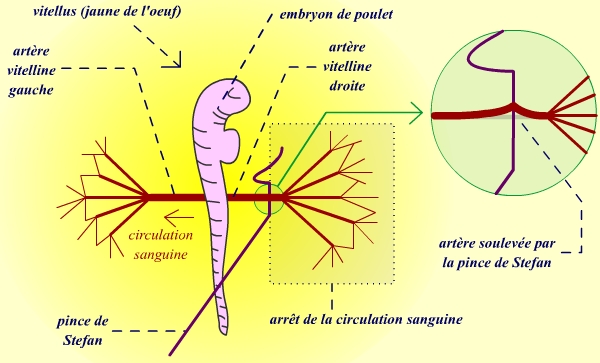 |
| La pince de Stefan permet de bloquer l'afflux sanguin dans les artères, d'un côté de l'embryon. |
Lorsqu'on réalise ces expériences de ligature des veines, on bloque l'afflux sanguin dans une jeune artère de l'aire extra-embryonnaire du poulet, on observe alors sa transformation en une veine, qui fusionne avec les capillaires veineux existants. L'autre côté de l'embryon, qui n'est pas opéré, se développe normalement.
5. Conclusion
L'expérience de ligature des veines grâce à la pince de Stefan montre qu'il existe une réelle plasticité des vaisseaux sanguins, aux stades précoces de leur développement. Toutefois, cette possibilité de changer de devenir disparait, en même temps que leur différentation s'accentue. Le modèle du système circulatoire extra-embryonnaire du poulet permet donc de montrer l'importance des conditions de leur environnement dans la détermination du devenir des vaisseaux conducteurs en cours de différentiation.
Toutefois, des expériences complémentaires montrent que les choses ne sont pas si simples : si les conditions du milieu jouent un rôle important, une certaine part de prédétermination (liée en particulier à l'expression de gènes spécifiques) existe aussi.
Le développement des vaisseaux sanguins du système circulatoire embryonnaire, à l'origine du système circulatoire de l'adulte, semble lui aussi dépendre pour partie d'une prédétermination génétique et pour partie des conditions dans lesquelles se trouvent ces vaisseaux. L'intervention de ces conditions environnementales permet le modelage précis et complexe de l'irrigation sanguine des organes.