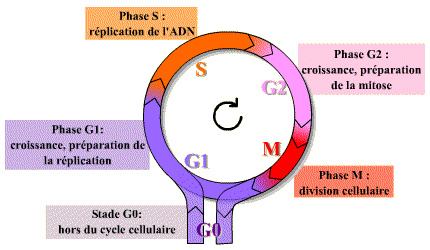
Une cellule eucaryote doit assurer l'ordre immuable des 4 phases du cycle : G1, S, G2, M et l'obtention de deux cellules filles identiques.
Cet article présente, à l'aide d'images et d'animations, les systèmes régulant les 4 phases du cycle cellulaire (essentiellement par des kinases cycline-dépendantes), ainsi que ceux impliqués dans la surveillance de l'ADN, garantissant l'obtention de 2 cellules filles rigoureusement identiques.
L’intérêt majeur de l’étude de la régulation du cycle cellulaire et de ses points de surveillance réside dans le fait que ces processus sont souvent déréglés dans les cancers.
Introduction générale
Les différentes phases et les événements du cycle cellulaire
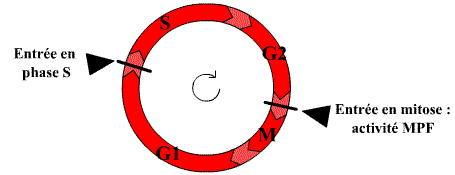
Le cycle cellulaire des cellules des eucaryotes supérieurs comprend quatre phases.
Durant deux de ces phases, phase S et phase M, les cellules exécutent les deux événements fondamentaux du cycle : réplication de l’ADN (phase S, pour synthèse) et partage rigoureusement égal des chromosomes entre les 2 cellules filles (phase M, pour mitose).
Les deux autres phases du cycle, G1 et G2, représentent des intervalles (Gap) : au cours de la phase G1, la cellule effectue sa croissance, intègre les signaux mitogènes ou anti-mitogènes et se prépare pour effectuer correctement la phases S ; au cours de la phase G2, la cellule se prépare pour la phase M.
Dans un cycle, les quatre phases se succèdent dans un ordre immuable : G1, S, G2 et M. Les trois premières phases (G1, S, G2) constituent l’interphase, durant laquelle le noyau de la cellule est limité par une enveloppe nucléaire, alors que la mitose (M) est caractérisée par la disparition de cette enveloppe et par l’apparition des chromosomes. Ces derniers deviennent alors visibles au microscope photonique parce qu’ils se compactent. Après la mitose, les cellules peuvent soit passer en G1, soit entrer en G0, stade quiescent de non division.
Les événements essentiels d’un cycle cellulaire (visibles en microscopie ou faciles à mettre en évidence) sont les suivants :
-
La réplication de l’ADN (c’est-à-dire des chromosomes) et la duplication du centrosome, qui ont lieu au cours de la phase S.
-
La désorganisation de l’enveloppe nucléaire (par phosphorylation des lamines), la compaction des chromosomes (par phosphorylation des condensines et des histones), qui sont des événements qui caractérisent le début de la phase M.
-
L’alignement des chromosomes dupliqués à la métaphase.
-
La séparation des chromatides-sœurs (par dégradation de cohésines) à l’anaphase de la mitose.
-
Et enfin la cytodiérèse, événement qui caractérise la fin de la mitose.
L’ensemble de ces événements aboutit à la formation de deux cellules filles identiques.
La régulation du cycle cellulaire
Pour assurer, d’une part, l’ordre immuable de la succession des quatre phases du cycle (régulation du cycle), et d’autre part, l’obtention de deux cellules filles rigoureusement identiques (surveillance de l’ADN), la cellule dispose de systèmes de régulation hautement perfectionnés. Dans le premier cas, (régulation du cycle), ce sont essentiellement des kinases cycline-dépendantes, les Cdk, qui interviennent. Dans le second cas, d’autres molécules interviennent dans différents mécanismes de surveillance du cycle pour inhiber les Cdk de la régulation du cycle et arrêter le cycle, si l’étape précédente n’est pas terminée, ou si une « réparation » est nécessaire.
La régulation de la succession des quatre phases du cycle cellulaire
Les différentes phases du cycle ont lieu selon l’ordre immuable cité plus haut et c’est pour assurer le maintien de cette séquence qu’interviennent des Cdk assurant la régulation du cycle cellulaire. Il en existe plusieurs ; elles interviennent tout au long du cycle dans un ordre déterminé : en phase G1 et pour la transition G1-S, c’est-à-dire pour le déclenchement de la réplication de l’ADN, en phase S pour la poursuite de la réplication, en phase G2 et pour la transition G2-M, c’est-à-dire pour le déclenchement de la mitose et pour l’exécution de la mitose. Les Cdk agissent soit sur les protéines qui permettent la réalisation des événements du cycle (leur fonction est alors de provoquer les événements du cycle), soit sur la protéine Rb, (leur fonction étant alors de permettre la progression du cycle).
La succession normale des différentes phases ne peut avoir lieu que si les différentes Cdk intervenant au cours des différentes phases sont présentes et actives aux moments opportuns.
Les mécanismes de surveillance du cycle
Les mécanismes de surveillance s’ajoutent à la régulation de la succession des quatre phases du cycle par les Cdk. Ils permettent la surveillance d’aspects fondamentaux comme l’état des molécules d’ADN avant, pendant et après leur réplication (DDCP = DNA Damage Checkpoint), l’achèvement total de la réplication avant l’entrée en mitose (RCP = Replication Checkpoint) et le bon positionnement de tous les chromosomes sur la plaque métaphasique avant la séparation des chromatides-sœurs (MPC = Mitotic Checkpoint).
Les dérèglements du cycle cellulaire conduisent à des proliférations anarchiques. L’intérêt majeur de l’étude de la régulation du cycle cellulaire et de ses points de surveillance réside dans le fait que ces processus sont souvent déréglés dans les cancers. La connaissance de la régulation du cycle cellulaire est donc fondamentale pour la cancérologie et peut servir à mettre au point de nouvelles approches thérapeutiques.
Mise en évidence de l'existence d'un contrôle du cycle cellulaire
Les événements et les différentes phases du cycle cellulaire étaient connus depuis longtemps. La remarquable constance de la succession des différentes phases suggérait un contrôle tout au long du cycle, mais les approches biochimiques directes pour mettre en évidence des molécules impliquées dans la régulation ne donnaient aucun résultat. Ce sont des expériences de biologie cellulaire qui ont permis de déceler la présence des facteurs de régulation présents à certaines phases du cycle.
L'entrée en phase M est sous le contrôle d'un facteur diffusible, le MPF (Maturation Promoting Factor)
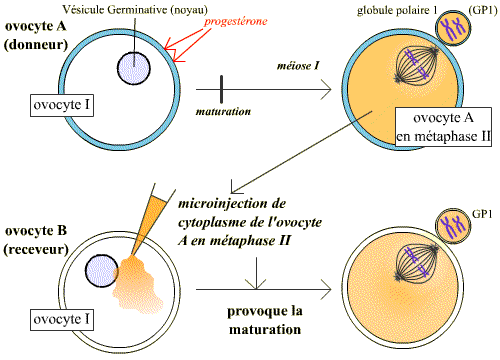
Deux types d’expérience ont été menés entre 1960 et 1970, amenant à la notion de MPF : expériences d’injection dans les ovocytes et expériences de fusions cellulaires.
Expérience de micro-injection de cytoplasme d’un ovocyte II (bloqué en 2e division de méiose, métaphase II) dans un ovocyte I : l’ovocyte I est maturé
L’ovocyte est un système modèle qui a permis l’analyse du déclenchement de la phase M du cycle cellulaire. Chez le Xénope, c’est après une décharge hormonale de progestérone que l’ovocyte I, jusque-là bloqué en début de prophase I de méiose, poursuit la méiose, termine la première division et effectue le début de la deuxième division méiotique jusqu’à la métaphase II, stade auquel il reste à nouveau bloqué ; cette étape s’appelle la maturation.
Lorsque du cytoplasme de cet ovocyte bloqué en métaphase II est prélevé et injecté dans un ovocyte I, il induit la maturation de l’ovocyte receveur.
L'injection du cytoplasme prélevé dans un ovocyte II maturé (bloqué en métaphase II) dans un ovocyte I, induit l'entrée en méiose de ce dernier. Cette expérience montre que le cytoplasme de l'ovocyte A contient un composé, présent en méiose, et suffisant pour induire le passage en méiose.
Cette expérience montre qu’une substance contenue dans le cytoplasme de l’ovocyte bloqué en métaphase II peut induire la maturation. Ce facteur a été appelé MPF (Maturation Promoting Factor). On s’aperçut par la suite que le MPF n’est pas seulement le déclencheur de la méiose ovocytaire, mais qu’il déclenche aussi l’entrée en mitose (phase M) des cellules somatiques. L’abréviation MPF peut donc aussi correspondre à « Mitosis Promoting factor ».
En réalité le cytoplasme injecté contient du MPF « actif » (c’est justement parce que ce MPF est maintenu actif que l’ovocyte est bloqué en métaphase II). La petite quantité de MPF actif injectée suffit pour activer le stock de MPF inactif de la cellule receveuse.
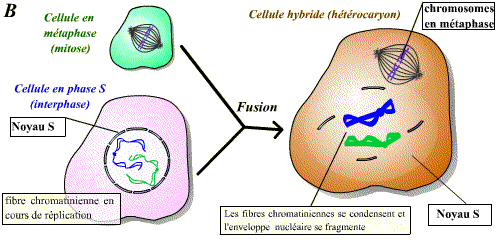
Expériences de fusion de cellules à des stades différents du cycle cellulaire
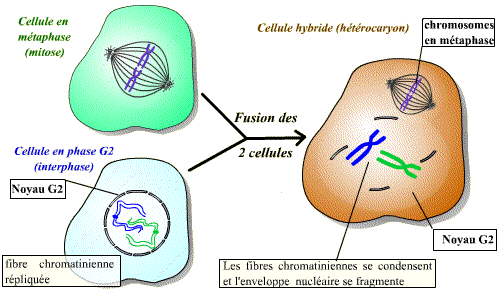
Il est possible de réaliser la fusion de deux cellules qui sont à des stades différents du cycle cellulaire : on obtient alors un hétérocaryon (cellule contenant deux noyaux différents) avec mise en commun des cytoplasmes. Ce modèle expérimental permet de savoir si une cellule donnée contient un facteur de stimulation d’une étape du cycle.
La fusion d’une cellule en mitose et d’une cellule en interphase permet d’observer une condensation des chromosomes issus de la cellule en interphase. Un facteur présent dans la cellule en mitose induit donc visiblement une « entrée en mitose » précoce du noyau de la cellule en interphase. Ce facteur est le MPF.
Un facteur diffusible présent dans la cellule en phase M induit l'entrée en mitose (condensation des chromosomes et disparition de l'enveloppe nucléaire) de la cellule en phase G2. Ce facteur est le MPF.
La fusion de toute cellule en interphase (même en phase G1 ou S) et d'une cellule en phase M induit la condensation des chromosomes et la disparition de l'enveloppe nucléaire.
La fusion de toute cellule en interphase (même en phase G1 ou S) et d'une cellule en phase M induit la condensation des chromosomes et la disparition de l'enveloppe nucléaire.
Conclusions
Ces expériences montrent que l’entrée en mitose (ou en méiose) est contrôlée par un facteur cytoplasmique diffusible, le MPF.
Mis en évidence en 1971, le MPF ne sera identifié et caractérisé précisément qu’en 1988. C’est un complexe formé de deux protéines :
-
une sous-unité catalytique, protéine kinase, qui est une enzyme phosphorylant des protéines cibles, et qui n’est active qu’en présence d’une cycline, d’où son nom, protéine kinase-cycline dépendante (Cdk).
-
une sous-unité régulatrice appartenant à la famille des cyclines.
Ce complexe cycline / Cdk agit en déclenchant différentes réactions. Il permet, entre autres, de provoquer la condensation des chromosomes, la fragmentation de l’enveloppe nucléaire et la formation du fuseau mitotique.
Les kinases cycline-dépendantes et autres protéines impliquées dans la régulation du cycle cellulaire des cellules de mammifères ont été identifiées grâce aux études effectuées sur la levure (Saccharomyces cerevisiae et Schizosaccharomyces pombe) par une recherche systématique des mutations dans les gènes codant pour des molécules intervenant dans le cycle cellulaire, cdc (cell division cycle). Des souches de mutants cdc thermosensibles ont été utilisées. Pour ces souches, les protéines mutantes sont fonctionnelles à température normale mais pas à température élevée.
Toutes les protéines identifiées chez la levure sont des protéines qui ont été conservées au cours de l'évolution et elles existent également chez les mammifères. C'est donc grâce aux études menées sur la levure que la compréhension de la régulation cellulaire a pu progresser.
Les études sur la levure ne seront pas du tout abordées dans ce document.
L'entrée en phase S (réplication de l'ADN) est aussi sous le contrôle d'un facteur diffusible
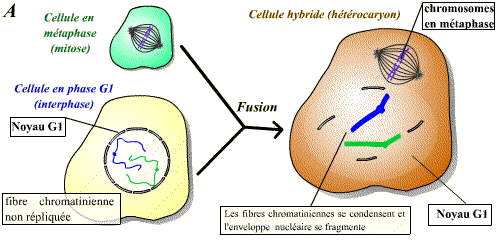
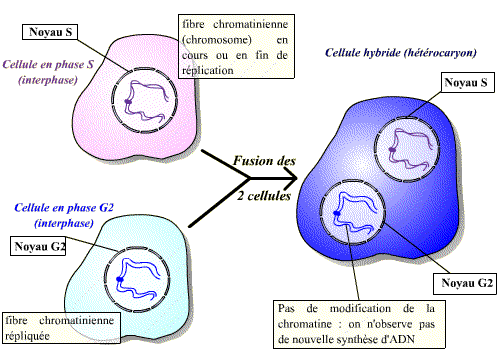
De même que précédemment, on peut réaliser la fusion d’une cellule en phase S avec une cellule en phase G1 ou G2. Les résultats ne sont pas les mêmes dans ces deux cas de figure. Si la cellule est en G1, on observe, après fusion, une réplication prématurée des fibres chromatiniennes de G1 (Fig.A). Si la cellule est en G2 par contre, il n’y aura pas de nouvelle réplication (Fig.B).
Un facteur contenu dans le cytoplasme de la cellule en phase S agit sur les fibres chromatiniennes de la cellule en G1 pour induire la synthèse d'ADN.
Il existe donc, dans le cytoplasme des cellules en phase S, un facteur de stimulation d'entrée en phase S.
Le facteur contenu dans le cytoplasme de la cellule en phase S n'agit pas sur les fibres chromatiniennes déjà répliquées : ce facteur n'est pas actif sur des cellules ayant déjà répliqué leur ADN.
Il existe donc un mécanisme qui bloque toute nouvelle réplication tant que la mitose n'a pas eu lieu.
Un facteur présent en phase S permet l’entrée en phase S des cellules n’ayant pas encore répliqué leur ADN (cellules en phase G1). Ce facteur est, par contre, sans effet sur les cellules ayant déjà réalisé la phase S (cellules en phase G2).
NB : le noyau S n’entrera en mitose que lorsque la réplication sera terminée (cf contrôle de l’entrée en M)
Ce facteur correspond en fait à un complexe protéique, qui est de même nature que le MPF, c’est-à-dire formé d’une Cdk associée à une cycline.
Conclusion : deux transitions importantes dans le cycle cellulaire
Ces expériences permettent donc de mettre en évidence que deux transitions importantes dans le cycle cellulaire, l’entrée en mitose et l’entrée en phase S, sont sous la dépendance de facteurs de régulation.
La caractérisation précise des molécules impliquées a permis de démontrer que dans ces deux cas (ainsi que dans les autres transitions de phases), on retrouve des complexes moléculaires semblables, constitués :
- d’une cycline, protéine sans activité enzymatique, et dont la présence, indispensable à l’activité du complexe, varie au cours du cycle
- d’une kinase, active lorsqu’elle est associée à une cycline : c’est-à-dire une Cdk (Cyclin Dependent Kinase : kinase dépendante d’une cycline).
Comprendre comment le cycle cellulaire est régulé nécessite donc de comprendre ce que sont ces Cdk et de comprendre leur mode de fonctionnement.
La régulation de la succession des quatre phases du cycle par les complexes Cyclines - Cdk
Définition et mode d'action des Kinases cycline-dépendantes (Cdk)
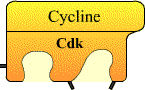
Entre 1987 et 1990, le régulateur universel de l’entrée en mitose (le MPF) est caractérisé : c’est une kinase cycline-dépendante (Cdk) associée à une cycline. Entre 1990 et 2000, une douzaine de Cycline / Cdk sont décrites chez l’homme. Six d’entre elles interviennent dans le contrôle direct du déroulement du cycle cellulaire. Les Cdk forment des complexes hétérodimériques avec les cyclines, leurs sous unités régulatrices.
La première Cdk mise en évidence fut la Cdk1 qui, associée à la cycline B, constitue le MPF : Cycline B / Cdk1 = MPF
Les Cdk ne deviennent fonctionnelles que lorsqu’elles sont associées à une cycline.
Les cyclines ne sont pas présentes pendant tout le cycle, elles apparaissent puis disparaissent brusquement à des moments précis du cycle, de façon périodique. Les Cdk peuvent donc être sous forme activée ou désactivée, selon qu’elles sont associées ou non à leur cycline. Mais nous verrons que d’autres activateurs ou inhibiteurs des Cdk interviennent.
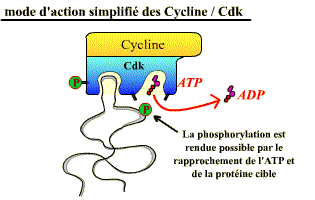
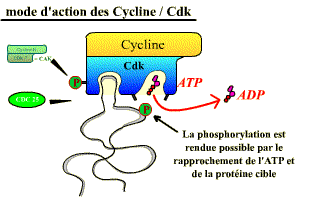
Les Cdk sont des sérine-thréonine kinases, enzymes qui catalysent la phosphorylation de protéines cibles (= substrats) jouant un rôle dans les événements du cycle cellulaire (fragmentation de l’enveloppe nucléaire, compaction des chromosomes, réplication de l’ADN…), ou dans l’avancement du cycle. Leur activité consiste à transférer le groupement γ-phosphate de l’ATP sur une sérine ou une thréonine, présente dans les protéines cibles, à condition que cet acide aminé soit dans une séquence d’acides aminés caractéristique (séquence consensus) spécifiquement reconnue par la kinase (exemple : Ser/Thr-Pro-X-Arg/Lys).
De cette phosphorylation, il résulte un changement de conformation des protéines cibles, ce qui entraîne des propriétés nouvelles pour ces dernières (activation, inhibition, changement de partenaire d’interaction…).
Les cyclines n’ont pas d’activité enzymatique, ce sont des protéines régulatrices nécessaires aux Cdk pour qu’elles soient enzymatiquement actives.
Différents complexes Cycline / Cdk interviennent à des moments précis du cycle cellulaire
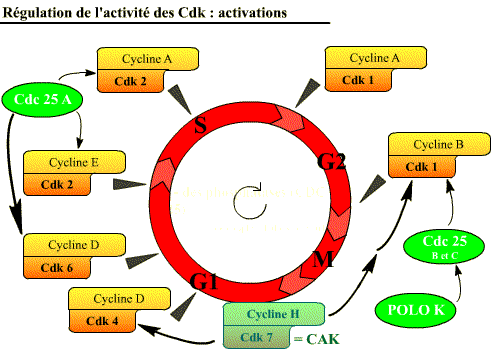
Le cycle cellulaire est contrôlé par au moins 6 complexes Cycline / Cdk différents qui interviennent à des moments précis du cycle cellulaire. (Chaque Cdk agit sur des substrats définis).
Au cours du cycle cellulaire, six complexes Cycline / Cdk interviennent.
Actions des différents complexes Cycline / Cdk au cours du cycle cellulaire
Les complexes Cycline / Cdk assurent le bon déroulement du cycle cellulaire, permettant le passage d’une phase à l’autre du cycle et la réalisation des événements du cycle, par le biais de l’activité kinase des Cdk :
| Moment du cycle | Complexe Cycline / Cdk | Effets du complexe |
| G1 |
Cycline D / Cdk4 |
|
| G1/S | Cycline E / Cdk 2 |
|
| S | Cycline A / Cdk 2 |
|
| G2/M | Cycline B / Cdk 1 |
|
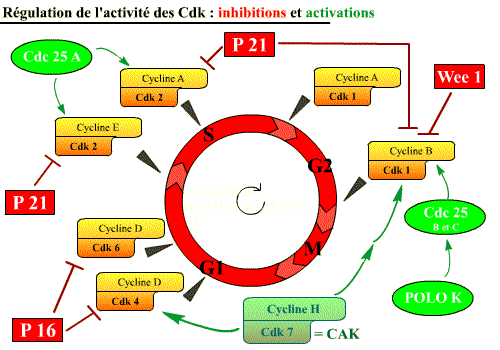
Comme l’illustre ce tableau, l’activité de chacune des Cdk n’est pas constante au cours du cycle cellulaire : les Cdk peuvent donc être activées ou inhibées.
L'activité des Cdk est régulée
Les Cdk sont présentes avant qu’elles ne soient requises. Comment leur activité enzymatique apparaît-elle et disparaît-elle aux moments opportuns ?
-
C’est, premièrement, grâce aux cyclines, qui n’ont pas d’activité enzymatique par elles-mêmes, mais se lient aux kinases du cycle pour les rendre actives. L’activité des Cdk est donc contrôlée par un cycle de synthèse/dégradation de leur cycline associée, tout au long du cycle cellulaire.
-
C’est, deuxièmement, grâce à des protéines déphosphorylant (Cdc 25) ou phosphorylant (CAK, Wee-1) les Cdk et qui permettent de compléter le contrôle de l’activité des Cdk. Nous verrons qu’une phosphorylation peut être activatrice ou inhibitrice.
-
C’est, troisièmement, grâce à des protéines inhibitrices, les CKI (Cdk Inhibitor), qui ne régulent que négativement.
Les Cdk sont activées, par :
-
des phosphatases : Cdc 25 [Déphosphorylations « activatrices »] ;
-
des kinases : CAK (« Cdk Activating Kinase » = Cycline H / Cdk 7), (Polo K, indirect), [Phosphorylations « activatrices »].
En plus de leur activation par association avec les cyclines, les Cdk peuvent être activées par diverses protéines : des phosphatases (Cdc 25 ; déphosphorylations activatrices) et des kinases (Cycline H / Cdk, et Polo K ; phosphorylations activatrices).
Les Cdk sont inhibées par :
- des protéines inhibitrices (inhibiteurs physiologiques), les CKI (Cdk Inhibitor) : p16, p21, p27, qui agissent sur les complexes Cycline / Cdk ;
- une kinase : Wee 1 [responsable de Phosphorylations "inhibitrices"] qui agit sur la Cdk1 en phosphorylant les sites tyrosine 15 et thréonine 14.
Les Cdk peuvent être inhibées par diverses protéines : des protéines inhibitrices, les CKI (p16 et p21) et des kinases (Wee 1 ; phosphorylations inhibitrices).
Structure tridimensionnelle et activation des Cdk : comment les sites de reconnaissance de la protéine cible et de l'ATP s'ouvrent et se ferment
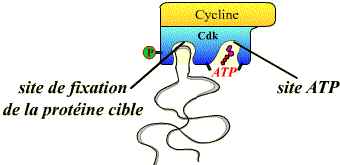
Toutes les Cdk présentent une structure tridimensionnelle similaire, caractérisée par l’existence de deux poches de fixation :
-
l’une pour la protéine cible (différents substrats spécifiques des complexes Cycline / Cdk) ;
-
l’autre pour l’ATP.
D’autre part des acides aminés jouent un rôle particulier suivant qu’ils sont phosphorylés ou non. Pour la Cdk1, il s’agit des acides aminés thréonine 161, thréonine 14 et tyrosine 15.
Pour pouvoir agir, les Cdk doivent présenter une conformation où ces deux poches sont accessibles. Les activateurs (Cyclines, Cdc 25, CAK) et les inhibiteurs (p16, p21, kinase Wee 1) induisent des changements de conformation des sites pour le substrat et pour l'ATP.
Changement de conformation induit par la liaison de la cycline
Avant la liaison de la Cdk à la Cycline, le site catalytique de la Cdk est inaccessible pour l’ATP : les boucles PSTAIRE (noms des acides aminés) et T-loop ferment l’entrée du site. Sans cycline la Cdk est inactive.
La liaison de la cycline provoque :
-
Un léger déplacement de la boucle T, domaine qui bloque l’accès du substrat dans la Cdk monomérique, ce qui a pour effet de rendre accessibles la thréonine 161, d'une part, et les thréonine 14 et tyrosine 15, d’autre part, aux molécules régulatrices.
-
Un changement de conformation à l’intérieur du site de liaison de l’ATP dû à une rotation du domaine PSTAIRE qui provoquera l’alignement des 3 phosphates de l’ATP quand celui-ci se mettra en place, alignement nécessaire pour le transfert du phosphate sur la protéine cible.
Changement de conformation induit par la CAK
La CAK phosphoryle la Thréonine 161 qui se situe au sommet de la boucle T et qui est devenue accessible après la liaison de la cycline à la Cdk. Ceci a pour effet un changement de conformation qui dégage l’entrée du site substrat et permet la fixation du substrat sur la Cdk. La phosphorylation de la Cdk par la CAK est donc « activatrice ».
Changement de conformation induit par Wee 1 puis par Cdc 25
Wee1 phosphoryle la Cdk sur la Thréonine 14 et la Tyrosine 15. Ces phosphorylations provoquent une répulsion électrostatique qui interdit l’entrée de l’ATP dans son site, elles sont donc inhibitrices. Dans ce cas, même si la Cdk est phosphorylée sur Th 161 par la CAK (elle accepte alors le substrat), elle reste inactive car l’ATP ne peut pas prendre sa place. C’est la raison pour laquelle les phosphorylations inhibitrices dominent la phosphorylation activatrice. Cdc 25, en déphosphorylant Thréonine 14 et Tyrosine Y15, permet à l’ATP d’entrer dans son site, ce qui correspond à l’activation de la Cycline B/ Cdk1.
Changement induit par les CKi
Quand la p21 se lie à la cycline, elle bloque la poche de l'ATP. La p16 se lie à la Cdk et empêche la fixation de la Cycline.
Conclusion
En bref, on peut retenir trois mécanismes fondamentaux qui interviennent dans la régulation de l’activité des Cdk :
-
Les cyclines se lient aux kinases du cycle pour les rendre potentiellement actives.
-
L’activité des complexes Cycline / Cdk peut être inhibée par la phosphorylation de 2 acides aminés (tyrosine 15 et thréonine 14) : la phosphorylation de ces acides aminés se fait par les kinases Wee-1 et Myt 1. Au contraire, la phosphatase Cdc-25 les déphosphoryle et ainsi active les complexes ; la phosphorylation d’un autre acide aminé (thréonine 161) par la CAK est nécessaire pour l’activation des complexes (liaison du substrat).
-
L’activité des complexes peut être inhibée à tout moment par des protéines inhibitrices, les CKI (importantes dans le contrôle de G1 et S).
Mécanismes de surveillance contrôlant les transitions G1/S, G2/M et Métaphase/Anaphase
L'existence de mécanismes de surveillance
En plus des Cdk, molécules permettant le passage d’une phase à l’autre et l’enchaînement des événements du cycle, existent des mécanismes capables de surveiller des processus très importants du cycle, de détecter des anomalies et d’imposer l’arrêt du cycle si des anomalies sont constatées. Ces mécanismes interviennent lorsque des lésions (DDCP = DNA Damage Checkpoint) ou des anomalies de réplication de l’ADN (RCP = Réplication Checkpoint) sont détectées, ou pour contrôler que les chromatides-sœurs vont bien se répartir équitablement dans les deux cellules filles (MCP = Mitotic Checkpoint). Ils assurent en quelque sorte le « contrôle qualité » du cycle cellulaire.
En effet, si seules les Cdk intervenaient, l'enchaînement des phases du cycle pourrait continuer à avoir lieu, même si l’ADN était endommagé, ce qui conduirait finalement à des anomalies génétiques ou chromosomiques graves pour les cellules, par exemple perte d'un chromosome ou d'un morceau d'ADN.
DDCP et transition G1/S
RCP et transition G2/M
MCP et transition métaphase-anaphase
Les mécanismes mis en jeu sont très élaborés et concourent au même but : veiller à ce que les 2 cellules-filles héritent exactement du même génome à la fin du cycle.
En effet, cette surveillance assure le maintien de l’intégrité de l’ADN et la qualité de la réplication de l’ADN. Si l’ADN présente des lésions ou si la réplication ne s’effectue pas correctement, le cycle est arrêté pour donner à la cellule le temps de réparer et de terminer correctement la réplication. Un autre aspect du contrôle veille à ce que le partage des chromosomes entre les 2 cellules-filles s’effectue de façon parfaitement équitable au cours de la transition métaphase – anaphase : si tous les chromosomes ne sont pas correctement attachés aux fibres kinétochoriennes, l’anaphase ne débute pas, les deux chromatides-sœurs de chaque chromosome restent liées l’une à l’autre. Dans tous les cas, si les anomalies sont trop importantes ou si les mécanismes de réparation échouent, un programme de mort cellulaire par apoptose est mis en place.
La surveillance de l’intégrité de l’ADN (DDPC) n’est pas réalisée en un point particulier du cycle mais s’effectue en réalité tout au long de l’interphase (G1, S, G2). Ainsi, lorsqu’une lésion de l’ADN existe, le cycle peut être arrêté soit en G1, (la cellule n’effectue alors pas la transition G1/S), soit en S, soit en G2 (la cellule ne rentre alors pas en mitose). La transition G1/S ne pourra donc avoir lieu que si l’ADN est en bon état.
La surveillance de l’accomplissement de la réplication (RCP) ne se fait pas en un point précis du cycle mais s’étale tout au long de la phase S et de la phase G2. Ainsi, la cellule ne pourra pas commencer la mitose tant que la réplication n’est pas correctement terminée et lorsqu’un défaut de réplication est détecté, la cellule arrête le cycle. La transition G2/M ne pourra donc se faire que si la réplication est correctement terminée et si l’ADN n’est pas lésé.
La surveillance de l’attachement correct des chromosomes métaphasiques au fuseau, ou checkpoint mitotique (MCP), ne s’exerce que dans le court laps de temps de la métaphase et jusqu’à ce que le dernier chromosome ait atteint la plaque métaphasique. La transition métaphase-anaphase ne peut avoir lieu que si tous les chromosomes sont alignés en plaque métaphasique.
Des molécules nouvelles interviennent
Les mécanismes de surveillance font intervenir des molécules nouvelles, différentes des Cycline / Cdk (qui assurent la progression du cycle cellulaire) et différentes des molécules qui interviennent directement dans les événements du cycle.
Parmi ces molécules se trouvent des kinases qui se lient à l’ADN, (DNA-PK) : kinase ATM (ataxia-telangiectasia mutée), kinase ATR (ataxia-telangiectasia Related), ainsi que les protéines sérine-thréonine kinases Chk1 et Chk2 (check-point protein kinase). La protéine Mad2 (Mitotic arrest deficient-2) intervient au point de surveillance métaphase – anaphase.
Chez les patients atteints d’ataxia-telangiectasia mutated, la kinase ATM est mutée et les points de contrôle du cycle sont déficients : les cellules continuent à proliférer malgré la présence de coupures dans l’ADN; elles ne s’arrêtent pas en G1, S ou en G2 pour réparer l’ADN. Ces patients sont hypersensibles aux radiations ionisantes, et présentent donc un risque accru de développer un cancer.
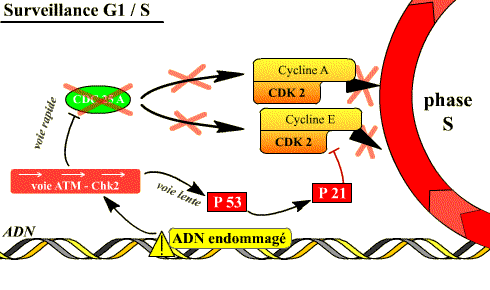
Blocage de la transition G1-S
Si l’ADN est endommagé, la transition G1-S est bloquée par les mécanismes de surveillance de l’état de l’ADN (DDCP). Ces mécanismes aboutissent d’une part à la dégradation de Cdc25A, ce qui arrête le cycle puisque les complexes Cycline D / Cdk4 et Cyclines E, A / Cdk2 ne peuvent plus être activés par Cdc 25A, d’autre part à l’accumulation dans la cellule de p53 qui induit l’expression de p21, inhibiteur des complexes Cyclines E, A / Cdk2. La p53 induit également la transcription d’enzymes de réparation de l’ADN.
Si l'ADN est lésé, l'activation de deux voies inhibitrices des complexes Cycline / Cdk de la phase S permet d'arrêter le déroulement de la phase S.
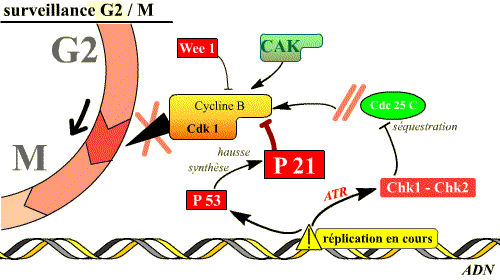
Blocage de la transition G2/M
Dans ce cas, il s’agit pour la cellule de faire en sorte que la mitose ne soit pas déclenchée tant que la réplication n’est pas totalement achevée ou tant que les lésions détectées dans l’ADN qui s’est répliqué ne sont pas réparées. Pour cela, les molécules qui interviennent vont bloquer le processus d'activation de la Cdk1.
Deux types de réponses existent :
-
La phosphorylation de Cdc25C entraîne sa séquestration dans le cytoplasme, loin de son substrat nucléaire Cdk1.
-
Le maintien de l’arrêt en G2 fait intervenir également la p53, facteur de transcription de la p21 et d’enzymes de réparation de l’ADN. La p21 bloque l’activité de cycline B / Cdk1.
Ainsi, le complexe Cycline B / Cdk 1 garde ses phosphorylations inhibitrices, ou bien est bloqué par la p21, tant que la réplication n’est pas achevée : aucune mitose ne débute avant la fin de la réplication.
Si l'ADN est lésé, ou si la réplication n'est pas achevée, l'activation de plusieurs voies inhibitrices du complexe Cdk 1 / Cycline B permet d'empêcher l'entrée en mitose. Deux de ces voies sont illustrées ici.
Point de surveillance de l'attachement correct des chromosomes au fuseau : transition métaphase / anaphase
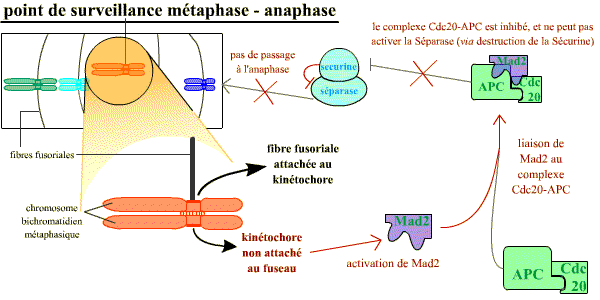
L’attachement correct des chromosomes au fuseau mitotique en plaque métaphasique est indispensable au déclenchement de l’anaphase. Le contrôle de cet attachement représente un point de surveillance important, au cours de la mitose.
Un mécanisme opère pour s’assurer que tous les chromosomes sont correctement attachés au fuseau avant que la séparation des chromatides-sœurs n’ait lieu. Les chromosomes non attachés au fuseau bloquent la séparation de toutes les chromatides-sœurs
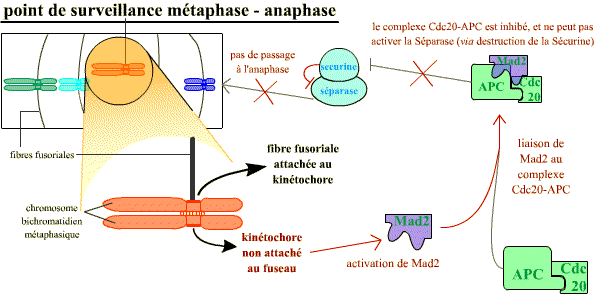
Normalement, à l’anaphase, les chromatides-sœurs se séparent lorsque la séparase (une protéase) détruit par protéolyse spécifique la cohésine qui les maintient rassemblées. Or, tant que les chromosomes métaphasiques ne sont pas correctement attachés au fuseau par leurs kinétochores (et, il suffit qu’un seul ne le soit pas), la séparase est inhibée par la sécurine. La destruction de la sécurine est sous la dépendance de l’APC-Cdc20 (APC = Anaphase Promoting Complex, ubiquitine ligase active lorsqu’elle est associée à la protéine Cdc20) qui reste inhibée par la protéine Mad2 tant que les chromosomes ne sont pas tous correctement attachés.
Chaque kinétochore non correctement attaché au fuseau envoie un signal inhibiteur bloquant l’activation de APC-Cdc20. Ce signal généré par le kinétochore non attaché correspond à la protéine Mad2 : un seul kinétochore mal attaché a pour conséquence la liaison de Mad2 sur le complexe APC-Cdc20, et ainsi son inhibition. Une fois que tous les kinétochores sont attachés, Mad2 n’est plus activée et ne peut plus inhiber le complexe APC-Cdc20 qui devient actif, ce qui permet la destruction de la sécurine et la séparation des chromatides pour leur ascension polaire opposée.
Le point de contrôle de l'attachement correct au fuseau : tant qu'il reste au moins un kinétochore non associé au fuseau, celui-ci émet un signal négatif, grâce à Mad2, qui aboutit à maintenir l'inhibition de la sécurine sur la séparase.
Sans séparase active, la transition vers l'anaphase ne se réalise pas (voir le chapitre 7 de cet article)).
Conclusion
- Le passage en phase S est retardé quand l'ADN est lésé.
- La réplication est suspendue quand l’ADN est endommagé.
- L’entrée en mitose est suspendue quand la réplication n’est pas terminée ou si l'ADN est lésé.
- La séparation des chromatides en mitose est retardée si un seul chromosome n'est pas correctement attaché au fuseau.
Le passage de G2 en M, c'est à dire le déclenchement de la mitose (l'entrée en mitose)
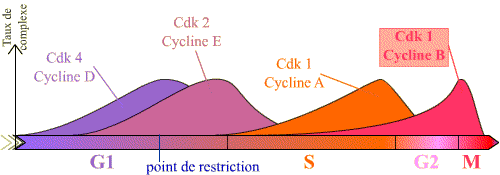
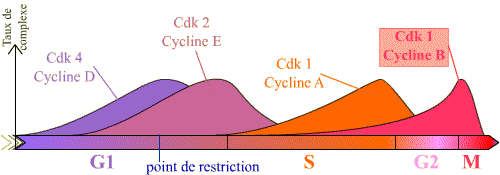
L'entrée en mitose, ou transition G2 / M, est sous le contrôle du complexe Cycline B / Cdk1, et se réalise de manière brutale. Or, on peut constater que la Cycline B est synthétisée pendant une longue période du cycle, et que le complexe Cycline B / Cdk1 se forme progressivement au cours des phases S et G2 (les courbes présentées montrent que pour les autres complexes, il existe de la même façon une accumulation progressive, en particulier pour la Cycline E / Cdk2 ).
Le graphique présente la succession des complexes, et leur taux, en fonction des phases du cycle. Seuls les principaux complexes sont représentés.
Comment alors expliquer que l’activité du complexe Cycline B / Cdk1 débute brusquement, au moment de l’entrée en mitose ?
L’ensemble du processus peut être décomposé en trois temps :
- Formation d'un stock de Cycline B / Cdk1 inactif (pré-MPF).
- Activation de ces complexes.
- Action de ces complexes.
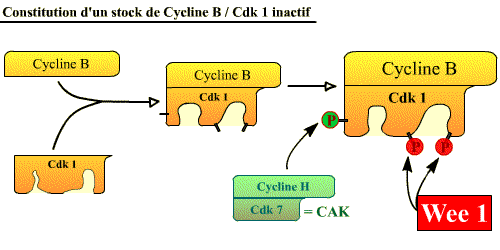
Constitution d'un stock de Cycline B / Cdk 1 inactif (Pré-MPF)
La Cycline B s'accumule progressivement pendant les phases S et G2, ce qui conduit à une accumulation graduelle du complexe au fur et à mesure que la cellule approche de la mitose. La Cdk1 est alors phosphorylée sur la thréonine 161 par la CAK (Cycline H / Cdk7), mais reste inactive à cause de la phosphorylation de 2 acides aminés voisins (tyrosine 15 et thréonine 14) par la protéine Wee-1. Ainsi, quand la cellule atteint la fin de la phase G2, elle contient un abondant stock de Cycline B / Cdk1 ( stock de pré-MPF inactif) prêt à agir mais dont l’activité est réprimée par la présence de 2 groupes phosphate qui bloquent la kinase. Pré-MPF = Cycline B / Cdk1 Tr 161p, Tr 14p, Ty 15p
La cycline B est synthétisée en permanence mais dégradée (APC-PR) de M à S.
Cdk1 s'associe à la cycline B, et est phosphorylée par CAK et Wee1.
Activation brutale des complexes Cycline B / Cdk1
L'activation du stock de Cycline B / Cdk1 est le résultat d'une série de réactions interdépendantes :
Lorsque la réplication est terminée, la phosphatase Cdc25 n'est plus séquestrée dans le cytoplasme et passe dans le noyau, et en fin de phase G2, la phosphatase Cdc 25 est activée, probablement par phosphorylation par la kinase Polo. Cdc 25 a alors pour action d'enlever les deux phosphates inhibiteurs de Cycline B / Cdk 1. Ceci permet l'activation d'une petite partie du stock de Cycline B / Cdk1.
Cdk 1 peut alors phosphoryler Cdc 25 (sur un site différent de celui de la kinase Polo). Cette phosphorylation active Cdc 25 : Cycline B / Cdk 1 active donc son propre activateur (processus d'auto-activation). Dans le même temps, Cycline B / Cdk 1 phosphoryle Wee 1, inhibant cette protéine : Cycline B / Cdk1 inhibe donc son propre inhibiteur.
Ce double mécanisme de rétrocontrôle positif permet d'obtenir rapidement et de façon irréversible une grande quantité de complexes Cycline B / Cdk1 actifs (feed-back positif).
Selon ce mécanisme, une activation partielle de Cdc 25 par la kinase Polo permet l’activation d’une sous population de complexes Cycline B / Cdk 1 qui, par la suite, phosphoryle plus de Cdc-25 et de Wee-1. Ceci permet plus de déphosphorylation de cycline B / Cdk1 et aboutit à une très rapide activation de tous les complexes Cycline B / Cdk 1 dans la cellule.
Mode d'action des complexes activés
Les complexes Cycline B / Cdk 1, une fois activés, permettent l'entrée en mitose. Pour cela, ils interviennent en déclenchant un certain nombre de phénomènes qui prennent place au début de la mitose, c'est-à-dire en prophase.
Les effets sur le cycle de l’activité de chaque complexe (ici Cycline B / Cdk1) dépendent donc des protéines cibles que chaque complexe phosphoryle.
Protéines cibles de Cycline B / Cdk1
Au début de la mitose, les complexes Cycline B / Cdk1 activés agissent en phosphorylant diverses protéines cibles. Parmi ces nombreuses protéines, on trouve :
-
Les condensines, les histones H1 et H3, impliquées dans la condensation des chromosomes.
-
Les lamines, qui permettent la désorganisation de l’enveloppe nucléaire.
-
Des protéines associées aux microtubules (MAPs), qui permettent l’assemblage du fuseau mitotique.
-
L’APC (Anaphase Promoting Complex) dont l’activité est nécessaire à l’ubiquitinylation de la sécurine et de la cycline B (ce qui permet la sortie de la mitose).
Conséquences de l'activité des complexes Cycline B / Cdk1
Globalement, l’activité kinase de ce complexe permet de provoquer de très nombreux évènements de la mitose :
-
La condensation des chromosomes.
-
La désorganisation de l’enveloppe nucléaire.
-
Le réarrangement du cytosquelette de tubuline et l’assemblage du fuseau mitotique.
-
L’attachement des chromosomes répliqués au fuseau.
-
Le réarrangement de l’actine.
-
La réorganisation du Golgi et du reticulum endoplasmique.
-
La dégradation de la Sécurine et de la Cycline B par APC – Cdc 20 (ce qui permet la sortie de la mitose).
Exemple : désorganisation de l’enveloppe nucléaire
La phosphorylation des lamines (filaments intermédiaires du noyau) par la Cycline B / Cdk 1, au début de la mitose, provoque leur dépolymérisation. Or ces lamines étaient associées à l’enveloppe nucléaire et permettaient de la structurer. En conséquence, leur dépolymérisation a pour effet de désorganiser l’enveloppe nucléaire qui se disperse en petites vésicules. Certaines lamines (les lamines B) restent ancrées dans les vésicules d’enveloppe nucléaire, car elles sont isoprénylées (ancre lipidique). Les lamines ont des séquences de liaison aux chromosomes, ce qui facilite la reformation de l’enveloppe nucléaire autour de ceux-ci en fin de mitose. Le processus inverse a lieu à la télophase, en fin de mitose, lorsque les lamines seront déphosphorylées.
L’activation du complexe Cdk 1 / Cycline B, nécessaire pour que l’entrée en mitose se réalise, permet à la cellule de contrôler ce moment clé de son cycle cellulaire.
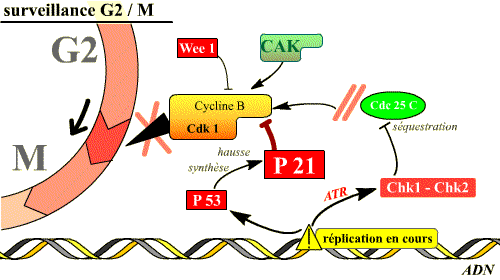
Le point de surveillance G2/M
L’activation massive et irréversible du complexe Cycline B / Cdk1 permet l’entrée en mitose. Avant que cette activation ne s’établisse, un mécanisme de surveillance du cycle cellulaire existe. C’est le point de surveillance G2/M. Il peut être activé par divers signaux (cassures des brins d’ADN, arrêt de la progression des fourches de réplication lors de la synthèse de l’ADN…), et permet d’arrêter le cycle en G2, c’est-à-dire de faire en sorte que la mitose ne soit pas déclenchée tant que la réplication n’est pas totalement et correctement achevée. Pour cela, les molécules qui interviennent vont bloquer le processus d’activation de la Cdk1.
Une des cibles essentielles du point de surveillance G2/M est la phosphatase Cdc25C qui sera inactivée. La fonction de Cdc25C dans la progression normale du cycle est de déphosphoryler la Cdk1, rendant ainsi le complexe actif, première étape de l’activation du complexe cycline B / Cdk 1. Les lésions de l’ADN activent Chk1 et Chk2 qui phosphorylent Cdc25C sur des sérines, ce qui entraîne sa séquestration dans le cytoplasme, loin de son substrat nucléaire Cdk1. Le complexe Cycline B / Cdk1 reste alors phosphorylé donc inactif. Si la réplication est inachevée, c’est ATR qui intervient, phosphoryle Chk1 qui inhibe Cdk1. Chk1 et Chk2 peuvent également inactiver Cdc25C en inhibant l’action de la kinase Polo, ou rendre inactive la Cdk1 en séquestrant les complexes Cycline B / Cdk 1 dans le cytoplasme, loin de ses substrats nucléaires : tant que la réplication n’est pas achevée, aucune mitose ne débute.
Un deuxième effet important est la stimulation de la synthèse d’un inhibiteur du cycle, la p21, qui bloque le complexe Cycline B / Cdk 1, provoquant ainsi le maintien de l’arrêt en G2. La protéine p21 peut, soit inhiber Cdk1, soit bloquer la CAK. Dans cette réponse, plus lente que la première, c’est p53 qui, en grande quantité dans la cellule, parce qu’elle est phosphorylée par Chk2 activée par ATM et en conséquence non dégradée, stimule le gène de la p21. p53 peut aussi réprimer les gènes de Cdk1 et de Cycline B dont les promoteurs contiennent un site p53.
p53 a été surnommée « le gardien du génome ». Elle est exprimée tout au long du cycle cellulaire, mais son taux d’expression reste bas du fait de sa dégradation rapide. C’est une protéine nucléaire qui possède plusieurs fonctions. C’est un facteur de transcription, mais c’est aussi une endonucléase qui participe directement à la réparation de l’ADN.
Si l'ADN est lésé, ou si la réplication n'est pas achevée, l'activation de plusieurs voies inhibitrices du complexe Cdk 1 / Cycline B permet d'empêcher l'entrée en mitose. Deux de ces voies sont illustrées ici.
Cliquez sur la figure pour accéder à une explication animée.
La grande diversité des voies intervenant pour bloquer l’entrée en mitose en cas d’anomalies de l’ADN reflète l’importance de cette régulation qui garantit la répartition d’un ADN intact dans les 2 cellules filles.
La transition métaphase - anaphase et point de surveillance métaphase - anaphase
Rappels sur les différentes phases de la mitose
La mitose se compose de plusieurs phases (voir le dossier « La Mitose »). En résumé :
-
Prophase : les chromosomes se condensent, les centrosomes s’éloignent l’un de l’autre et le fuseau mitotique se forme puis l’enveloppe nucléaire disparaît.
-
Prométaphase : les chromatides-sœurs de chaque chromosome sont capturées par des microtubules des pôles opposés au niveau de leur kinétochore.
-
Métaphase : l’attachement bipolaire des chromosomes, par leurs kinétochores, est terminé. Ils sont tous situés dans le plan équatorial de la cellule (= plaque métaphasique).
-
Anaphase : les deux chromatides-sœurs de chaque chromosome se séparent. Chaque chromatide devient ainsi un chromosome « fils » indépendant. Un lot de chromatides migre vers un pôle, pendant que l’autre lot (portant la même information génétique) migre vers l’autre pôle.
-
Télophase : les enveloppes nucléaires se reforment autour des deux lots de chromosomes, et la cytodiérèse, processus long et complexe, permet d’obtenir deux nouvelles cellules distinctes.
L'entrée en prophase est contrôlé par le complexe Cycline B / Cdk 1. Ce complexe s'accumule en effet pendant la phase G2 et devient actif brutalement en début de mitose, permettant les évènements de la prophase.
Noter l'accumulation progressive du complexe Cycline B / Cdk 1 en G2 et M, puis sa chute après la métaphase.
La séparation des chromatides-soeurs, à la transition entre la métaphase et l'anaphase, est une étape particulièrement contrôlée, son bon fonctionnement détermine en effet la bonne répartition des chromosomes-fils dans les cellules-filles. Après l’anaphase, le complexe Cycline B / Cdk 1 est dégradé.
La transition métaphase - anaphase, une étape clé de la mitose
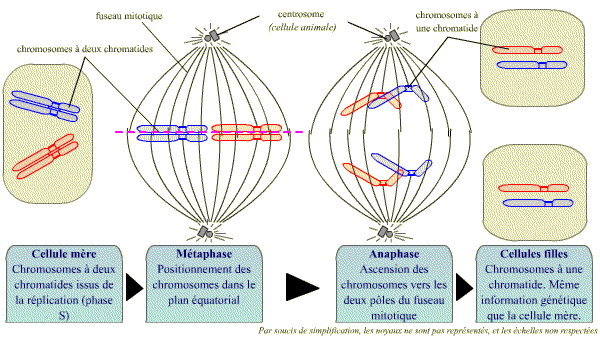
Lors de la mitose, une étape clé est le passage de la métaphase (où les chromatides sont encore étroitement associées) à l’anaphase (où les chromatides se séparent). Cette étape est fondamentale dans le passage d’une cellule à chromosomes formés de deux chromatides, à deux cellules qui possèdent les mêmes chromosomes, mais formés chacun d’une seule chromatide.
La transition de la métaphase à l'anaphase est centrale dans le passage d'une cellule à chromosomes bichromatidiens à deux cellules à chromosomes monochromatidiens.
La séparation des chromatides-soeurs
La séparation des chromatides-soeurs de chaque chromosome est le point culminant de la mitose, au moment de la transition métaphase - anaphase.
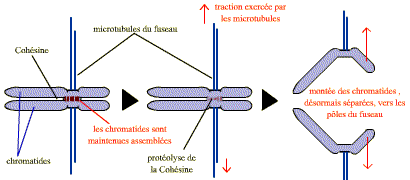
Les chromatides sont liées entre elles dans la région du centromère, mais aussi tout au long de leurs bras, par un complexe de protéines : le complexe cohésine. Celui-ci se met en place pendant la réplication (phase S) et est dégradé en 2 étapes. Au cours de la prométaphase de la mitose, le complexe cohésine est dégradé le long des bras mais demeure au niveau du centromère. A la fin de la métaphase, la destruction par un processus spécifique de protéolyse, du complexe cohésine du centromère permet la séparation soudaine des chromatides-sœurs, qui peuvent alors migrer vers les pôles opposés du fuseau.
La destruction soudaine du complexe cohésine du centromère permet la séparation des chromatides sœurs et leur migration vers les 2 pôles du fuseau.
La séparation des chromatides-sœurs, qui marque le début de l’anaphase, est la conséquence d’une succession d’événements moléculaires :
-
Activation d’un complexe enzymatique, l’APC (Anaphase Promoting Complex). L’APC est un complexe enzymatique ubiquitine / ligase qui permet la destruction de plusieurs protéines régulatrices de la mitose, en particulier de la sécurine.
-
L’APC activé permet l’ubiquitinylation et la destruction de la protéine sécurine par les enzymes du protéasome. Or, la sécurine était auparavant liée à une protéase (de la famille des caspases), la séparase. Cette liaison permettait à la sécurine d’inhiber la séparase. La destruction de la sécurine permet donc de lever cette inhibition sur la séparase.
-
La séparase, devenue active, clive une sous-unité du complexe cohésine. En un instant le complexe cohésine s’ouvre et les chromatides se séparent.
Ainsi, la transition métaphase – anaphase est étroitement liée à l’activation du complexe APC. L’activation de l’APC fait intervenir la protéine Cdc 20 : Lorsque la cellule entre en mitose, la Cycline B / Cdk 1 phosphoryle l’APC, ce qui augmente son affinité pour Cdc20. Il se forme alors de nombreux complexes APC/Cdc20 non actifs qui seront nécessaires à l’ubiquitinylation de la sécurine et de la cycline B (voir ci-après).
Point de surveillance métaphase/anaphase : attachement correct des chromosomes au fuseau
L'attachement correct des chromosomes au fuseau mitotique est indispensable au déclenchement de l'anaphase. Le contrôle de cet attachement représente un point de contrôle important, au cours de la mitose.
Un mécanisme opère pour s’assurer que tous les chromosomes sont correctement attachés au fuseau avant que la séparation des chromatides-sœurs n’ait lieu. Les chromosomes non attachés au fuseau bloquent la séparation des chromatides-sœurs : chaque kinétochore non correctement attaché au fuseau envoie un signal inhibiteur bloquant l’activation de APC – Cdc20. Ce signal généré par le kinétochore non attaché correspond à la protéine Mad2 (Mitotic Arrest Deficient – 2) : un seul kinétochore mal attaché a pour conséquence la liaison de Mad2 sur le complexe APC – Cdc20, et ainsi son inhibition. Une fois que tous les kinétochores sont attachés, Mad2 n’est plus active et APC – Cdc20 devient actif, ce qui permet la destruction de la sécurine et la séparation des chromatides pour leur ascension polaire opposée.
Tant qu'il reste au moins un kinétochore non associé au fuseau, celui-ci émet un signal négatif, grâce à Mad2, qui aboutit à l'absence de la levée de l'inhibition de la sécurine sur la séparase. Sans séparase active, la transition vers l'anaphase ne se réalise pas.
La sortie de mitose
Après la migration des chromosomes aux pôles du fuseau, les processus inverses de la prophase doivent avoir lieu.
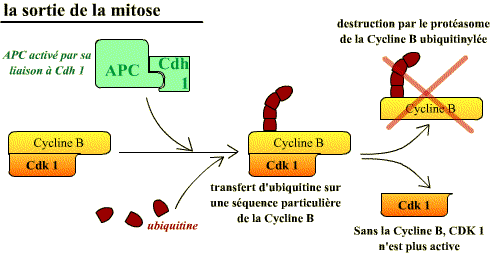
L’inactivation du complexe Cycline B / Cdk 1 a lieu essentiellement par la protéolyse ubiquitine-dépendante de la cycline B. L’ubiquitinylation de la cycline est causée par le complexe APC - Cdh1 (Cdc 20 homolog). En effet, pour ubiquitinyler la Cycline B, l'APC a besoin d'une autre sous-unité de spécificité de substrat différente de Cdc 20, la Cdh1
La dégradation protéolytique de la cycline B par les enzymes du protéasome nécessite que la cycline soit au préalable reconnue et « marquée » par des chaînes d’ubiquitine par l’APC/Cdh1. Il faut remarquer que c’est le complexe Cycline B / Cdk1 actif qui est lui-même à l’origine de l’activation de la dégradation de la cyline B, sa sous-unité activatrice. En effet, c’est lui qui, lorsque la cellule entre en mitose, provoque la préactivation de l’APC en le phosphorylant. Lorsque ces complexes seront devenus actifs, l’ubiquitinylation de la cycline B aura lieu.
Ainsi l’activation de l'APC conduit non seulement à l’anaphase mais aussi à l’inactivation du complexe Cycline B / Cdk1 ce qui entraîne tous les autres événements qui permettent à la cellule de sortir de la mitose.
Comment une cellule en G0 peut-elle entrer en G1 ?
Les cellules-filles, dès la sortie de mitose, peuvent entrer en phase G0, stade de non division ou de « quiescence ». La plupart des cellules dans un organisme adulte sont en G0. Seules des cellules spécialisées comme les cellules souches hématopoïétiques ou les cellules souches de l’épithélium intestinal gardent la capacité d’une prolifération active.
Les cellules qui sont en G0 n’effectuent ni réplication d’ADN, ni mitose, leur cytoplasme ne contient pas de cycline et le facteur de transcription E2F y est maintenu inactif par la protéine Rb. Ces cellules sont en dehors du cycle cellulaire mais elles peuvent, si elles sont stimulées par des facteurs mitogéniques extérieurs, y entrer à nouveau.
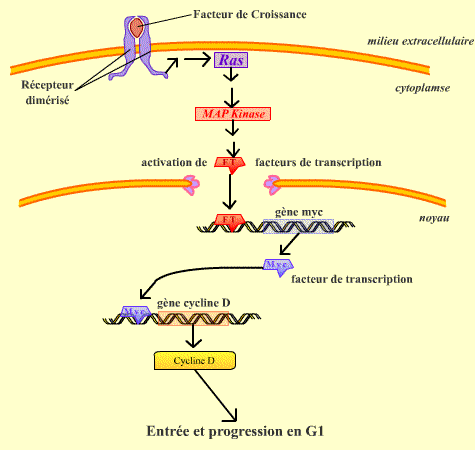
La transition de l’état de repos vers la prolifération est dépendante de l’action de facteurs mitogènes ou facteurs de croissance (ou d’autres stimulus extracellulaires). La liaison du facteur de croissance à son récepteur transmembranaire provoque une cascade de signaux intracellulaires : activation d’une petite GTPase, Ras, qui conduit à l’activation de la cascade MAPKinase et enfin à l’activation du gène de la protéine Myc, qui est un facteur de transcription. Myc déclenche la transcription du gène de la Cycline D.
La voie Ras - MAPKinase permet, suite à la stimulation par des facteurs de croissance, de déclencher l'expression du gène codant la Cycline D.
Les traductions de Myc et de la Cycline D ont lieu dans le cytoplasme.
En présence de cycline D, le complexe Cycline D / Cdk 4 peut se former et être activé. Contrairement à la Cycline B, dont le moment de la dégradation est réglé d’une façon précise, la Cycline D est continuellement dégradée par SPC (S-phase Promoting Complex), ubiquitine ligase, qui est présente en permanence dans la cellule. Le maintien du complexe Cycline D / Cdk 4 est donc le résultat d’un équilibre entre stimulation de la synthèse et dégradation.
En absence de facteurs de croissance, la Cycline D n’étant plus synthétisée, la cellule se retrouve sans complexe Cycline D / Cdk4 actif. La cellule retourne alors en G0.
Le passage de G1 à la suite du cycle
Action de Cycline D / Cdk 4 sur la protéine Rb
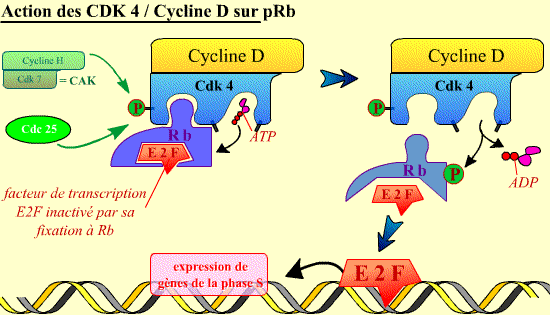
Au début de G1, la cellule contient le complexe Cycline D / Cdk 4 qui, une fois activé, initie la phosphorylation de la pRb. Phosphorylée, la pRb libère E2F qui sert alors de facteur de transcription du gène de la cycline E. La fonction essentielle de la Cycline D / Cdk4 est donc d’activer, au début de la phase G1 (G1 précoce), la transcription du gène de la cycline E intervenant dans la phase suivante du cycle.
Une fois activé, le complexe Cycline D / Cdk4 peut phosphoryler la protéine Rb. Ceci permet alors la libération par cette dernière du facteur de transcription E2F.
Une fois libéré, E2F se fixe sur l'ADN, activant l'expression de gènes codant pour des protéines nécessaires au déroulement de la phase S.
Cliquer sur l'image pour accéder à une explication animée.
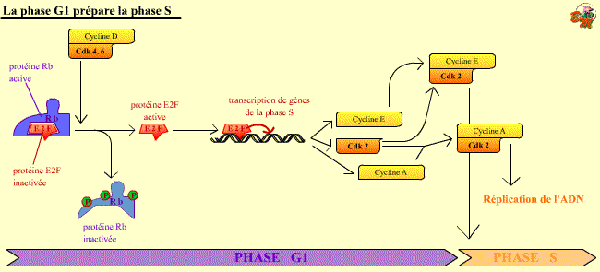
Une boucle de rétroactivation prépare le passage du point de restriction
Après la synthèse de la Cycline E, le complexe Cycline E / Cdk 2 pourra alors se former. Or, ce nouveau complexe a lui aussi pour protéine cible la pRb qu’il phosphoryle. Il commande donc, par boucle de rétro-activation, l’amplification de la synthèse de sa propre cycline. Lorsqu’elle est hyperphosphorylée, la pRb libère le facteur E2F qui stimule alors la transcription du gène de la cycline suivante, la cycline A.
En réalité, il existe plusieurs versions de pRb : pRb, p130, et p107 qui séquestrent différents facteurs de transcription E2F (E2F1, 2, 3, 4, 5).
L'activation du facteur de transcription E2F, grâce à la phosphorylation de la protéine Rb, permet la synthèse de gènes de la phase S.
La transcription de Cdk 2 et de Cycline E, en particulier, permet d'augmenter cette activation de E2F, ce complexe phosphorylant Rb .
Ce mécanisme permet à la cellule de préparer son entrée en phase S.
Le point de restriction, limite entre G1 précoce et G1 tardif
Le point de restriction désigne un moment spécifique de G1, avant lequel les cellules en culture ont besoin de facteurs de croissance pour avancer dans le cycle, et après lequel elles peuvent proliférer indépendamment des stimuli mitogéniques. Ce point a été mis en évidence en 1968 par A. Pardee.
-
Des cellules en culture, ayant effectué une mitose 3 heures auparavant, peuvent être stoppées dans le cycle cellulaire par une privation en facteur de croissance : elles entrent en G0. Ces cellules peuvent ensuite entrer à nouveau dans le cycle si on re-stimule par des facteurs de croissance.
-
Si les mêmes cellules sont privées de facteurs de croissance 4 heures après la mitose, elles continuent quand même le cycle : elles avaient passé le point de restriction.
Actuellement le point de restriction est utilisé pour subdiviser G1 en une phase G1 précoce et une phase G1 tardive. Dans des cellules en culture, le point de restriction se situe 3 à 4 heures après la mitose. En revanche, la phase G1 tardive (du point de restriction à la phase S) a une durée plus variable, de 1 heure à 10 heures. Cette variabilité explique les différences qui existent dans la longueur du cycle cellulaire.
On peut considérer que la cellule passe le point de restriction au moment où elle a, sous l’influence de facteurs de croissance, suffisamment synthétisé de cycline D et suffisamment mis en place de Cycline E / Cdk2 phosphorylant suffisamment de pRb. La situation est probablement beaucoup plus complexe, avec intervention de signaux externes capables de réguler le nombre de cellules dans un organe, la taille d’un organe, ou même des signaux internes capables de mesurer le stade de croissance atteint par la cellule…
Relation entre point de restriction et processus de surveillance G1 / S
Passé le point de restriction, la cellule commence irréversiblement un cycle, sauf si elle détecte une anomalie au niveau de l’ADN ; dans ce cas, le processus de surveillance G1/S est enclenché. Ainsi le processus de surveillance peut retenir la cellule en phase G1, c’est ce qu’illustre l’animation suivante.
Récapitulatif des molécules de la phase G1
|
Protéines
|
Partenaires ou cibles
|
Rôles clés
|
| Cdk | ||
| Cdk 4 | Cycline D | Fonctionne pendant G1 pour phosphoryler pRb. Directement induite par c-Myc |
| Cdk 6 | Cycline D | Phosphoryle pRb |
| Cdk 2 | Cyclines E et A | Fonctionne de G1 tardif à G2. Phosphoryle pRb et d'autres substrats comme les histones. Impliquée dans la duplication du centrosome et la réplication de l'ADN quand elle est liée avec la Cycline A |
| Cyclines | ||
| Cycline D | Cdk 4 et Cdk 6 | Quantité augmente en G1 et reste importante pendant la suite du cycle cellulaire |
| Cycline E | Cdk 2 | Induite après la phosphorylation de pRb par Cdk 4 et 6 |
| Inhibiteurs de Cdk | ||
| p16 | Cdk 4 et Cdk 6 | Induite pendant la sénescence et dans des stress oncogéniques. |
| p21 | Toutes les Cdk | p53 dépendante, induite durant la sénescence. Son niveau fluctue pendant le cycle, avec un pic en G1. Inhibe Cdk 2. Son absence prédispose aux tumeurs chez la souris |
| pRB - E2F | ||
| pRb, p130, p107 | E2F et beaucoup d'autres | Contrôlent la transcription de protéines liées au cycle. Sont régulées par les Cdk 4, 6 et 2 |
| E2F | pRb, p130, p107 | Cibles = gènes des Cyclines E et A, de pRb, de Cdk 1, de l'ADN polymérase |
| Phosphorylations | ||
| CAK (Cdk 7/Cycline H) |
Toutes les Cdk sauf Cdk7 |
Régule l'activité de presque tous les complexes Cdk / Cycline |
| Wee 1 | Complexes Cycline / Cdk | Phosphoryle et inactive Cdk 1 et 2. Régulé par Cdk 1et polo K |
| Cdc 25 | Complexes Cycline / Cdk | Active les Cdk 4, 6, 2 et 1 en enlevant les phosphorylations inhibtrices aux stades S et G2/M. Régulée par Cdk et polo K |
| Protéolyse | ||
| SPC | Impliqué dans la protéolyse médiée par l'ubiquitine des Cyclines D et E, ainsi que de p16 et E2F | |
Le point de surveillance G1 / S
L’activation des Cycline A et E / Cdk 2 permet l’entrée en phase S. Avant cette activation, lorsque la cellule est encore en G1, des cassures des brins d’ADN peuvent se produire accidentellement ou sous l’effet d’un traitement. Cet événement engendre alors l’arrêt du cycle en phase G1, par activation du point de surveillance G1/S : la cellule fait en sorte que la phase S ne soit pas déclenchée. Les mêmes processus interviennent aussi pendant la phase S, permettant l’arrêt du cycle en cas de cassures de l’ADN ou d’anomalies de la réplication.
Pour cela, des molécules interviennent pour bloquer le processus d’activation de la Cycline A et E / Cdk2.
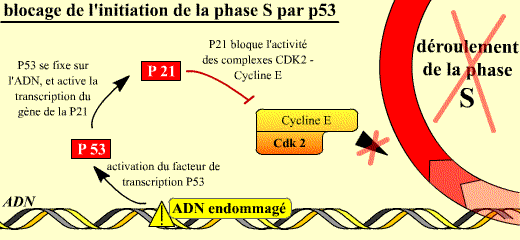
Une des cibles essentielles du point de surveillance G1/S est la phosphatase Cdc25A qui sera détruite. Une première voie est activée. La fonction de la Cdc25A dans la progression normale du cycle est de déphosphoryler la Cdk4 puis la Cdk2. Ces déphosphorylations sont activatrices pour la Cdk. La première voie activée peut donc arrêter le cycle, soit avant le point de restriction, en G1 précoce si elle agit sur Cdk4, soit après le point de restriction, en G1 tardif si elle agit sur Cdk2. Elle fait intervenir les messagers ATM-Chk2. ATM est recrutée par des protéines qui se lient aux cassures d'ADN, active alors Chk2, ce qui aboutit à la dégradation de Cdc 25 A. La conséquence est l'arrêt du cycle par la suppression de l'activation des complexes Cycline D / Cdk4-6 et Cycline E-A / Cdk2.
La deuxième voie possible pour le point de surveillance G1/S est, comme dans le cas du point de surveillance G2/M, la synthèse accrue de la p21 qui est inhibitrice de Cdk2/Cycline E et A. Dans ce cas l’arrêt du cycle se fait en G1 tardif. Si l’ADN est lésé, Chk2 activé par ATM phosphoryle p53 sur les sérines 9, 15 et 20. Ces phosphorylations de p53 réduisent son ubiquitinylation et sa dégradation, en conséquence la quantité de p53 augmente dans la cellule. p53 induit l’expression de p21 qui inhibe les complexes cycline D / Cdk4, Cycline E-A / Cdk2, ce qui arrête le cycle. La surexpression de la p21 est donc induite par la p53 dont la quantité augmente considérablement dans la cellule dont l’ADN est lésé.
p53 hyperphosphorylée peut induire également l’expression de gènes impliqués dans l’apoptose (bax, Fas), ce qui conduit la cellule à la mort. p53 peut stimuler également la transcription de gènes de réparation de l’ADN
Si p53 est déficiente, les cellules entrent en S malgré les anomalies de l’ADN et de plus, elles ne sont pas éliminées par apoptose. Ces deux processus peuvent aboutir à un cancer.
Les complexes cycline E / Cdk 2 permettent normalement le déroulement de la phase S. Lorsque l'ADN est endommagé, l'activation de la p53 permet d'augmenter la synthèse de la p21 (p53 étant un facteur de transcription, capable en particulier d'activer la transcription du gène de la p21).
La p21 bloque alors l'activité des complexes Cycline E / Cdk 2 : la phase S ne peut pas commencer si l'ADN est endommagé.
La combinaison de ces deux voies de signalisation permet à la cellule de ne pas s'engager dans la réplication de l'ADN si celui-ci est endommagé. La cellule évite ainsi l'apparition de mutations.
La phase S
Les origines de réplication fixent , pendant la phase G1, le complexe ORC (Origine Recognition Complex) sur lequel viennent se placer les protéines Cdc6, Cdt1, MCM (mini chromosome maintenance) ainsi que les facteurs qui permettent le démarrage de la réplication (ADN polymérase…). L’assemblage de cet énorme complexe dépend de Cdk2 /Cycline E.
Lorsque la réplication est déclenchée, les protéines Cdc6 et Cdt1 sont phosphorylées par Cdk 2/Cycline A, ce qui provoque leur détachement de l’ADN et permet d’éviter la reconstitution du complexe d’initiation.
La protéine ATR, du point de surveillance G1/S, est elle aussi associée au complexe ORC, prête à intervenir si une anomalie est détectée au niveau de la fourche de réplication.
Remarque : Le « point » de surveillance G1/S est donc un processus qui peut intervenir tout au long de la phase S.
La Cdk2/Cycline E a permis l’entrée en phase S ainsi que la mise en place des complexes d’initiation et de surveillance de la réplication.
La Cdk2/Cycline A agit tout au long de la phase S pour rendre impossible une 2ème réplication (voir expériences de fusions cellulaires).
Il existe sur l’ADN un énorme complexe protéique – plus de 40 protéines – BASC (BRCA1 associated genome surveillance où BRCA1= breast cancer 1), associé à l’ADN. C’est un complexe de surveillance de l’intégrité du génome. On retrouve dans ce complexe les molécules de détection des lésions de l’ADN ainsi que les molécules de signalisation (ATM, BRCA1) qui font le lien avec les effecteurs de la réparation et du cycle cellulaire.
Conclusion générale
Grâce à la grande précision de la régulation du cycle, le taux d’erreurs dans le déroulement du cycle est très faible. Cependant, l’apparition de cellules transformées dont la prolifération incontrôlée aboutit à un cancer s'observe encore malheureusement trop fréquemment. Comme nous l'avons vu, la régulation du cycle cellulaire et les différents processus de surveillance du cycle font intervenir de très nombreuses protéines qui, soit stimulent la prolifération, soit l’inhibent. Toutes ces molécules peuvent présenter des mutations.
L’analyse moléculaire des tumeurs humaines montre que les protéines régulatrices du cycle sont fréquemment mutées. On peut constater :
-
des sur-expressions de protéines qui normalement sont des stimulatrices de la prolifération : Cyclines (Cycline D dans le cancer du sein) ou Cdk (Cdk4 par exemple)
-
des pertes d’expression ou des inactivations de protéines qui normalement sont des freins du cycle (CKI, pRb).
Les molécules intervenant aux points de surveillance du cycle sont également souvent mutées : l’inactivation par délétion ou mutation du gène de la p53 est fréquente dans de très nombreux cancers humains (côlon, poumons, sein, cerveau, os…), la sécurine du point de surveillance métaphase/anaphase, est mutée dans le cancer de l’hypophyse, l’ATM des points de surveillance G1/S et G2/M est mutée dans l’Ataxie-télangiectasie, maladie prédisposant aux cancers.
Il faut remarquer que ces changements dans le taux d’expression de molécules peuvent être dus à des altérations chromosomiques (translocations, délétions).
Parmi les gènes mutés dans les cancers se trouvent les gènes suppresseurs de tumeurs (leur rôle normal dans la cellule saine est de freiner la prolifération). Ces gènes, lorsqu’ils sont absents ou inhibés, peuvent être à l’origine d’un cancer. (exemple : pRb, p53)
La pRb freine la prolifération en séquestrant le facteur de transcription E2F ; quand pRb est absente, le facteur E2F est en permanence activé, les cycles se succèdent sans arrêt, pas de réparations d’ADN possibles… La perte ou l’inactivation de la pRb est très fréquente dans les cancers humains, en revanche des mutations de la p E2F ou de Cdk2 n’ont pas été observées.
Certaines protéines virales (papillomavirus, SV40 ...) se lient à pRb et font libérer E2F, ce qui a pour conséquence une prolifération anarchique incontrôlable.
La p53 freine la prolifération en stimulant la synthèse d’un inhibiteur (p21) de Cycline / Cdk. Quand la p53 est non fonctionnelle la p21 est absente et le cycle n’est pas arrêté par inhibition de Cycline / Cdk, la prolifération s’effectue sans frein. De plus, le nombre de cellules augmente parce que sans p53 les cellules qui présentent des anomalies et qui ne peuvent pas être réparées ne sont pas dirigées vers une mort par apoptose.
Un grand merci à l’ensemble de l’équipe du laboratoire Biologie et Multimédia pour leur aide tout au long de ce projet. Un énorme merci à Philippe Denoulet (Université Pierre et Marie Curie) pour sa relecture attentive, ses critiques et toutes ses discussions sur ce document.