Cet article présente une technique de coloration histologique à base de jus de myrtille, avec ajout éventuel d'un mordant.
Introduction
Les biologistes ont remarqué que l’utilisation de colorants utilisés par les teinturiers pour colorer les tissus des vêtements pouvait, dans certaines circonstances, améliorer l’observation d’objets microscopiques. En effet le contenu des cellules est transparent, ce qui traduit que ses composants ont des indices de réfraction fort proches.
Historiquement, les microscopistes ont d’abord utilisé le safran, le carmin (issu d’un insecte), le bois de campêche et d’autres bois exotiques, ainsi que quelques composés minéraux (sels de cuivre, mercure et de plomb, iode).
La seconde moitié du XIXe siècle a vu apparaître des colorants issus de la chimie du goudron de houille. Les conditions d’extraction ou les méthodes de fabrication de tous ces colorants avaient un coût qui en restreignait l’utilisation.
La difficulté de se procurer ces substances a amené des biologistes à s’intéresser à des produits locaux, facile à se procurer et bon marché. La recherche de méthodes de coloration de substitution aux colorants de synthèse s’est imposée très tôt. Elle se poursuit encore.
La méthode présentée ici est une adaptation d’une publication de la fin du XIXe siècle (1884) par Lavdowsky, cytologiste russe. Cette méthode a été modifiée afin d’éviter la filtration à chaud du colorant et l’utilisation de certains composés toxiques.
Cette méthode consiste à utiliser le jus d’un fruit, la myrtille (Vaccinium myrtillus de la famille des Éricacées), comme colorant des chromosomes.
Préparation du colorant et matériel expérimental
- Transvaser le contenu d’un sachet de myrtilles congelées dans un sac plastique. Étiqueter ce dernier avec la mention « ne pas consommer ».
- Broyer dans un mortier environ 20 grammes de myrtille auxquels on ajoutera le même volume d’alcool à 95 %.
- Filtrer sur un papier filtre préalablement imbibé d’alcool.
Cette solution mère se conserve très bien à l’obscurité.
Remarques :
- Ne jamais mélanger nourriture et matériel expérimental afin que l’on ne puisse pas consommer des myrtilles additionnées de produits impropres à la consommation.
- Pour observer les différentes étapes de la mitose, on conseille l’utilisation de racines d’échalotes (Allium cepa L. var. aggregatum). L’échalote grise (cv. Mikor) germe rapidement (racine obtenues en environ 2 jours).
- Pour observer des figures de méiose, on utilisera des boutons floraux d’ail, de poireaux ou d’ail des ours.
Méthode de coloration
La coloration, simple à réaliser, se déroule en plusieurs étapes.
Fixation du matériel
On peut se dispenser de fixation ou bien fixer avec le mélange suivant :
- acide acétique cristallisable : 1 volume
- éthanol : 3 volumes.
L’acide acétique est corrosif, le mélange aussi.
Hydrolyse de la lame moyenne
Certains matériels végétaux, comme les racines, ont des cellules fortement soudées les unes aux autres par un ciment pectique. Une hydrolyse acide permet une meilleure dissociation des cellules, une meilleure coloration et un écrasement plus aisé du matériel végétal, pour observer une couche d’une seule épaisseur de cellules. Elle améliore donc l’observation.
- Déposer quelques gouttes d’une solution d’acide chlorhydrique 1N sur la lame.
- Au bout de 5 minutes absorber le liquide par un carré de papier filtre.
- Laver trois fois à l’eau du robinet. À chaque fois, utiliser un carré de papier filtre pour éliminer le liquide. Mettre le papier filtre dans une poubelle particulière.
Ordre de grandeur du papier : en pliant 6 fois une feuille de papier filtre de 52 cm X 42 cm on obtient des rectangles de papiers de 6,5 cm sur 5,3 cm, qui suffisent fort bien.
Coloration de la préparation
- Diluer le colorant au tiers (un volume de solution mère pour 2 volumes d’eau).
- Déposer une goutte sur une lame.
- Placer la pointe de racine ou l’anthère dans le colorant.
- Déposer une lamelle sur la goutte de colorant.
- Pratiquer un écrasement entre lame et lamelle en tapotant avec un bout de bois.
La coloration est généralement rapide, en deux minutes.
Le colorant se fixe préférentiellement sur les chromosomes. Il colore également les parois. Suivant le pH du milieu d’observation, la couleur prise par les cellules peut varier. Pour rendre la coloration plus stable, on peut pratiquer le mordançage (voir plus loin) et utiliser des milieux de montage particuliers.
Résultats
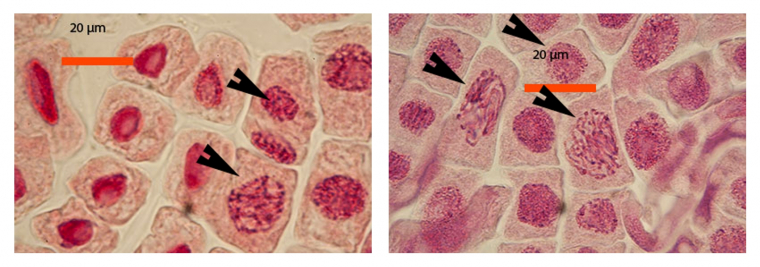
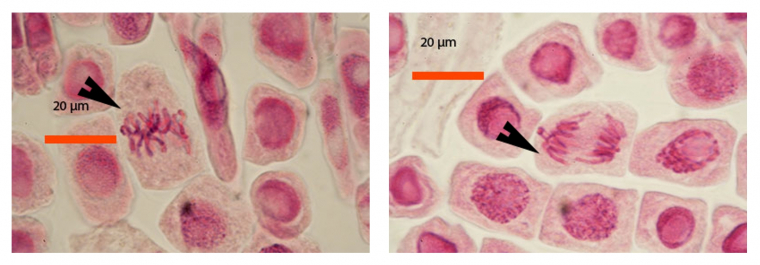
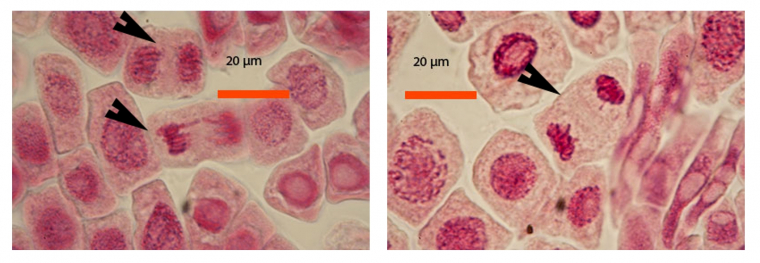
Les images suivantes des différentes phases de la mitose ont été obtenues avec des pointes de racine d’échalote colorées par le jus de myrtille.
A gauche : noyaux en interphase (flèche du haut) et prophase (flèche du bas)
A droite : noyaux en interphase (flèche du haut) et prophase (deux flèches du bas)
A gauche : métaphase (flèche)
A droite : anaphase (flèche)
A gauche : fin d'anaphase (flèche du haut) et début de télophase (flèche du bas)
A droite : télophase (flèche)
Le mordançage
Principe
Le mordançage est une technique connue des teinturiers depuis l’époque romaine. Les techniques des microscopistes (les méthodes de différenciations) peuvent différer de celles des teinturiers. Le mordançage augmente l’affinité du colorant pour les structures à colorer. Il peut changer la couleur finale de la coloration.
Le mordant contient un métal avec une valence au moins égale à deux. Il forme des complexes de coordination avec certains colorants. Il se forme alors une laque grâce à des liaisons de coordination entre le colorant et le métal du mordant. Il peut aussi se former ces mêmes liaisons entre la structure à colorer, le mordant et le colorant.
Méthode
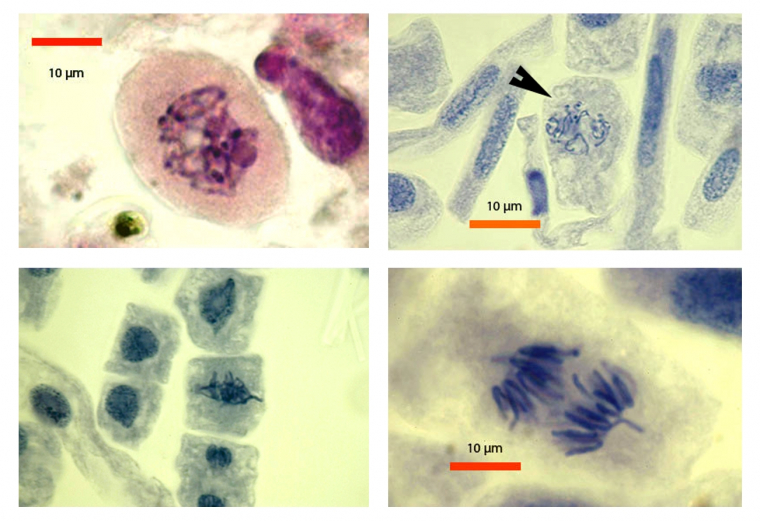
Les images ci-dessous ont été réalisées après avoir soulevé légèrement la lamelle couvre-objet et introduit une solution d’alun à 2 % (sulfate d’aluminium et de potassium [KAl(SO4)2 12 H2O] dans l’eau, à 2 % poids/volume). Après plusieurs minutes, la solution a été éliminée à l’aide d’un fragment de papier filtre. Mettre dans un milieu de montage (voir ci-dessous).
Voir également Gabe (1968) et cette page expliquant ce qu’est le mordançage (en anglais).
En haut : cellule en prophase, à gauche, et en fin de prophase, à droite.
En bas : cellule en métaphase, à gauche, et en anaphase, à droite.
Milieux de montage
Solution de saccharose
C’est un milieu aqueux qui évite d’avoir à déshydrater l’objet observé. Ce milieu se dessèche au bord de la lame et empêche l’évaporation et la cristallisation du milieu de montage sous la lamelle. La durée de conservation est d’à peu près 1 an.
Composition du milieu et préparation
Faire dissoudre 50 g de saccharose (du sucre en poudre convient parfaitement) dans 25 ml d’eau. Il est important de faire en sorte qu’il y ait disparition de tous les cristaux de sucre afin d’empêcher une recristallisation précoce.
Après coloration, soulever la lamelle par un côté et déposer une goutte près du bord de la lamelle. Reposer la lamelle.
Veiller à enlever l’excès de milieu.
On peut observer immédiatement ou laisser sécher la lamelle en posant un poids sur la lamelle.
Conclusion
On partagera, au vu des colorations réalisées, la conclusion de l’article de Lavdovsky : « On ne peut guère trouver de procédé plus recommandable pour obtenir rapidement et à coup sûr […] la coloration des noyaux et des membranes. Son très faible coût devrait également lui assurer une large diffusion, notamment dans l’enseignement et pour l’anatomie microscopique. »
Bibliographie
Gabe (1968) Techniques histologiques, Masson.
Lavdovsky ; Arch.f. mikrosk. Anat., XXIII, 1884 p 506 (en allemand).
StainsFiles ; The Internet Resource for Histotechnologists
Page d’accueil du site https://stainsfile.info/jindex.html