L'hépatite C affecte, comme son nom l'indique, le fonctionnement du foie. Cependant cette maladie présente également des manifestations extrahépatiques.
Le virus de l’hépatite C (VHC) est un virus à ARN de la famille des Flavivirus. Son génome comporte une région structurale codant les protéines de l’enveloppe et de la capside, et une région non structurale, codant les protéines impliquées dans la réplication virale. Il existe plusieurs sous-types de VHC correspondant à différents génotypes (1a, 1b, 2, 3, 4, 5) ; certains sous-types sont associés à des atteintes hépatiques plus marquées.
Sur le plan épidémiologique, la prévalence est élevée chez les usagers de drogues par voie intraveineuse, les détenus et les sujets infectés par le VIH. Cette prévalence est directement liée à la transmission, par le sang, du virus. Celle-ci se fait le plus fréquemment lors de l’usage de matériel d’injection partagé lors de consommation de drogues. Elle peut également avoir lieu suite à la réutilisation ou à la mauvaise stérilisation du matériel médical, en particulier des seringues et des aiguilles, dans certains centres de soins, ou lors de la transfusion de sang et la perfusion de produits sanguins labiles n’ayant pas fait l’objet d’un dépistage. D’après le Global Hepatitis Report, en 2017, 1 % de la population mondiale – 71 millions de personnes – serait infectée par le VHC [1].
Phase aiguë
Dans la phase aiguë, l’infection par le VHC est le plus généralement asymptomatique ; un ictère (jaunisse) peut être observé dans moins de 10 % des cas, entre 15 et 150 jours après le premier contage (c’est-à-dire après la contamination). À la différence de ce qui peut être observé par exemple avec le VHA et la co-infection VHB-VHD, l’hépatite fulminante, caractérisée par une nécrose massive du foie, est rarissime avec le VHC.
L’évolution naturelle de l’infection par VHC est dichotomique :
- dans moins de 20 % des cas, il y a guérison, induite par une réponse immunitaire de l’hôte efficace : on ne retrouve alors dans le sérum que les anticorps anti-VHC, l’ARN viral ayant lui disparu.
- dans plus de 80 % des cas, l’infection aiguë devient chronique : l’ARN viral persiste malgré la présence d’anticorps anti-VHC.
Le diagnostic est fait par sérologie (technique ELISA à la recherche d’anticorps anti-VHC) et complété par la recherche du génotype viral et la quantification de la charge virale C par PCR quantitative. Cette dernière méthode permet de détecter l’ARN du VHC une à trois semaines après le premier contage.
L’infection chronique
L’hépatite chronique
Si l’infection aiguë est passée inaperçue, l’infection chronique par le VHC est souvent diagnostiquée sur un bilan hépatique de routine – le patient étant encore asymptomatique – par une augmentation du taux de transaminases dans le sang. En effet ces enzymes, et notamment l’alanine aminotransférase (ALAT), sont produites par le foie. La destruction des hépatocytes par le VHC libère donc ces protéines dans le sang. L’augmentation du taux de transaminases incite en général à réaliser un bilan des causes de cette élévation ; le diagnostic d’infection par le VHC est fait en général en réalisant la sérologie des virus hépatotropes (virus de l’hépatite A, B, C, D et E notamment).
La lyse hépatocytaire est en grande partie liée à l’action de cytokines produites à la fois par les lymphocytes T cytotoxiques et par les cellules T CD4+ de type Th1, et en particulier aux grandes quantités de TNF-α et d’interféron-γ produites par ces dernières. L’action cytotoxique directe des lymphocytes T, combinée à l’action des cytokines, notamment du TNF-α, conduisent à la mort cellulaire par apoptose [2].
L’infection chronique peut également être diagnostiquée, hélas plus tardivement, à l’occasion d’une décompensation de cirrhose, une situation où les mécanismes de compensation de l’insuffisance hépatique sont dépassés. La cirrhose correspond à une fibrose diffuse du foie, c’est-à-dire à une accumulation anormalement élevée de constituants de la matrice extracellulaire dans le parenchyme hépatique. L’architecture lobulaire normale du foie est alors altérée et des nodules hépatocytaires de structure anormale (nodules dits de régénération) peuvent être observés en microscopie optique suite à une biopsie.
Le diagnostic est posé avec certitude après une biopsie hépatique ou une autopsie. La ponction chez des patients vivants n’est pas sans risque, car ils présentent souvent des troubles de la coagulation.
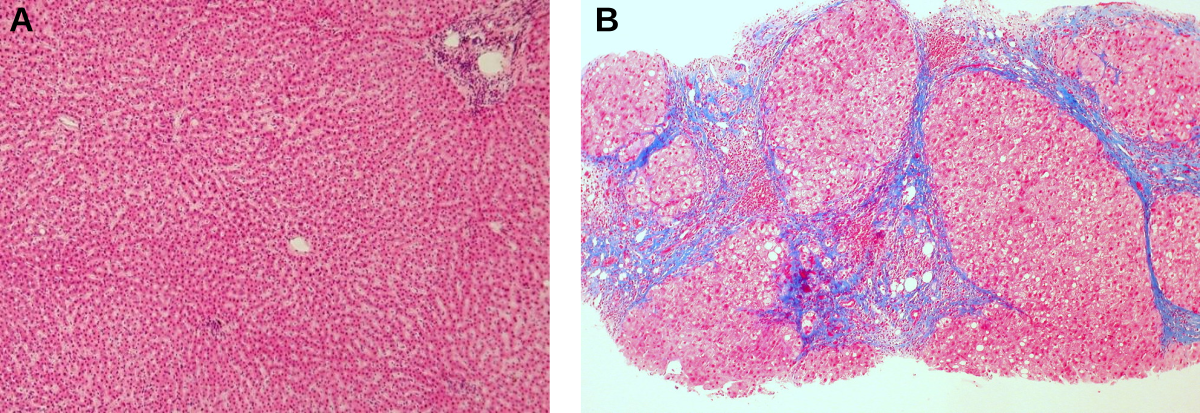
A. Sujet sain. Les hépatocytes (cellules colorées en rose) sont disposés en travées régulières et séparés par les sinusoïdes. Ces travées convergent vers une veine centrolobulaire (petit rond blanc visible au centre de l’image) et permettent de retrouver l’architecture lobulaire polygonale. Sur les angles du lobule au centre de l’image, on peut distinguer les espaces portes, composés d’une branche de la veine porte, de l’artère hépatique et d’un canal biliaire. Cette architecture peut se voir comme une interface d’échange, où les produits de dégradation du métabolisme hépatique sont excrétés vers les canaux biliaires qui se dirigent ensuite vers la lumière duodénale.
B. Sujet cirrothique. Les lobules sont totalement remaniés. Des plages de fibroses (violettes) sont visibles et altèrent l’architecture globale. Jouxtant certaines plages de fibrose, il est possible d’apercevoir les nodules de régénération, où les hépatocytes sont de structure différente, plus grands et déformés.
Sources : A. Department of Histology, Jagiellonian University Medical College, CC BY-SA, Wikimedia ; B. Ed Uthman, CC BY, Flickr
L’évolution vers des stades avancés de fibrose, en particulier le stade ultime qu’est la cirrhose, peut être favorisée par des agressions hépatiques surajoutées telles que la consommation d’alcool, une co-infection par le VIH, la présence d’un syndrome métabolique (maladie du soda, équivalent du foie gras pour l’homme), etc.
Le foie étant impliqué dans de nombreux processus métaboliques (synthèse des facteurs de la coagulation, métabolisme des médicaments et de l’alcool, excrétion biliaire des produits de dégradation du métabolisme de base…), sa fibrose avancée va empêcher le bon déroulement de ces différents processus, ce qui aura un retentissement systémique.
La décompensation de cirrhose peut prendre plusieurs formes, cliniquement marquée et menaçant souvent le pronostic vital, comme un coma, une péritonite par infection du liquide d’ascite, le vomissement de sang (hématémèse) par rupture de varices œsophagiennes, un carcinome hépatocellulaire…
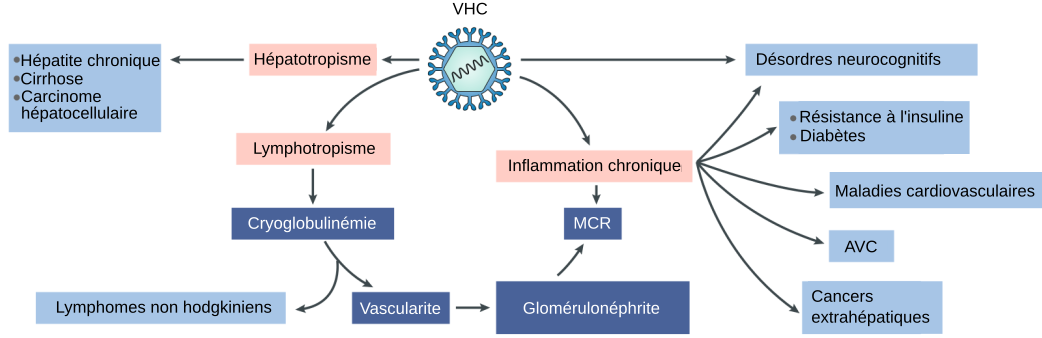
Le virus de l’hépatite C présente un tropisme pour le foie ainsi que pour le système lymphoïde. L’hépatotropisme va induire les maladies du foie comme la cirrhose ou le cancer hépatocellulaire. Le lymphotropisme ouvre la porte à d’autres atteintes systémiques, comme les cancers hématologiques tels que les lymphomes, ou encore la cryoglobulinémie. L’atteinte rénale (glomérulonéphrite et maladie chronique du rein, MCR) peut être un témoin de l’atteinte systémique liée à l’inflammation chronique et à la cryoglobulinémie. L’inflammation chronique augmentent les risques de maladies neuro et cardiovasculaires ainsi que le risque de cancer en général.
Une maladie extrahépatique systémique
Une cirrhose, qu’elle soit d’origine virale ou non, peut présenter des manifestations extrahépatiques comme la rupture de varices œsophagiennes, la présence d’une ascite (accumulation de liquide dans la cavité péritonéale) à risque d’infection par translocation bactérienne du tractus digestif, d’un déficit en facteurs de la coagulation ou encore la présence d’encéphalopathie hépatique par accumulation de métabolites neurotoxiques.
L’infection chronique par le virus de l’hépatite C présente également d’autres manifestations extrahépatiques, indépendantes de l’atteinte hépatique avancée. Ces atteintes systémiques ont des conséquences importantes en termes de mortalité.
Ces manifestations sont celles de l’inflammation chronique : résistance à l’insuline – voire diabète non insulinodépendant –, atteinte vasculaire chronique, en particulier l’athérosclérose, augmentant le risque d’AVC ou d’infarctus du myocarde par rapport à la population générale. Ces risques vasculaires seraient corrélés à l’importance de la charge virale circulante.
L’inflammation chronique, peut également mener à une atteinte rénale (glomérulonéphrite) en partie à cause de la quantité élevée d’immunoglobulines dans le sang. L’infection chronique par le VHC est également un facteur de risque indépendant pour les lymphomes non hodgkiniens et pourrait également être impliquée dans d’autres cancers comme ceux de l’œsophage, de la prostate ou de la thyroïde.
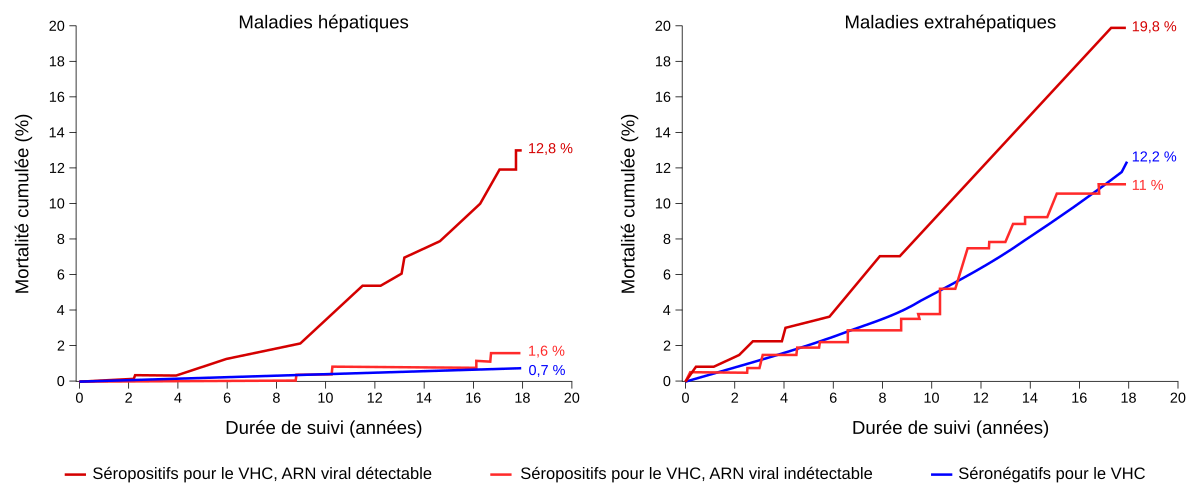
Ces graphiques présentent la mortalité cumulée par maladies hépatiques ou extrahépatiques, au sein d’une cohorte taïwanaise regroupant 23 820 personnes, suivies de 1991-1992 à fin 2008, et ayant un âge moyen de 47,6 ans à l’entrée dans l’étude. Trois groupes de personnes sont distingués : les séronégatifs pour le VHC, les séropositifs avec une charge virale détectable, et les séronégatifs avec une charge virale indétectable. Cette dernière catégorie correspond aux patients traités de façon efficace par des antiviraux.
Concernant la mortalité due à des maladies hépatiques, on constate qu’elle est divisée par huit chez les personnes séropositives dont la charge virale est indétectable par rapport à aux personnes chez qui elle est détectable. Chez ces dernières, on observe également que les morts par atteintes extrahépatiques sont nettement supérieures à celles retrouvées chez les personnes avec une charge virale indétectable.
L’extrémité des doigts, davantage exposée au froid, est un des lieux fréquents où la cryoglobuline précipite. On observe des taches bleutées, irrégulières – certains doigts sont épargnés comme l’index droit sur cette image – parfois associés des taches rouges punctiformes purpuriques. Les taches bleues correspondent aux territoires sous-oxygénés en aval d’un caillot obstructif. Elles peuvent parfois même s’associer à des zones blanches. Les taches rouges punctiformes correspondent à l’extravasation de globules rouges, au niveau du caillot, liée à l’atteinte endothéliale du vaisseau par la cryoglobuline. La douleur, l’atteinte rénale, le contexte infectieux, et l’analyse complète le tableau de cryoglobulinémie.
La cryoglobulinémie
Une atteinte assez particulière et typique de l’infection chronique par le VHC est la vascularite cryoglobulinémique. Chez les personnes atteintes, le sang contient de grandes quantités d’immunoglobulines pathologiques sensibles au froid appelées cryoglobulines. Celles-ci deviennent insolubles à des températures inférieures à la température corporelle normale – phénomène qu’on peut observer dès 34 °C. Le caillot précipité peut alors bloquer les vaisseaux sanguins et provoquer la nécrose par ischémie (hypoxie cellulaire) sur le territoire vasculaire d’aval. En général, ceci survient sur des territoires microvasculaires, exposés au froid, comme les doigts, les orteils, la peau. Cela peut également arriver dans les microvaisseaux du rein et causer des glomérulonéphrites d’origine vasculaire.
La cryoglobuline associée au VHC est souvent un mélange d’IgM, d’IgG et/ou d’IgA monoclonales ou polyclonales avec des protéines de complément sanguin telles que C4.
Conclusion
L’infection chronique par le virus de l’hépatite C, historiquement connue pour ses conséquences hépatiques, est néanmoins une maladie systémique dans laquelle les atteintes extrahépatiques sont responsables d’une part significative de la mortalité.
L’inflammation chronique ainsi que les modifications immunologiques comme la cryoglobuline sont à l’origine d’un tableau systémique.
Références
- L'hépatite C - Organisation mondiale de la santé
- Jean-Michel Pawlotsky – Gastroentérologie clinique & biologique 2001 ; 25 : 123-133 © Masson, Paris, 2001
- Gary Josephsen, M.D. – N Engl J Med 2005 ; 352 :2627 DOI : 10.1056/NEJMicm030887
- A. Obaid Shakil, M.D., and Adrian M. Di Bisceglie, M.D. – N Engl J Med 1994 ; 331 :1624 DOI : 10.1056/NEJM199412153312405