Présentation des modalités de reproduction de la Truffe noire du Périgord (Tuber melanosporum) et des difficultés à en cerner tous les aspects.
NB : « Truffe » avec une majuscule désigne ici l’espèce Tuber melanosporum tandis que « truffe » sans majuscule désigne la fructification comestible du champignon.
En mycologie, le terme de truffe désigne les champignons dont la fructification se met en place sous terre et non en surface. Parmi ces champignons souterrains, on distingue les truffes « vraies » qui appartiennent au genre Tuber, bien connu en Europe grâce à plusieurs espèces comestibles particulièrement appréciées, telles que la Truffe blanche du Piémont (Tuber magnatum) que l’on trouve quasi-exclusivement en Italie, la Truffe de Bourgogne (Tuber aestivum), ou encore la Truffe noire du Périgord ( Tuber melanosporum). Cette dernière tient une place importante dans la culture et la gastronomie française, et fait depuis plusieurs décennies l’objet de tentatives de domestication.
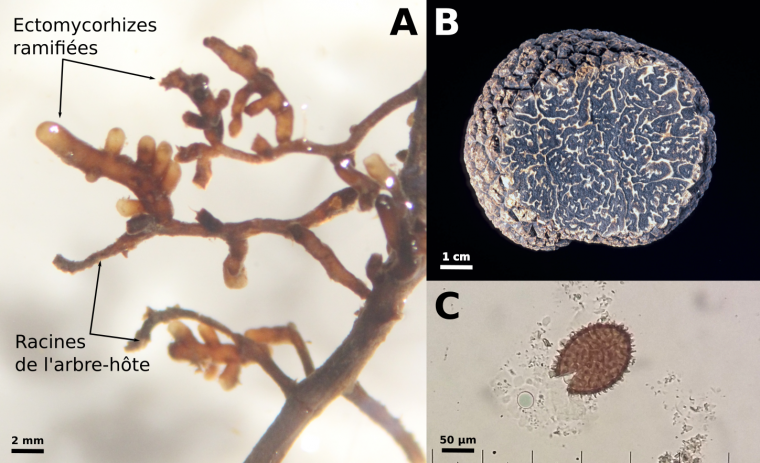
La Truffe noire est un champignon ectomycorhizien : elle établit avec les racines d’un arbre-hôte une interaction étroite dont chaque partenaire bénéficie. Le mycélium vivant dans le sol, constitué d’hyphes haploïdes, forme autour des jeunes racines de l’arbre un manteau et pénètre entre les cellules corticales, établissant ainsi une zone de protection et d’échanges (Fig. 1A). Les hyphes mycéliens, plus fins que les racines et capables d’explorer un grand volume de sol, captent eau et minéraux qu’ils transfèrent à l’arbre. Celui-ci fournit en retour des molécules carbonées issues de la photosynthèse, telles que des sucres ou des lipides. La symbiose ectomycorhizienne permet en outre une protection mutuelle accrue des deux partenaires contre les agressions du sol.
De nombreuses études ont montré comment un « dialogue moléculaire » entre les partenaires fongique et végétal permet l’établissement de la symbiose mycorhizienne, et on sait depuis plus de 40 ans comment inoculer en pépinière les jeunes arbres avec Tuber melanosporum. Plus de 80 % de la production française de truffes noires est aujourd’hui assurée par des plantations de chênes ou de noisetiers inoculés (le reste de la production provenant de truffières spontanées gérées). Cependant, de nombreux mystères entourent la formation des truffes proprement dite : si les ectomycorhizes sont indispensables à la production de la partie comestible du champignon (la « truffe » au sens commercial du terme, appelée ascocarpe, Fig. 1B), leur présence seule ne garantit pas la récolte.
(A) ectomycorhizes de Tuber melanosporum sur racine de noisetier, observées à la loupe binoculaire (photo Laure Schneider-Maunoury), (B) ascocarpe de Tuber melanosporum (photo François Le Tacon), (C) spore de Tuber melanosporum observée à la loupe binoculaire (photo Laure Schneider-Maunoury).
Une reproduction sexuée impliquant deux partenaires…
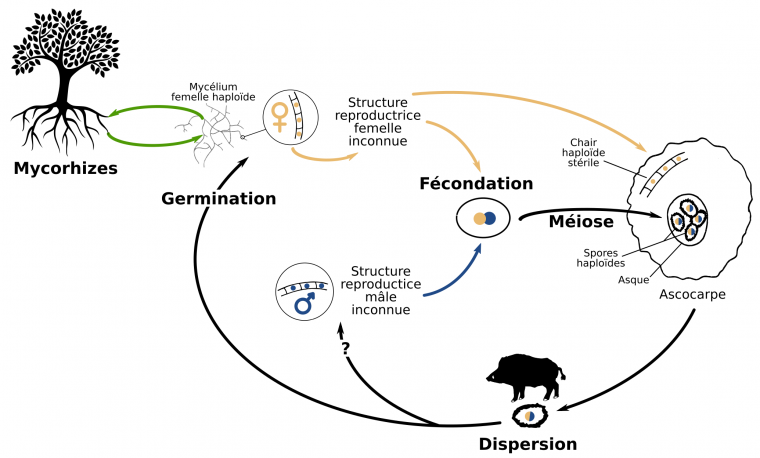
L’ascocarpe est l’équivalent anatomique du « chapeau » des champignons de surface, mais refermé sur lui-même et contenant en son sein les spores issues de la méiose, enfermées dans des asques. La chair de la truffe (les veines claires visibles sur la figure 1A) sont constituées de cellules haploïdes de génotype maternel. Les zones noires correspondent aux spores imprégnées de mélanine (Fig. 1C). Elles sont issues de la méiose de la cellule-œuf et sont donc également haploïdes mais contiennent à la fois des allèles maternels et des allèles paternels. Les appellations mâles et femelles sont données par analogie avec les espèces – telles que les animaux – dans lesquelles les individus qui investissent le plus dans la reproduction en portant la descendance sont appelés femelles et les individus investissant peu mâles. Chez la Truffe, le génotype femelle (ou maternel) est donc par convention celui retrouvé à la fois dans la chair et les spores, tandis que le génotype mâle (ou paternel) est celui trouvé uniquement dans les spores (Fig. 2).
Très peu de choses sont connues sur les mécanismes de la reproduction de la Truffe : on ignore encore quelles sont les structures reproductives mises en jeu dans la fécondation (simple mycélium, structure spécialisée ou encore cellules libres jouant le rôle de gamètes ?), s’il y a une unique fécondation et si celle-ci est suivie ou non de mitoses. L’impossibilité de cultiver la Truffe et de produire des ascocarpes en laboratoire rend difficile l’étude de la fécondation, qui en milieu naturel se déroule sous terre, au début de l’été.
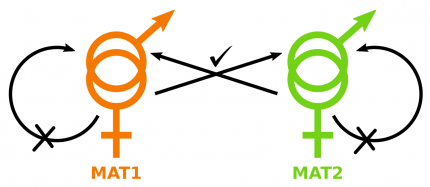
Chaque individu est hermaphrodite et porteur du gène MAT1 ou du gène MAT2. La fécondation est possible entre deux individus de type sexuel opposé, mais pas entre deux individus de même type sexuel ou au sein d’un même individu (autofécondation).
Par ailleurs, le génome de la Truffe contient un locus d’auto-incompatibilité, appelé « type sexuel » (ou mating type) : ce locus présente deux gènes (MAT1 ou MAT2), dont la présence conjointe est nécessaire à la reproduction. Ces deux gènes sont situés au même endroit dans le génome (même locus) mais codent chacun une protéine ayant une fonction complètement différente : on les appelle alors desidiomorphes et non pas des allèles. Le mycélium de T. melanosporum étant haploïde, chaque individu ne possède qu’un seul des deux gènes MAT, mais la présence des deux protéines codées par MAT1 et MAT2 est requise pour la fécondation : la reproduction a donc obligatoirement lieu entre deux individus différents porteurs de gènes MAT opposés. Pour autant, la Truffe est un organisme hermaphrodite, et chaque individu peut jouer le rôle mâle ou femelle dans la reproduction à condition de rencontrer un individu du type sexuel opposé (Fig. 3).
… ayant chacun une niche écologique propre
Des analyses génétiques ont montré que le génotype maternel des ascocarpes est aussi présent dans les ectomycorhizes avoisinantes, ce qui signifie que les individus maternels établissent des ectomycorhizes avec l’arbre-hôte. À l’inverse, les génotypes paternels ne sont jamais retrouvés sur les ectomycorhizes, indiquant que les individus mâles occupent une autre niche écologique.
Le génotypage de plusieurs centaines d’échantillons de truffes et d’ectomycorhizes pendant cinq ans a mis en évidence des différences importantes dans la structure génétique des deux populations parentales. Les individus maternels, qui forment des ectomycorhizes, sont de grande taille (de l’ordre de quelques m²), et sont impliqués dans de nombreux ascocarpes, parfois sur plusieurs saisons consécutives. Les partenaires paternels, quant à eux, participent à un petit nombre d’ascocarpes et sont très rarement trouvés deux années de suite. L’écologie des deux partenaires est donc bien distincte, l’un étant large et pérenne, l’autre petit et éphémère. Observation surprenante, on retrouve extrêmement peu de génotypes à la fois mâle dans un ascocarpe et femelle dans un autre (bien que la Truffe soit théoriquement hermaphrodite), ce qui suggère qu’un déterminisme particulier contraint le rôle reproductif de chaque individu.
Par ailleurs, les génotypes maternel et paternel d’une même truffe sont souvent très proches, témoignant d’un haut niveau de consanguinité. Enfin, proximités spatiale et génétique sont corrélées : plus les ascocarpes sont proches géographiquement dans la truffière, et plus leurs génotypes sont proches génétiquement ; inversement, plus ils sont éloignés dans la truffière, plus leurs génotypes sont différents. C’est ce qu’on appelle l’isolement par la distance (IBD ou isolation by distance en anglais) : chaque individu tend à se reproduire davantage avec les individus à proximité qu’avec les individus éloignés, ce qui traduit une absence de flux de gènes (qui rendrait les génotypes plus homogènes d’un bout à l’autre de la truffière). Ces indices suggèrent que les individus paternels, bien que non détectés encore, sont spatialement proches des individus maternels.
Une difficulté supplémentaire dans la recherche des partenaires paternels s’ajoute ici : au pied des arbres truffiers, on observe que les ascocarpes et les ectomycorhizes sont rassemblés par type sexuel. Dans certaines zones, toutes les ectomycorhizes et la chair des ascocarpes seront de type MAT1, tandis que dans la zone voisine elles seront MAT2. Comme la reproduction ne peut avoir lieu qu’entre individus de type sexuel opposé, cette observation entre en contradiction avec la déduction précédente selon laquelle les deux partenaires devaient être spatialement proches. Si les partenaires paternels ne peuvent pas être présents sur les ectomycorhizes mais doivent être proches des individus maternels, quelle niche peuvent-ils bien occuper ?
Le brûlé, une particularité de la Truffe du Périgord
La végétation est rase, peu dense et moins diversifiée qu’à l’extérieur du brûlé, et témoigne de la présence d’ectomycorhizes sur les racines de l’arbre.
Lorsqu’un arbre-hôte (chêne, noisetier, tilleul, charme…) est en symbiose avec T. melanosporum, on observe à sa base le développement d’une zone pauvre en plantes herbacées, appelée « brûlé » à cause de sa végétation rase et peu dense (Fig. 4). La présence de cette zone est corrélée à celle d’ectomycorhizes sur les racines de l’arbre, mais son existence ne s’explique pas encore. Il a récemment été mis en évidence que la Truffe colonise de manière diffuse les racines des plantes herbacées, sans dommage apparent ni structure visible (contrairement aux ectomycorhizes). Cette colonisation, appelée « endophyte » (terme qui désigne une interaction plante-champignon sans structure morphologique spécifique, dont les conséquences pour chaque partenaire sont inconnues), pourrait contribuer à ralentir ou empêcher la croissance des herbes du brûlé.
L’endophytisme, cette nouvelle niche écologique inconnue jusqu’alors pour T. melanosporum, intrigue pour deux raisons : la première est qu’elle pourrait être celle des partenaires paternels. Cependant, le génotypage du mycélium en interaction avec les racines des plantes herbacées révèle souvent le génotype maternel des ascocarpes les plus proches ou d’autres génotypes inconnus, mais jamais les génotypes paternels recherchés. La quête des partenaires paternels continue donc…
En revanche, cette découverte soulève la question de la délimitation des niches écologiques des champignons : une espèce fongique classiquement considérée comme ectomycorhizienne avec certaines espèces végétales, peut en fait être en même temps (et au même endroit) endophyte avec d’autres espèces végétales ! Reste à savoir si cette interaction endophyte est réellement négative pour les herbacées, ce qui pourrait expliquer le brûlé, et quel est son impact sur la vie de T. melanosporum.
Le mystère du partenaire paternel en voie de résolution
Chez un certain nombre de champignons, on connaît l’existence de cellules mobiles qui jouent le rôle de gamètes mâles, mais aucune structure de la sorte n’a été documentée chez T. melanosporum. Cependant, une hypothèse qui expliquerait les observations faites jusqu’à présent est que les spores elles-mêmes pourraient être (directement ou après une germination rapide) les partenaires paternels.
En effet, lorsqu’une truffe mature est ingérée par un animal attiré par son parfum, celui-ci disperse conjointement les spores contenues dans l’ascocarpe dans ses déjections. Se trouvent donc au même endroit des spores génétiquement proches (puisque issues d’un même événement de reproduction) et portant les idiomorphes MAT1 et MAT2 (puisque la reproduction a nécessité la présence de ces deux idiomorphes). Tout se passe alors comme si localement, un type sexuel donné devenait « dominant » dans les ectomycorhizes, et que seuls les spores de ce même type sexuel pouvaient établir de nouvelles ectomycorhizes et former des ascocarpes. Par exemple, si des spores d’un même ascocarpe sont déposées au milieu d’une zone où toutes les ectomycorhizes sont MAT1, alors les spores MAT1 vont pouvoir germer et former des ectomycorhizes. L’association symbiotique permettra à ces individus d’accéder à suffisamment de ressources carbonées pour assurer le développement et la nutrition d’ascocarpes. À l’inverse, la germination des spores MAT2 sera empêchée (par un mécanisme encore inconnu) et elles n’auront accès qu’à peu de ressources, les capacités de T. melanosporum à dégrader la matière organique morte du sol étant probablement limitées. Les individus MAT2 seront alors contraints de jouer le rôle paternel dans la formation des ascocarpes, potentiellement en germant rapidement et en rencontrant une structure reproductive maternelle, ne laissant que leurs gènes dans les spores.
Ce scenario rend compte à la fois de la consanguinité élevée et de l’isolement par la distance observés entre ascocarpes d’un même brûlé, ainsi que de l’agrégation des ectomycorhizes et des ascocarpes par type sexuel. Il est actuellement testé grâce à des expériences menées sur plusieurs années, qui consistent à inoculer des spores dont les génotypes sont connus et à rechercher ces génotypes dans les tissus maternels et les spores des ascocarpes des années suivantes. Mieux comprendre la reproduction de la Truffe du Périgord permettra peut-être d’en améliorer la production, en fort déclin depuis un siècle, mais aussi de mieux cerner l’écologie des champignons mycorhiziens, dont le rôle dans les écosystèmes est fondamental. Affaire à suivre…
Références
Articles de recherche
- Taschen et al. (2016). How the truffle got its mate : insights from genetic structure in spontaneous and planted Mediterranean populations of Tuber melanosporum. Molecular Ecology 25, 5611–5627
- Selosse et al. (2017). Black Truffle, a hermaphrodite with forced unisexual behaviour. Trends in Microbiology, in press
Références en français
- Selosse et al. (2016). Truffe en quête de pères : un champignon à l’orientation sexuelle forcée, et pas encore domestiqué ! Le Trufficulteur 97 : 7-11.
- Selosse et al. (2017). La truffe révèle les secrets de sa sexualité. La Recherche 524 : 72-76.
- Retrouvez d'autres articles de vulgarisation de Marc-André Selosse sur le site de l’Institut de systématique, évolution, biodiversité.