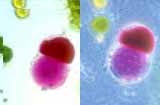
Protocole d'obtention de protoplastes à partir de chou rouge et de poireau. Réalisation de fusion entre protoplastes.
Document réalisé par « Biologie et Multimédia » à partir de données obtenues en travaux pratiques à la préparation à l’agrégation de Paris 6. Depuis la rédaction de cet article, certains fournisseurs proposent des kits prêts à l'emploi.
Introduction
Définition : Les protoplastes sont des cellules végétales sans paroi, obtenues expérimentalement par digestion de la paroi pectocellulosique. Pour obtenir ces protoplastes et les maintenir en vie, il faut les préparer et les conserver dans un milieu hypertonique qui plasmolyse les cellules et leur permet de ne pas éclater par entrée d’eau en l’absence de paroi.
Intérêt : Comme elles n’ont plus de paroi, ces cellules se prêtent à divers types d’expérimentation (introduction de matériel génétique étranger, fusion interspécifique, étude électrophysiologique de la membrane plasmique, etc.)
Les photographies sont présentées sous forme de vignettes. Cliquer dessus pour obtenir les photographies en plus grand format (640 × 400 pixels).
Matériel biologique
Un chou rouge entier en coupe longitudinale : il est constitué par un énorme bourgeon. Seules les assises externes des feuilles sont colorées.
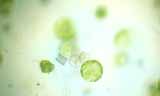
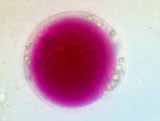
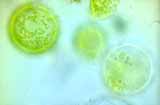
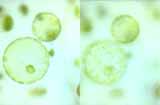
Le chou rouge et le poireau ont été choisis pour leur grande résistance. Ils possèdent une cuticule épaisse qui les protège de la déshydratation même si on les oublie un peu longtemps sur la paillasse. Pour les fusions, les protoplastes sont facilement reconnaissables. Les protoplastes de poireau sont verts grâce aux chloroplastes bien visibles. Les protoplastes de chou rouge ne sont pas chlorophylliens ; ils sont rouges grâce aux anthocyanes contenues dans leurs vacuoles.
Comme le montre la coupe longitudinale du chou-rouge, le mésophylle des feuilles n’est pas coloré. Les vacuoles à anthocyanes ne se trouvent que dans l’épiderme et quelques assises sous-jacentes.
Protocole d’obtention
Solution enzymatique d’incubation
Nombreux sont ceux qui veulent réaliser cette manipulation. Il manquait jusqu’à présent des références précises sur les produits. Dans ce document nous vous proposons deux types de tampons.
Tampon phosphate
Produits pour 100 mL de tampon phosphate 10 mM à pH 5,8 :
- 0,1 g de macérozyme Onozuka R10
- 0,1 g de cellulase Onozuka R10
- 10 g de mannitol (soit une concentration finale de 0,6 M)
Préparation :
- Réaliser une solution de NaH2PO4 à 0,2 M (solution A) et une solution de Na2HPO4 à 0,2 M (solution B).
- Mélanger 4,6 mL de solution A, 0,4 mL de solution B, 95 mL d’eau.
Références :
- cellulase Onozuka R10 réf : 16419.02
- macérozyme Onozuka R10 réf : 28302.02
- SERVA, distribué par COGER, 79 rue des Morillons 75015 Paris tél : 01 45 33 67 17
Tampon MES
Produits pour 100 mL de tampon MES 5 mM à pH 5,6 Sigma : référence M-8250
- 0,2 g de pectinase
- 1 g de cellulase
- 13 g de mannitol
- CaCl2 1 mM
Préparation :
- Préparer une solution mère à 100 mM
- Ajuster le pH à 5,6 avec KOH 0,1 M
- Préparer la solution finale à 5 mM
- Ajouter CaCl2 1 mM
- Ajouter le mannitol à 13 %
- Ajouter les enzymes cellulase et pectinase
Références :
- Cellulase : caylase 345
- Pectinase : M2
- Sociéte CAYLA, ZI Montaudran, 5 rue Jean Rodier 31400 Toulouse tél : 05 62 71 69 39 - Fax : 05 62 71 69 30
- Tampon MES : réf M-8250 (par 10 g) SIGMA
Les enzymes sont interchangeables.
Remarques
- CaCl2 : permet une meilleure stabilisation des membranes
- Tampon : nécessité absolue d’un tampon acide (pH 5,5 à 5,8) peu concentré. Le tampon phosphate est le plus facile à se procurer, mais ce n’est pas le meilleur pour les protoplastes. D’autre part le calcium précipite dans du tampon phosphate (!). Il vaut mieux utiliser le MES.
- Temps d’incubation : 4 heures à 28 °C, soit une nuit à la température du labo.
- Pour obtenir de grandes quantités de protoplastes permettant des manipulations, utiliser des solutions plus concentrées (1 g de macérozyme et 1 g de cellulase en conservant la même concentration en mannitol et le même pH). Attention, les enzymes coûtent cher. Préparer seulement la quantité nécessaire. S’il en reste, on peut congeler la solution. Au moment de la décongélation, agiter la solution au bain marie (30 °C maximum) pour remettre le mannitol en solution. À l’inverse, les concentrations indiquées pour les enzymes Cayla peuvent être divisées par 2.
Préparation du matériel biologique
- Faire des lamelles tangentielles fines dans une feuille de chou rouge et placer les lamelles immédiatement dans la solution enzymatique, la face sectionnée contre la solution.
- Enlever l’épiderme d’une feuille de poireau sur une petite surface (1 cm2). Découper le morceau dénudé et le poser sur la solution enzymatique, la face dénudée vers le bas. Répéter l’opération jusqu’à recouvrir la surface de la boîte avec les morceaux de feuilles.
Incubation
- Fermer les boîtes de Pétri avec leur couvercle et placez-les à l’étuve à 25 °C.
- Durée de l’incubation : au minimum 3 h, donc préparer le matin pour un TP du soir. Pour obtenir beaucoup de protoplastes, préparer la veille mais attention, les protoplastes sont fragiles et les milieux peuvent s’infecter (bactéries)
Préparation de chambres humides
- Sur une lame d’histologie, placer 2 lamelles séparées de 1 cm.
- Poser à la pipette une goutte de suspension cellulaire à étudier entre les deux lamelles.
- Placer une troisième lamelle à cheval sur les deux premières pour observer la préparation.
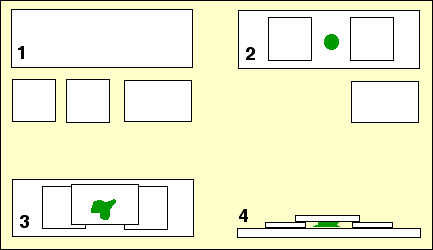 |
| L'épaisseur des lamelles est exagérée dans le schéma N°4. |
Observation des protoplastes
Étapes de la formation de protoplastes chlorophylliens à partir de mésophylle de feuilles de poireau
Observation de protoplastes de chou rouge
Observation de protoplastes de poireau
Réalisation de fusions
Préparation de la solution fusionnante
Pour 100 mL de tampon pH 7 :
- 40 g de PEG (Poly Ethylène Glycol réf. : P3640 chez Sigma)
- glucose 2 g
- nitrate de calcium 1,5 g
- Il n’est pas nécessaire d’ajouter du mannitol. Malgré son fort poids moléculaire, le PEG et les autres ingrédients maintiennent une pression osmotique suffisante.
Protocole
- Dans une chambre humide, déposer une goutte de suspension de protoplastes de chou rouge et une goutte de suspension de protoplastes de poireau.
- Mélanger délicatement avec la pointe de la pipette ou une spatule fine.
- Ajouter une goutte de la solution de PEG et mélanger délicatement.
- Recouvrir d’une lamelle et observer immédiatement.
- Lorsque vous observez un accolement particulièrement intéressant, restez sur cette observation en attendant la fusion complète des cytoplasmes.