Cet article fournit les renseignements nécessaires à la préparation et l’observation histologique de figures de méiose sur des végétaux frais ; l’ail des ours et la ciboulette. Il comprend l’explication des étapes suivantes : récolte, tri, fixation, conservation et coloration des échantillons.
Introduction
La mise en évidence de figures de méiose chez les végétaux est plus difficile à réaliser que celle de mitose. En effet, la plupart des plantes à fleurs a une période de différenciation des cellules mères des spores assez courte, très précoce dans le temps et souvent très différente de la période de maturité des fleurs. Ainsi, même si les jeunes étamines représentent un matériel de choix pour la mise en évidence de figures de méiose, la principale difficulté consiste à récolter les anthères au moment où les cellules mères du pollen (CMP) subissent la méiose. Deux autres questions se posent alors : comment avoir à disposition du matériel végétal hors saison et quel matériel choisir ?
Ce document se propose de répondre à ces questions afin de pouvoir préparer soi-même et relativement simplement des préparations observables.
Choix du matériel végétal : l’ail des ours, une plante idéale
Certains groupes d’espèces ont des figures de méiose plus facilement observables que d’autres. Il convient ainsi de rechercher des espèces ayant un nombre restreint de gros chromosomes et ne présentant pas trop d’anomalies (par exemple, certaines espèces peuvent avoir des chromosomes surnuméraires qui se répartissent aléatoirement). Par ailleurs il faut une plante que l’on puisse trouver facilement.
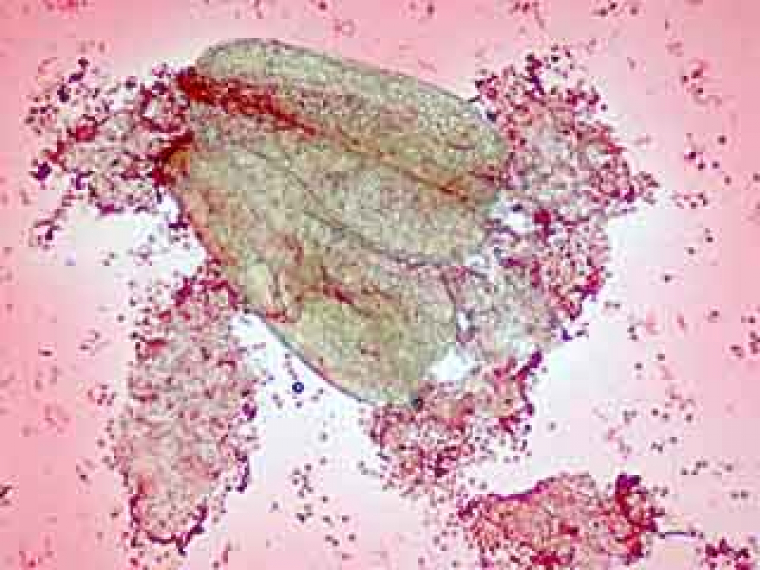
L’ail des ours est une plante commune vivant en peuplement important (figure 1). Elle fleurit en juin-juillet dans les lieux humides. Dans le bassin parisien, cette espèce pousse sur les sols calcaires marneux des chênaies ainsi que dans les forêts bordant des cours d’eaux sur alluvions. Si la plante fleurit vers juin-juillet, les réductions chromatiques se déroulent fin mars, lors de la sortie de terre de la hampe florale. L’inflorescence au bon stade est accessible facilement, il suffit de la cueillir lorsque la hampe florale apparaît (figure 2). Cette inflorescence est constituée de fleurs à différents stades de développement, on peut ainsi observer des stades de méiose différents.
Choix des anthères
À partir des inflorescences récoltées, on va choisir les anthères qui seront utilisées pour préparation ultérieure. Pour cela on va disséquer les étamines pour sélectionner les anthères qui permettront d’observer des figures de méiose (figures 3 à 6).
Cette jeune fleur provient des inflorescences de la figure précédente.
Echelle: un côté d'un carreau mesure 1 mm
On peut voir un pétale en arrière-plan.
Echelle: un coté d'un carreau mesure 1 mm
Sur cette anthère de couleur uniforme on ne peut pas distinguer, par transparence, les microsporocytes (cellules mères des microspores).
Cette étamine présente des anthères à un stade de maturité trop avancé pour y observer des figures de méiose.
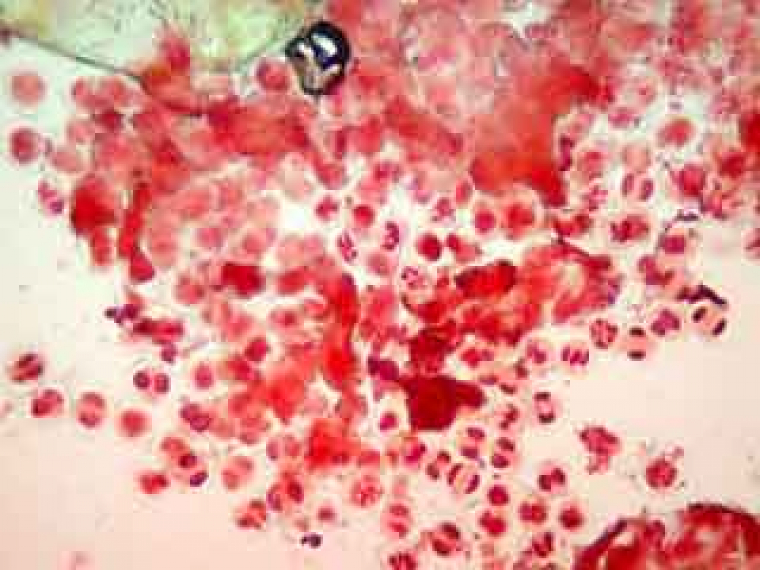
Dans les anthères trop âgées pour une observation, les grains de pollen qui sont déjà constitués colorent les anthères. Les anthères aux bons stades présentent une couleur verdâtre uniforme. Il convient cependant de vérifier si les anthères sont réellement au bon stade en faisant des essais de coloration, car les anthères trop jeunes présentent aussi cet aspect. Pour cela, monter une étamine dans la solution colorante choisie, appliquer une lamelle et écraser l’étamine en tapotant la lamelle avec un bout d’allumette. Le tissu sporogène a une consistance propre plus molle que celle du cadre rigide qui l’entoure (qui constituera l’assise mécanique ou endothélium). Les CMP sont dépourvues de paroi épaisse, ce qui facilite leur étalement, et, avec un peu d’habitude, permet de les distinguer des autres éléments des tissus de l’anthère. Lors de l’écrasement des loges de l’anthère entre lame et lamelle, les CMP sont éjectées (figure 7).
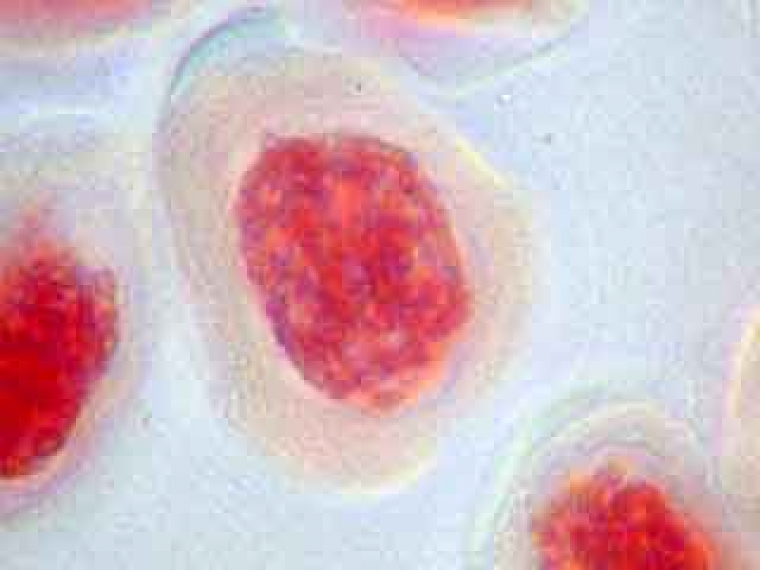
A plus fort grossissement, les cellules mères du pollen sont parfaitement visibles.
A droite d'une CMP, on distingue un "fantôme" de CMP.
Ce groupe de chromosomes est peut-être issu du "fantôme" de CMP visible sur la figure précédente.
On ne distingue pas la membrane plasmique ni la paroi qui les entouraient.
Si les anthères qui apparaissent comme les plus jeunes (les plus petites) sont déjà trop âgées, de même que si les anthères les plus âgées (les plus grandes) sont encore trop jeunes, on peut éliminer l’inflorescence.
Préparation des anthères
Matériels et instruments
- Une à deux paires de pinces fines
- Une loupe binoculaire pour la dissection des fleurs
- Microscope avec objectifs de grossissement 16, 40 et 100
- Huile à immersion
- Gants nitrile ou gant latex non poudrés (ne jamais utiliser de gants poudrés en latex)
- Petit rectangle de papier filtre (environ 55 mm x 62 mm). On obtient ce format en pliant 6 fois en deux une feuille de papier filtre de 420 mm x 520 mm. L’empilement de trois à quatre morceaux de papier filtre suffisent à absorber l’excès de colorant et évite ainsi de se tacher les doigts en manipulant la lame.
- Lamelles, format de 18 mm x 18 mm à 20 mm x 20 mm
- Lames
- Agitateur de diamètre 5 mm (permet de déposer des gouttes de colorant d’une taille adéquate)
- Vernis à ongles transparent (facultatif)
La fixation
Une fois coupées, on peut conserver les inflorescences pendant une petite journée, mais il est préférable de fixer le matériel rapidement. La fixation permet de disposer du matériel adéquat au cours de l’année. Elle renforce la structure des CMP, de plus elle permet de faire apparaître la zone du fuseau et participe à un début d’hydrolyse des parois entre les CMP, ce qui rend l’écrasement plus facile à réaliser.
Le fixateur est composé de 1 volume d’acide acétique glacial (c’est-à-dire pur) pour 3 volumes d’éthanol absolu, et doit être préparé et utilisé dans la journée (attention, les deux composants sont inflammables et l’acide acétique est corrosif). Pratiquement, enlever les bractées de l’inflorescence et garder le moins possible de la hampe florale (ceci favorise une fixation rapide). Utiliser 2 à 5 fois plus de volume de fixateur que de volume du matériel à fixer. Fixer environ 16 à 24 h.
Une fois fixées, laver les inflorescences pour retirer l’acide acétique. Pour cela, mettre des gants et enlever le fixateur, puis éponger avec du papier filtre. Pour les petites quantités de fixateur que vous utiliserez, diluez le fixateur usagé dans au moins 20 fois son volume d’eau, et passez à l’eau le papier imbibé d’acide acétique avant de le jeter. Faire alors tremper les inflorescences dans une grande proportion d’alcool à 70 % (3 à 4 fois le volume de matériel), durant 5 minutes. Renouvelez l’opération deux fois en tout.
Un des avantages de la fixation puis du lavage est la possibilité de conserver un à deux ans le matériel.
La coloration
On peut utiliser des solutions colorantes contenant soit du carmin acétique, soit de l’orcéine acétique, auxquels on ajoute du saccharose et de la gélatine, ce qui permet de conserver les préparations plus longtemps et rend les manipulations plus aisées. L’orcéine se conserve mieux en solution concentrée, que l’on dilue à l’usage.
Préparation de l’orcéine acétique selon Zirkel (1940) :
- Sous hotte et dans un bain-marie bouillant, chauffer doucement jusqu’à ébullition commençante la solution suivante : acide acétique 50 mL, orcéine 1 g (l’utilisation d’un tube à refoulement limite les émanations gazeuses d’acide acétique).
- Laisser refroidir.
- Filtrer. Cette solution peut se conserver au réfrigérateur.
- La veille de l’emploi, dissoudre 2 g de saccharose et 2 g de gélatine dans 11 mL d’une solution composée d’acide acétique 45 % v/v et d’eau 55 % v/v. Ajouter 9 mL de la solution mère.
Préparation du carmin acétique selon Zirkel (1940) :
- Préparer la solution colorante suivante : eau 55 mL, acide acétique 45 mL, carmin 1 g.
- Faire chauffer sous hotte, à ébullition commençante, durant 5 heures (l’utilisation d’un tube à refoulement limite les émanations gazeuses d’acide acétique et permet de limiter la perte par évaporation).
- Filtrer.
- La veille de l’emploi, dissoudre à chaud, pour 20 mL de la solution, 2 g de saccharose et 2 g de gélatine.
Ces solutions (orcéine ou carmin) se conservent. Toutefois il est bon de s’assurer de l’absence de précipités gênants en réalisant un essai de coloration, préalablement au TP.
Procédure de coloration :
- Disséquer la fleur pour recueillir les étamines. Placer au plus deux étamines par lamelle.
- Déposer une goutte de colorant.
- Laisser 5 à 10 minutes puis écraser sous une lamelle.
- Mettre les gants et éponger le surplus de colorant à l’aide de plusieurs épaisseurs de papier filtre.
Variation de la méthode suivant le choix du matériel végétal :
Les protocoles décrits sont une adaptation de protocoles de recherche mis au point pour le comptage de chromosomes. Ils permettent la visualisation des figures de méiose mais ne sauraient remplacer les protocoles originaux dans une expérience de comptage.
Certaines espèces ont des anthères qui doivent être hydrolysées par un séjour de 5 minutes dans une solution d’acide chlorhydrique 1 N puis lavées, épongées et colorées.
La conservation
On peut utiliser le matériel, fixé puis transféré dans de l’alcool à 70 %, pendant environ un an et demi pour distinguer les figures de méiose.
Au bout d’un an et demi, avec une conservation à la température de la pièce, et après filtration, les solutions à l’orcéine ou au carmin (d’après Zirkel modifié) ont conservé leur pouvoir colorant des chromosomes. Avant chaque utilisation, vérifier l’absence de précipité dans la solution colorante. Faire un essai, parfois la présence de précipité n’est pas gênante.
Les préparations peuvent se conserver une à deux semaines sans problème. Il est donc possible de conserver des montages particulièrement démonstratifs d’un TP à un autre.
Les résultats
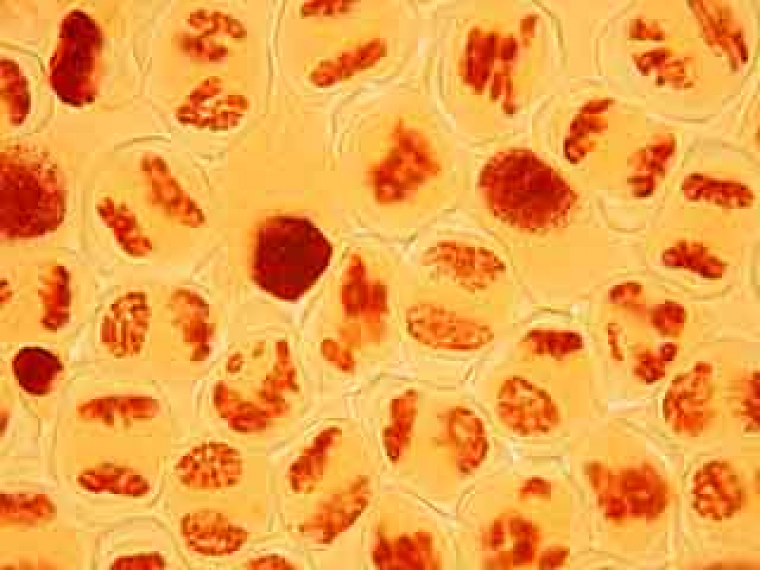
Résultats d’observations de cellules mères du pollen d’Allium ursinum.
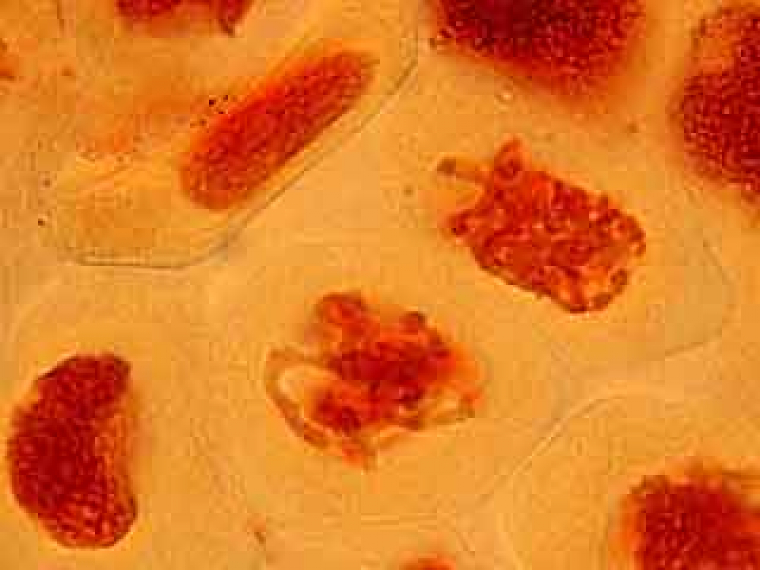
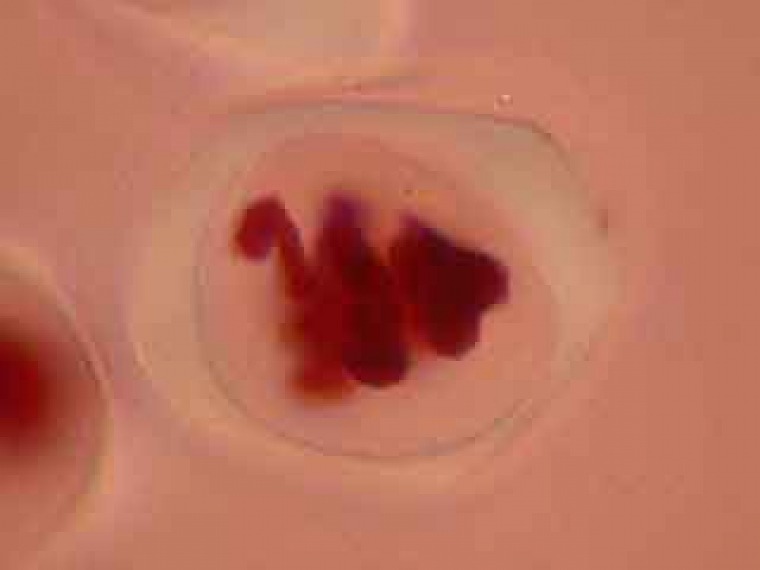
C'est par une observation au faible grossissement que l'on cherche les cellules présentant des figures de méiose intéressantes.
L'ascension des chromosomes aux pôles de la cellule étant très rapide, il est rare d'obtenir une image d'une cellule avec des chromosomes en cours de migration.
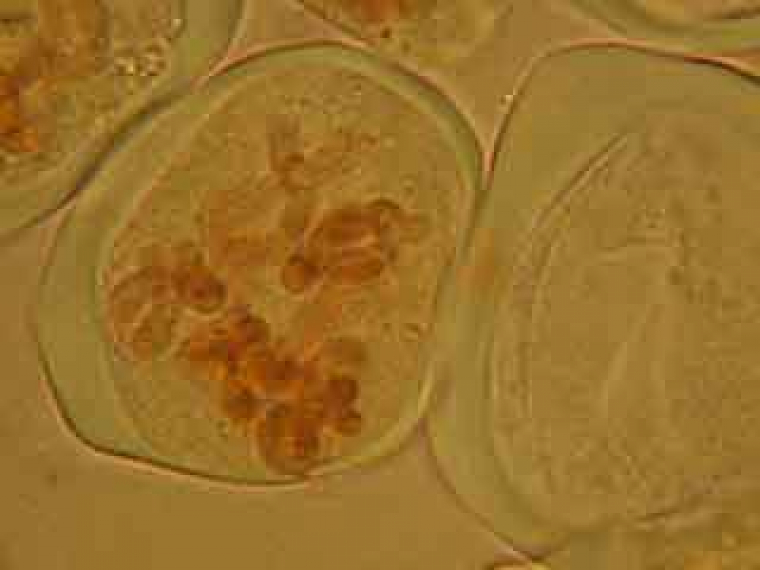
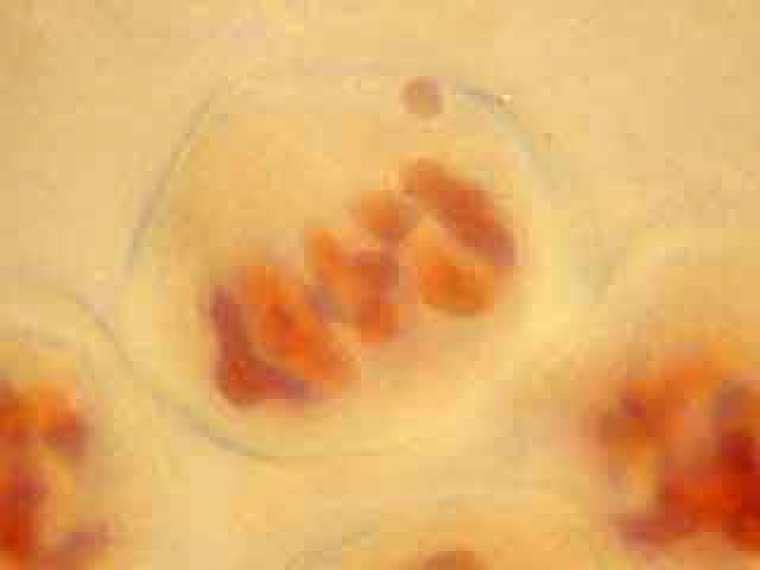
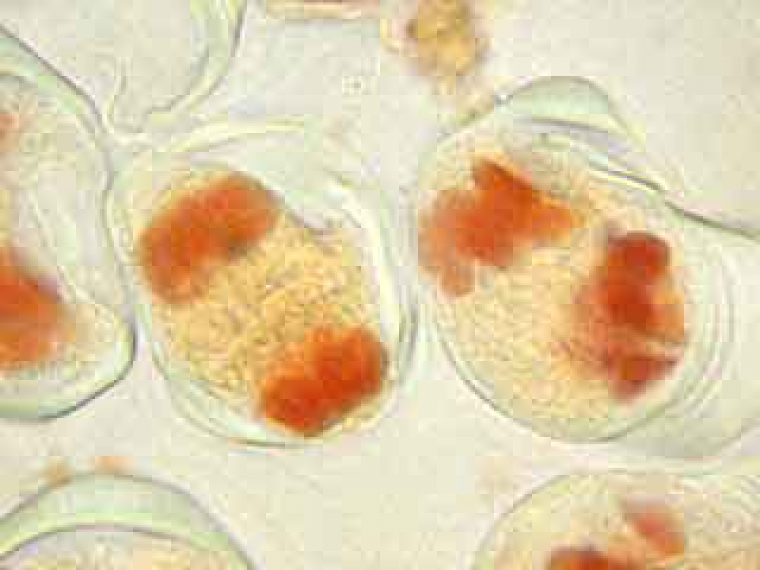
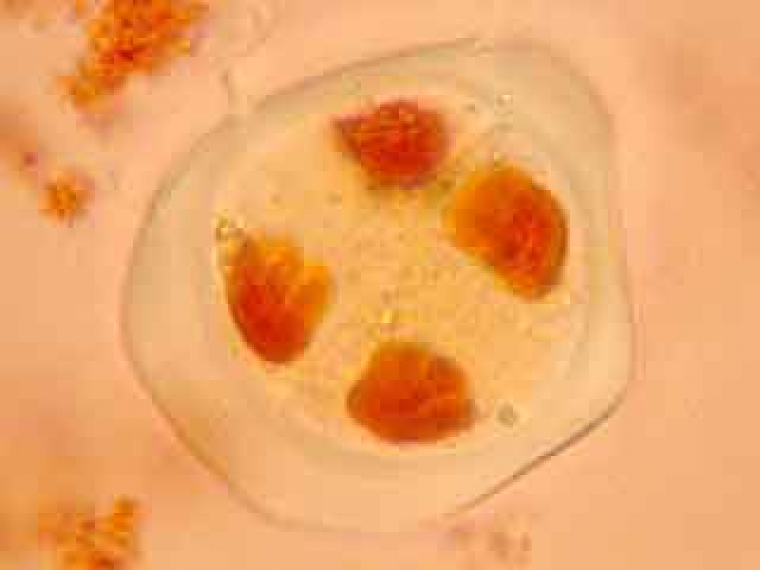
On peut observer le fuseau et deviner le début de formation du phragmoplaste.
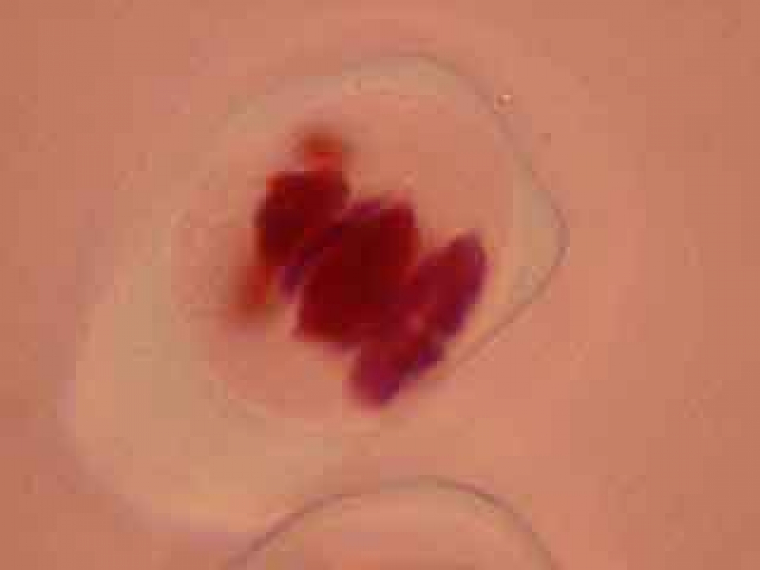
Dans la cellule mère du pollen de gauche, on distingue nettement le phragmoplaste.
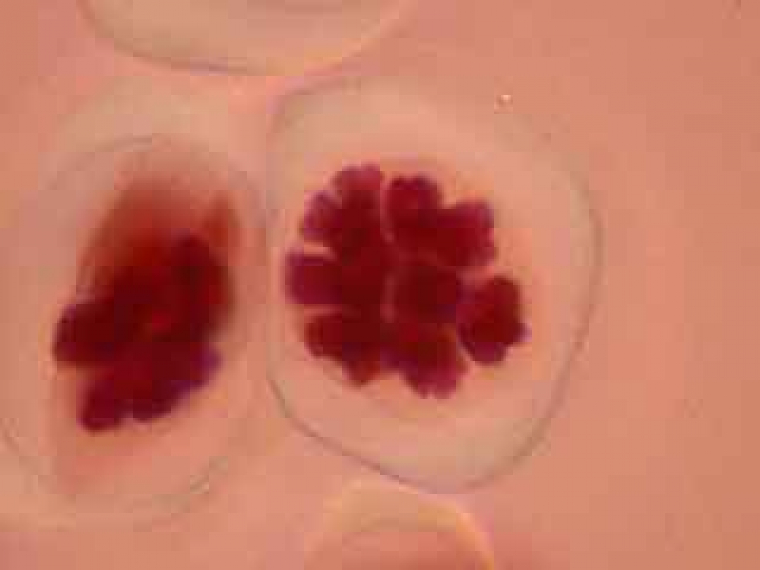
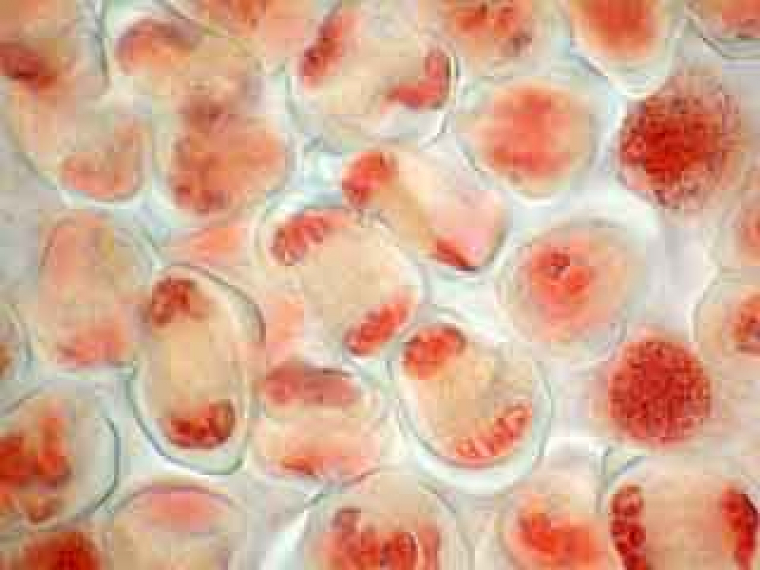
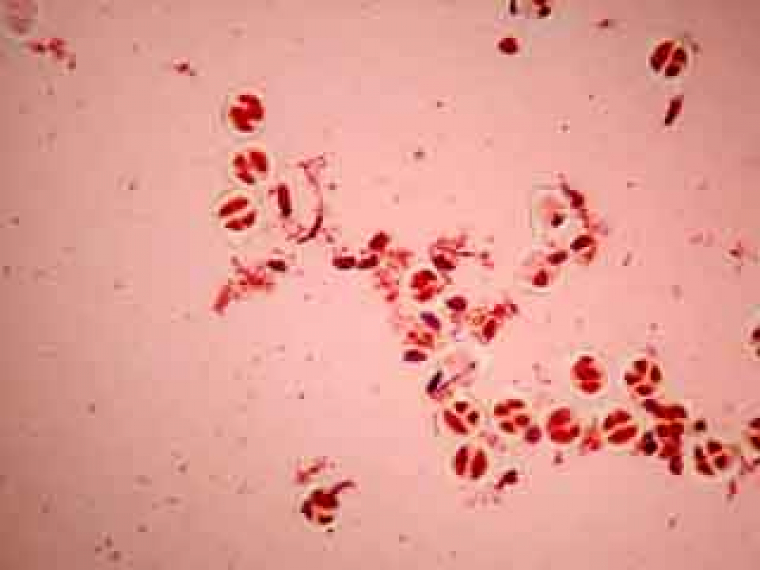
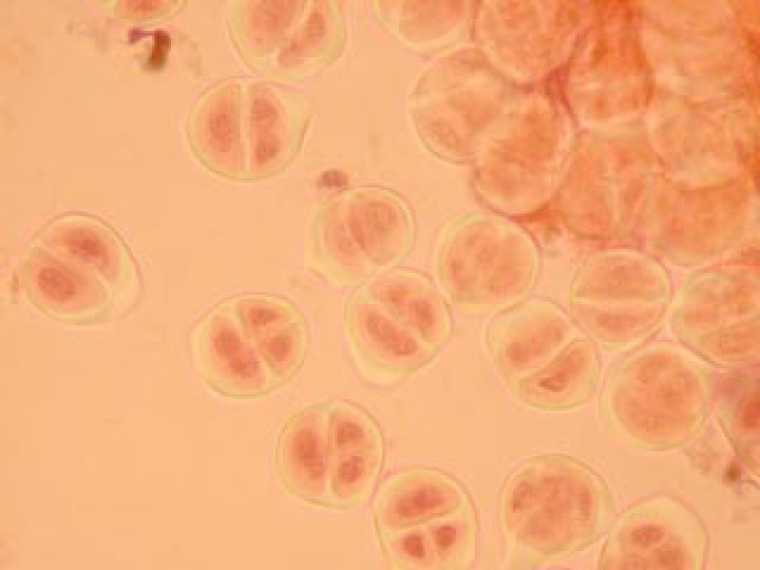
Selon les cellules, il est possible de distinguer deux, trois ou quatre noyaux.
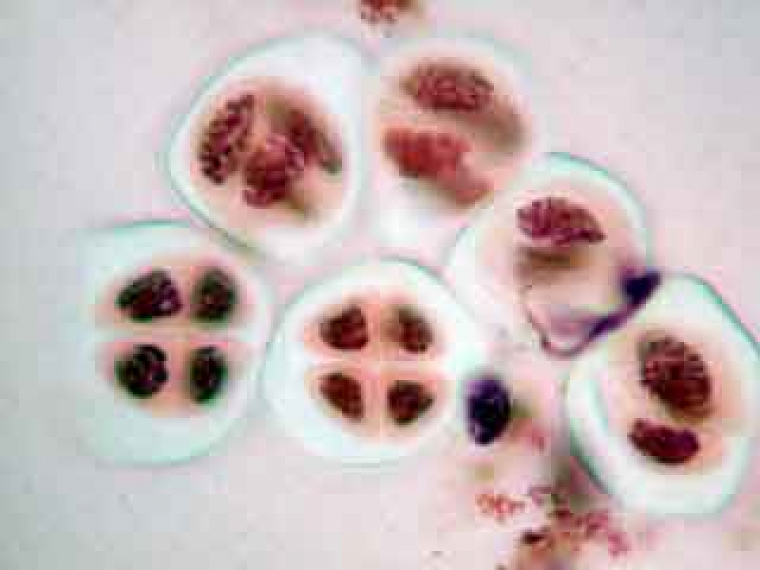
Selon l'orientation des cellules mères du pollen, on distingue nettement les quatre noyaux (cellules en bas à gauche) ou bien certains d'entre eux sont en partie masqués par les autres (cellules en haut à gauche).
Autre matériel végétal adapté
Sur cette plante entière on distingue les fleurs épanouies, dont le pollen, à ce stade, est déja constitué.
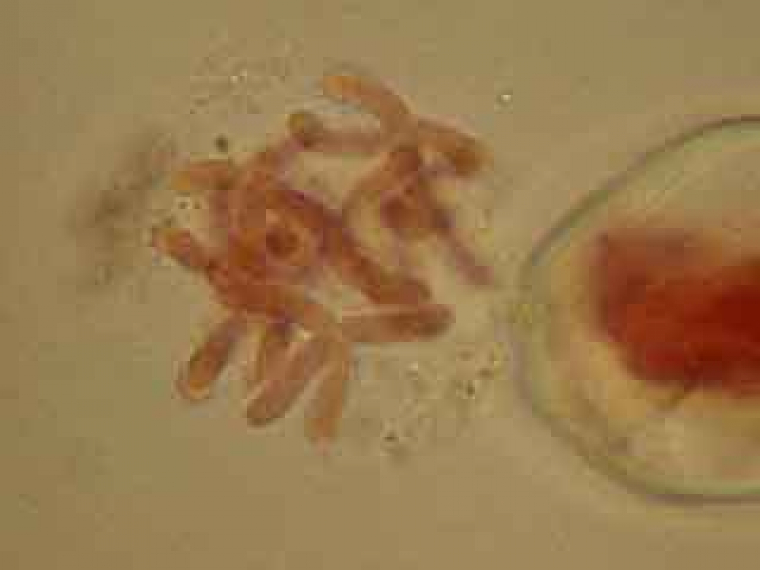
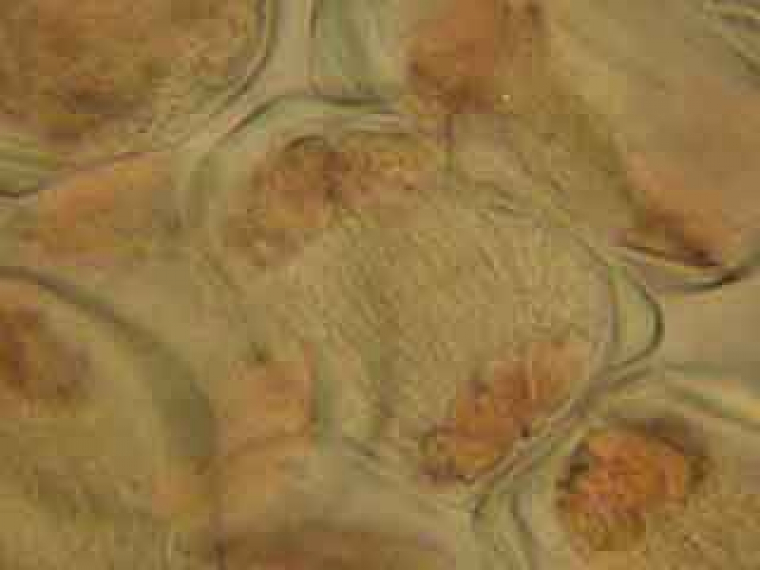
On peut également utiliser une espèce proche de l’ail des ours, Allium schœnoprasum L, une espèce sauvage qui est cultivée sous le nom de cive ou civette ou encore ciboulette (figure 25). Selon les populations, le nombre 2n de chromosomes peut être 16, 24 ou 32. Elle fleurit en plaine vers la mi-avril. C’est avant que les fleurs ne s’épanouissent hors des bractées de l’inflorescence (figure 26) que les étamines présentent des figures de méiose (figure 27).
C'est à ce stade de l'inflorescence qu'il est possible d'observer des méioses dans les cellules mères du pollen.
Les cellules mères du pollen observables ici sont en méiose II
Conclusion
Les figures de méiose végétale sont plus difficiles à obtenir que les figures de mitose, principalement parce que la fenêtre temporelle pendant laquelle se déroule la méiose est courte.
La méthode proposée ici, en permettant la conservation d’anthères pendant plus d’un an, permet de s’affranchir de cette difficulté. Ainsi, l’étude de la méiose peut se dérouler selon des modalités proches de celle de la mitose, avec réalisation personnelle des préparations observées, sans être dépendante du calendrier.
Bibliographie
Techniques de microscopie
- GAGNIEU A. et LAISNÉ G. (1949) L’observation des chromosomes. Sedes.
- DARLINGTON C.D. et LACOUR L.F. (1962) Handling of chromosomes. Allen et Unwin.
- FUKUI K. et NAKAYAMA S. (1996) Plant chromosomes, Laboratory methods. CRC Press, ISBN 0-8493-8919-4.
- PRAT R. (1993 pour la 1ère édition) L’expérimentation en physiologie végétale. Hermann
Livres généraux traitant de la méiose
- RAVEN P.H., EVERT R.F. et EICHORN S.E. (2003) Biologie végétale, 1ere édition. De Boeck université, ISBN 2-7445-0102-6.
- ALBERTS B. (2004) Biologie moléculaire de la cellule. Flammarion. Médecine sciences, ISBN 2257161211.
- GUINOCHET M. (1965) Notions fondamentales de botanique générale à l’usage des candidats de SPCN. Masson.
- ROBERT D., DUMAS C. et BAJON C. (1994) La reproduction. Doin, ISBN 2704006946.
- ROLAND J.C., VIAN B. et ROLAND F. (1989) Organisation des plantes à fleurs. Masson, ISBN 2225809917.
- KLEIMAN C. (2001) La reproduction des Angiospermes. Belin, ISBN 2-7011-2849-8.
Liens sur le web
- Réalisation de préparations microscopiques de mitose : une méthode sûre, rapide et peu coûteuse . La méthode de coloration est légèrement différente. On peut conserver pour l’observation des figures de mitose les solutions préconisées ici.
- Pour ceux qui ne pourraient pas se procurer le livre de GUINOCHET, ce site : « The modern synthesis » (Botany-online, en anglais) contient des informations sur la variabilité de la ploïdie, variabilité inter mais aussi intra spécifique, en particulier la page sur les caryotypes.