Cet article présente, à l'aide de schémas et d'animations, la structure fine du muscle squelettique et les mécanismes moléculaires à l'origine de la contraction, ainsi que leurs particularités dans le cas du muscle cardiaque.
Les muscles sont des organes chargés de convertir l’énergie chimique en énergie mécanique. Il existe différents types de muscles selon leur organisation et leur modalité de fonctionnement (voir l’article Différences muscle squelettique - muscle cardiaque). À de rares exceptions près, la commande du fonctionnement de ces organes se fait par voie nerveuse.
Ce document présente la cascade d’évènements qui, partant d’un potentiel d’action, permet la contraction musculaire.
Structure fine des filaments fin et épais
Les muscles striés ont une structure remarquablement organisée basée sur la répétition d’un motif structural, appelé sarcomère, composé de deux sortes de filaments : les filaments fins et les filaments épais.
Les filaments fins
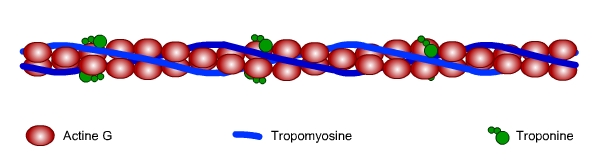
Les filaments fins ont un diamètre d’environ 7 nm et sont constitués de plusieurs types de molécules : l’actine, la tropomyosine et la troponine.
L’actine monomérique (ou actine G pour Globulaire) est une molécule globulaire de 42 kDa pouvant polymériser pour former des filaments (actine F pour Filamenteuse). Les filaments d’actine sont composés de deux chaînes linéaires qui s’enroulent l’une autour de l’autre pour former une double hélice (fig. 1).
La tropomyosine est une protéine allongée homodiégétique ou hétérodimèrique, chaque monomère étant constitué de 284 acides aminés adoptant une structure en hélice alpha s’enroulant l’une autour de l’autre pour former une super-hélice. Elle va se lier à l’actine en se logeant au creux des sillons de la double hélice formée par l’actine (fig. 1). À l’état de repos, les molécules de myosine (voir les filaments épais ci-dessous) sont également en contact avec la tropomyosine.
À chaque extrémité d’une molécule de tropomyosine, soit un intervalle correspondant à 7 molécules d’actine, une molécule de troponine vient se lier avec la tropomyosine (fig. 1). La troponine est une molécule composée de 3 chaînes respectivement dénommées troponine-T, troponine-I et troponine-C. Chaque chaîne possède une fonction différente :
- la troponine-T est responsable de la liaison troponine-tropomyosine ;
- la troponine-I possède une activité inhibitrice de l’activité ATPasique de la myosine ;
- la troponine-C possède 4 sites de fixation pour le calcium qui, lorsqu’ils sont occupés, lèvent l’action de la troponine I.
Les filaments épais
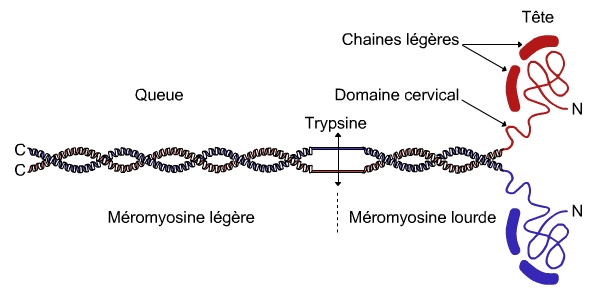
Les filaments épais ont un diamètre d’environ 15 nm et sont essentiellement constitués d’une espèce moléculaire, la myosine II.
La myosine II est une molécule allongée de 2 × 240 kDa composée de deux chaînes lourdes (environ 200 kDa chacune) et de quatre chaînes légères (environ 20 kDa chacune). Chaque chaîne lourde est constituée d’une queue C-terminale allongée et fibrillaire en hélice alpha, d’une tête globulaire N-terminale enzymatique à activité ATPasique associée à deux chaînes légères, et d’un domaine cervical déformable reliant les deux extrémités. Tête globulaire et partie cervicale forment la méromyosine lourde, la partie fibrillaire caudale formant la méromyosine légère. Les queues allongées de deux chaînes lourdes de myosine s’enroulent l’une autour de l’autre en une superhélice, les deux têtes globulaires se trouvant côte à côte (voir fig. 2).
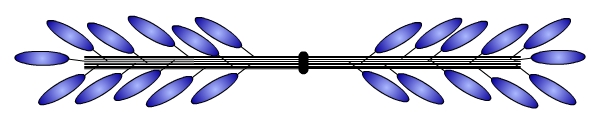
Plusieurs centaines de molécules de myosine II s’assemblent pour former un filament épais. Les parties caudales de ces molécules sont rassemblées parallèlement. Les têtes globulaires dépassent en périphérie de ce filament et sont donc disponibles pour pouvoir se fixer aux filaments d’actine. Les molécules de myosine étant disposées en deux groupes tête-bêche, la partie centrale du filament (correspondant à la strie M) est dénudée, c’est-à-dire dépourvue de tête globulaire (voir fig. 3).
Le couplage excitation – contraction
L’évènement déclenchant de la contraction musculaire est une augmentation de la concentration intracellulaire en calcium. Au repos, cette concentration est d’environ 0,1 μmol.L-1. Lors d’une stimulation, cette concentration peut grimper jusqu’à 0,1 mmol.L -1 soit une augmentation d’un facteur 1000. Le couplage excitation – contraction correspond aux mécanismes permettant cette forte augmentation. Dans les muscles squelettiques, cette augmentation est majoritairement due à la libération massive d’ions calcium stockés dans le réticulum sarcoplasmique.
L’arrivée d’un potentiel d’action dans la terminaison nerveuse d’un neurone moteur déclenche la libération du neuromédiateur (de l’acétylcholine) dans la fente synaptique. Après diffusion dans l’espace inter synaptique, l’acétylcholine va se lier à son récepteur spécifique, le récepteur nicotinique de l’acétylcholine. Celui-ci est un récepteur canal cationique ouvert par la présence de son ligand. Son ouverture entraîne la dépolarisation locale de la membrane post-synaptique musculaire (pour plus de détails sur fonctionnement de la synapse cholinergique, voir cette animation). Le potentiel de plaque excitateur ainsi généré va provoquer la naissance d’une vague de dépolarisation propagée sur tout le sarcolemme (membrane plasmique musculaire) correspondant à un potentiel d’action musculaire. Cette propagation est due à l’ouverture de canaux sodiques et calciques voltages dépendants selon un décours temporel précis. Les canaux calciques impliqués sont les canaux de type L, également appelés récepteurs aux dihydropyridines (DHPR), qui ont comme caractéristique d’être à inactivation lente (d’où le nom de canaux de type L, pour Late). On a donc un influx de calcium extracellulaire augmentant la concentration intracellulaire.
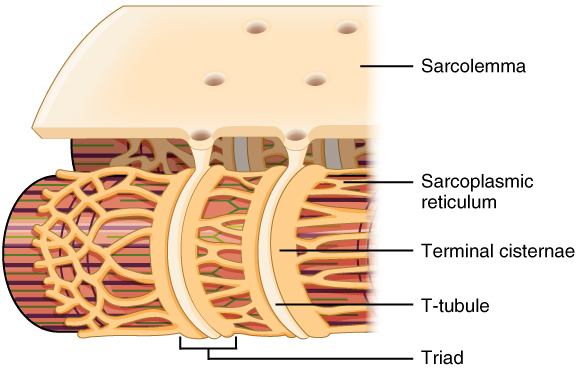
La membrane plasmique des fibres musculaires, également appelée sarcolemme, présente des invaginations appelées tubules T qui entrent en contact avec le réticulum sarcoplasmique de la cellule pour former des structures appelées triades.
Par ailleurs, la vague de dépolarisation pénètre au cœur de la cellule par l’intermédiaire des tubules transverses. Or, ceux-ci sont au voisinage immédiat des citernes terminales du réticulum sarcoplasmique au niveau des triades (voir fig. 4) : les deux membranes sont distantes d’environ 15 nm. Dans la membrane des citernes terminales du réticulum sarcoplasmique, on trouve le récepteur à la ryanodine (RyR1). Cette protéine est un canal calcique ayant une forme de trèfle à quatre feuilles qui arrive presque au contact de la membrane des tubules transverses. La dépolarisation de la membrane et l’augmentation de la concentration intracellulaire en calcium, due à l’ouverture des DHPR, va entraîner l’ouverture du RyR. Ce couplage, dont on ne connaît pas encore toutes les subtilités, fait intervenir une interaction directe entre le DHPR activé par la dépolarisation de la membrane et le RyR. Cette interaction, va entraîner l’ouverture du RyR, ouverture qui est également favorisée par le calcium et l’ATP. Cela dit, ce résultat est obtenu même en absence de calcium extracellulaire, montrant que la seule dépolarisation de la membrane plasmique suffit à provoquer l’ouverture du RyR. Le DHPR peut ainsi être considéré comme un senseur de dépolarisation entraînant l’ouverture du RyR probablement grâce au lien direct qui existe entre ces deux types de canaux.
Dans la lumière du réticulum sarcoplasmique, le calcium est stocké à des concentrations pouvant atteindre 1 mmol.L-1. Il est en particulier lié à la calséquestrine, une protéine soluble spécifiquement localisée dans les citernes terminales du réticulum sarcoplasmique, qui est capable de lier à basse affinité un nombre important d’ions calcium (50 ions calcium par molécule de calséquestrine). Or, calséquestrine et RyR sont reliés par de la triadine, une protéine soluble. Cette organisation permet un stockage local d’importantes quantités de calcium. L’ouverture des récepteurs de la ryanodine permet un relargage massif du calcium stocké entraînant une élévation très importante de sa concentration cytoplasmique, et ce à proximité immédiate des myofibrilles.
Le raccourcissement des sarcomères
Mouvement relatif des filaments d’actine et de myosine
La contraction musculaire correspond à un raccourcissement des sarcomères dû au glissement relatif des filaments d’actine et de myosine : les deux disques Z délimitant un sarcomère se rapprochent l’un de l’autre. Ce phénomène se produisant simultanément pour tous les sarcomères de la cellule, il en résulte un raccourcissement global de la cellule musculaire selon l’axe longitudinal (voir fig. 5).
| Le glissement relatif des filaments fins d'actine et épais de myosine permet un rapprochement des stries Z, donc un raccourcissement global de la myofibrille. |
L’activation par le calcium
Lorsque la troponine C n’est pas liée à du calcium (et en présence de troponine T et de tropomyosine), la troponine I inhibe l’interaction actine-myosine en faisant occuper par la tropomyosine le site d’interaction de la myosine situé sur l’actine. La liaison de calcium sur la troponine C entraîne un changement de conformation de la troponine, ce qui déplace légèrement la tropomyosine qui lui est liée, démasquant ainsi les sites de liaison actine-myosine. On a donc une levée de l’inhibition de la liaison actine-myosine.
Le cycle ATPasique de l’actomyosine
La suite des évènements peut, en première approximation, être découpée en quatre étapes (voir fig. 6 pour une animation) :
-
Au repos, la myosine est couplée à de l’ADP et du phosphate inorganique (Pi). Après démasquage des sites de liaison de la myosine portés par l’actine en présence de calcium, les têtes de myosine vont se lier à l’actine.
-
Le départ du phosphate inorganique, puis de l’ADP, va stabiliser la liaison actine-myosine et entraîner un changement de conformation de la myosine. L’angle que fait la tête de myosine avec la queue allongée va diminuer de 90° à 45°. Myosine et actine étant liées, ce changement de conformation va entraîner un mouvement relatif entre filaments fins et filaments épais. La configuration obtenue, stable en absence d’ATP, est appelée configuration rigor car elle est à l’origine de la rigidité cadavérique (rigor mortis).
-
La liaison d’une molécule d’ATP sur la tête de myosine entraîne la dissociation de la liaison actine-myosine.
-
Enfin l’hydrolyse de cet ATP en ADP + Pi entraîne un changement de conformation de la myosine : l’angle formé par la tête et la queue de myosine revient à sa valeur initiale. Au final, la tête de myosine s’est donc déplacée vers l’extrémité « plus » du filament d’actine (située côté strie Z).
| Le raccourcissement des sarcomères est du à un cycle de liaison-dissociation entre actine myosine associé à des changements de conformation de la myosine. Ce cycle ne peut se dérouler qu'en présence d'une concentration élevée en calcium (au moins 1 μmol.L-1), nécessaire pour démasquer les sites de liaison de la myosine sur l'actine. |
Ce cycle peut se reproduire aussi longtemps que la concentration en calcium reste élevée. A chaque fois, la myosine se fixe une peu plus près de l’extrémité « plus » du filament d’actine, c’est-à-dire plus près du disque Z. Comme la même chose se produit à l’autre extrémité du filament de myosine, les deux disques Z se rapprochent, ce qui correspond à un raccourcissement du sarcomère (voir fig. 5).
Aspects cinétiques du cycle ATPasique de l’actomyosine
Cette présentation, très linéaire, nécessite d’être étoffée par quelques précisions d’ordre cinétique. En effet, il existe huit configurations possibles entre actine, myosine, ATP, ADP et Pi :
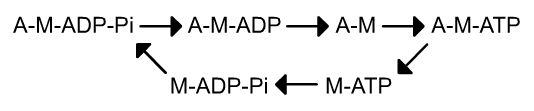
- myosine seule (notée M),
- myosine-ATP (M-ATP),
- myosine-ADP-Pi (M-ADP-Pi),
- myosine ADP (M-ADP)
- actine-myosine (A-M),
- actine-myosine-ATP (A-M-ATP),
- actine-myosine-ADP-Pi (A-M-ADP-Pi),
- actine-myosine-ADP (A-M-ADP)
Dans le modèle décrit dans le paragraphe précédent, ces configurations se succèdent dans l’ordre suivant (fig. 7) :
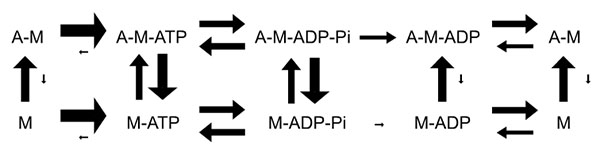
En réalité, même si cet enchaînement est le plus fréquent, d’autres transitions sont possibles, avec des cinétiques variables résumées dans la figure 8 :
Au repos, la myosine ne peut pas être liée à l’actine en raison de l’action inhibitrice de la troponine I. Les seules configurations possibles sont donc celles représentées sur la ligne du bas de la figure 8. On constate que la dissociation de l’ATP (pour donner M) de même que celle du Pi (pour donner M-ADP) sont peu fréquentes (petite flèche). La myosine se trouve donc majoritairement sous-forme M-ATP ou M-ADP-Pi, ce qui correspond à une activité ATPasique réversible.
En présence de calcium, la liaison actine-myosine devient possible. Mais, d’après les cinétiques présentées sur la figure 8, on constate que cette association est rapidement réversible en présence d’ATP (M-ATP ‹-› A-M-ATP) ou d’ADP+Pi (M-ADP-Pi ‹-› A-M-ATP-Pi). On constate également que l’hydrolyse de l’ATP est également rapidement réversible (que la myosine soit liée à l’actine ou non). Il y a donc une transition rapide entre ces quatre états.
En revanche, si le Pi se dissocie (pour donner majoritairement A-M-ADP, le Pi se dissociant lentement de la myosine seule), il n’y a pas de retour possible (pas de flèche). En conséquence, c’est le départ du Pi qui stabilise la liaison actine-myosine. De même, en présence ou en absence d’ADP, il est peu probable que la liaison actine-myosine se dissocie (petites flèches). L’évolution majoritaire et rapide (grande flèche) consiste en l’arrivée d’un ATP (A-M-ATP), la réaction inverse étant très peu probable. Le départ du Pi entraîne donc quasi-automatiquement l’enchaînement des complexes venant d’être décrits, correspondant à la suite des évènements présentée dans le paragraphe précédent.
En résumé, la suite linéaire d’évènements généralement présentée (voir fig. 6) correspond donc en réalité à l’enchaînement des évènements le plus fréquent, mais non exclusif.
Le relâchement du muscle
La contraction musculaire est provoquée par une augmentation de la concentration en calcium intracellulaire, le relâchement est donc obtenu par un retour à la concentration initiale.
L’augmentation de la concentration en calcium intracellulaire ne dure que quelques millisecondes. Le retour à la situation initiale est rapidement obtenu par l’action convergente de trois phénomènes :
- La fermeture rapide des canaux calciques
- La liaison du calcium sur différentes protéines (dont la troponine)
- Le pompage actif vers la lumière du réticulum sarcoplasmique par des ATPases calcium-dépendantes appelées SERCA.
On estime que le temps nécessaire pour ramener le taux de calcium intracellulaire à sa valeur de repos est de l’ordre de 30 ms. La concentration en calcium diminuant, on a dissociation du calcium lié à la troponine C, ceci entraînant le rétablissement de l’inhibition exercée par la troponine I sur la liaison actine-myosine. En conséquence, le muscle se relâche.
Les particularités du contrôle de la contraction musculaire dans le muscle cardiaque
Activité spontanée : les cellules pace-maker
L’ultrastructure du muscle cardiaque est similaire à celle du muscle strié squelettique (voir l'article Différences muscle squelettique - muscle cardiaque), ainsi que le mécanisme de la contraction contrôlée par le calcium. En revanche, la commande déclenchant la contraction est totalement différente puisque le muscle cardiaque est capable de se contracter en absence de toute innervation.
On trouve dans le muscle cardiaque, des canaux différents de ceux trouvés dans le muscle squelettique, aussi bien dans la membrane sarcolemmale que dans le réticulum sarcoplasmique. Dans la membrane sarcolemmale des cellules pace-maker, cellules localisées dans le centre générateur des battements cardiaques, on trouve un canal très particulier dit canal de fuite. Ce canal n’est jamais complètement fermé, même si sa conductance est faible, de sorte qu’il laisse en permanence échapper des ions K+ et entrer des ions Na+. Cette fuite entraîne une dépolarisation lente de la membrane plasmique. Lorsque la différence de potentiel transmembranaire passe la valeur seuil d’activation des canaux voltage-dépendants responsables du potentiel d’action (document en préparation), ces canaux vont s’ouvrir, provoquant l’apparition d’un potentiel d’action classique, mais sans intervention d’un neurone excitateur. Le temps nécessaire pour que la dépolarisation atteigne la valeur seuil dicte le rythme endogène de contraction du muscle cardiaque.
Bien sur, il faut que ce potentiel d’action soit transmis aux autres cellules musculaires cardiaques. Celles-ci étant reliées les unes aux autres par des jonctions communicantes ou jonctions gap (type de jonction reliant les cytoplasmes de deux cellules adjacentes par un pore protéique), cette propagation se réalise sans intervention d’un mécanisme particulier, comme si les différentes membranes étaient en continuité.
La vague de dépolarisation suit un trajet bien précis. Prenant naissance dans le nœud sinusal localisé au niveau de l’oreillette droite près de l’abouchement de la veine cave supérieure, elle se propage dans tout le myocarde, des oreillettes jusqu’au nœud auriculoventriculaire situé à la jonction oreillettes-ventricules. Après un court délai, cette vague de dépolarisation va se propager le long du septum auriculoventriculaire via le tronc du faisceau de Hiss, la branche droite et la branche gauche, les fibres de Purkinje, et enfin dans tout le myocarde ventriculaire à travers les cellules musculaires. L’ensemble nœud sinusal, nœud auriculoventriculaire, tronc du faisceau de Hiss et réseau de Purkinje correspond au tissu nodal composé de cellules musculaires modifiées.
Le couplage excitation-contraction
On trouve dans les cardiomyocytes des isoformes spécifiques du RyR (RyR2 au lieu de RyR1 dans le muscle squelettique) et du DHPR. Leur organisation spatiale en est modifiée, la principale différence étant que ces deux canaux ne sont plus en interaction directe (même s’ils restent à proximité). De ce fait, les DHPR ne peuvent pas provoquer directement l’ouverture des RyR2.
La vague de dépolarisation qui parcours la membrane plasmique ouvre les DHPR. Des ions calcium extracellulaires entrent dans la cellule, provoquant une petite augmentation de la concentration intracellulaire en calcium. Cette augmentation va directement agir sur les RyR2, entraînant leur ouverture et la libération massive des ions calcium stockés dans le réticulum sarcoplasmique. Ce mécanisme est appelé « Calcium-Induced Calcium Release » pour « libération du calcium induite par le calcium ». Cela explique une des grosses différences de comportement expérimental entre muscle squelettique et muscle cardiaque : le muscle squelettique continue à pouvoir se contracter en absence de calcium extracellulaire (le DHPR activé pouvant directement ouvrir le RyR1), ce qui n’est pas le cas du muscle cardiaque.
Conclusion
Dans le mécanisme assurant la contraction musculaire, l’élément clef de la régulation est l’ion calcium. Mais ce qui est frappant, c’est de voir à quel point l’organisation ultra structurale est essentielle dans le fonctionnement de cette cellule : triades permettant la libération massive d’ions calcium ; organisation des sarcomères permettant le raccourcissement de la cellule ; sans même parler de l’organisation ultra structurale de la jonction neuromusculaire.