L'EPO est une molécule naturellement produite par l'organisme en situation d'hypoxie et qui stimule la production de globules rouges. Des dérivés de cette molécule peuvent être utilisés en médecine mais également en tant que produits dopants.
Cet article est une mise à jour majeure de celui initialement publié par Gilles Camus en mai 2012.
Rôles physiologiques de l’EPO
L’EPO contrôle la production des globules rouges
L’érythropoïétine, ou EPO, contrôle la production de globules rouges dans l’organisme. C’est une hormone indispensable à l’érythropoïèse, le mécanisme qui, à partir de cellules souches, aboutit à la production d’hématies (également appelées érythrocytes ou globules rouges).
Cette activité hormonale a été décelée dans le sérum d’animaux anémiques dans les années 1890. Le rôle de l’érythropoïétine a été suggéré dès 1906 et de nombreuses études ont tenté de l’isoler depuis les années 1950. Ce n’est qu’à la fin des années 1970 que Miyake et Goldvasser réussirent à obtenir de l’EPO purifiée à partir de l’urine de patients anémiés.
L’érythropoïèse est un phénomène qui se produit, chez l’adulte, dans la moelle rouge de certains os (moelle hématopoïétique) et est contrôlé positivement et négativement par des glycoprotéines appartenant à la famille des cytokines.
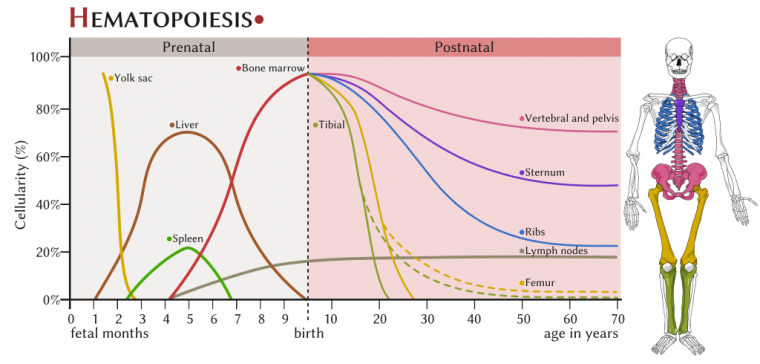
L’hématopoïèse (ou érythropoïèse) est l’ensemble des phénomènes qui concourent à la fabrication et au remplacement, continu et régulé, des cellules sanguines.
Au cours de la vie intra-utérine, l’hématopoïèse a d’abord lieu dans le tissu conjonctif (jusqu’au 2e mois), puis prend place dans le foie et la rate (du 2e au 6e mois). Elle devient médullaire (dans les os) à partir du 4e mois, coïncidant avec le développement des ébauches des os.
Chez l’adulte, la moelle hématopoïétique se rencontre essentiellement au niveau du sternum, des clavicules, des vertèbres, des os du bassin et des os plats du crâne.
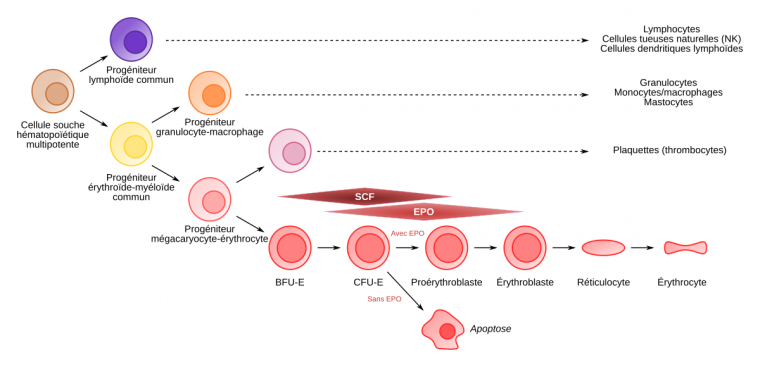
L’érythropoïétine, ou EPO, est une cytokine qui stimule à la fois la prolifération et la différenciation des cellules progénitrices érythropoïétiques.
Les progéniteurs érythroïdes les plus précoces, appelés BFU-E (burst forming unit-erythroid, ainsi nommés car, in vitro, en milieu semi-solide, ils produisent des colonies éclatées en multiples agrégats) requièrent la présence de SCF (stem cell factor) et d’EPO. Ils donnent naissance aux CFU-E (colony forming unit-erythroid) qui eux, sous le contrôle strict de l’EPO, vont se différencier en cellules morphologiquement identifiables de la lignée érythroïde : les proérythroblastes. Ces derniers se différencient alors en érythroblastes basophiles, puis polychromatophiles et acidophiles.
L’énucléation des érythroblastes acidophiles donne naissance aux réticulocytes qui maturent finalement en globules rouges.
Les cellules souches hématopoïétiques (CSH) multipotentes donnent naissance à tous les types cellulaires que l’on trouve dans le sang.
Elles produisent des progéniteurs lymphoïdes communs (en violet) et des progéniteurs érythroïdes-myéloïdes communs (en jaune).
Ces derniers sont à l’origine de toutes les cellules de la lignée myéloïde : granulocytes, monocytes, plaquettes, érythrocytes et cellules dendritiques myéloïdes.
On a donc une spécialisation croissante : on passe de cellules multipotentes (CSH) à des cellules pluripotentes, puis unipotentes (à partir de BFU-E, burst forming unit-erythroid), et enfin des cellules spécialisées (érythrocytes).
Les BFU-E requièrent la présence de deux cytokines, SCF (stem cell factor) et EPO. Ils donnent naissance aux progéniteurs CFU-E (colony forming unit-erythroid). L’EPO est la seule cytokine intervenant sur les phases finales de production des hématies (à partir du stade BFU-E le récepteur de l’EPO commence à être exprimé, avec un maximum d’expression au stade CFU-E).
L’EPO est une cytokine
L’EPO est la principale cytokine impliquée dans la production des globules rouges de l’organisme, mais ce n’est pas la seule. D’autres facteurs de croissance agissent : les IL (interleukines), le GM-CSF (granulocyte macrophage – colony stimulating factor), le SCF (stem cell factor) et l’IGF-1 (insulin-like growth factor).
Les cytokines correspondent à des protéines ou glycoprotéines, comparables aux hormones, qui peuvent être membranaires, ou sécrétées suite à une stimulation, et qui interviennent dans la communication cellulaire. Elles sont une centaine et classées selon leur structure tridimensionnelle.
Les cytokines sont des molécules définies comme étant généralement produites par les cellules immunitaires et ayant une action sur ce système ainsi que sur l’hématopoïèse. Cette classe de messagers chimiques se distingue globalement des hormones par certaines caractéristiques : nombre important de types de cellules productrices, large distribution des cellules cibles, effets pléiotropes, grande amplitude de variation des concentrations plasmatiques selon les conditions physiologiques, modes d’action variés (autocrine, paracrine et endocrine). Cela dit, il existe des discussions entre spécialistes sur l’étendue de cette classe et les messagers qui doivent y figurer.
Il existe une relation très étroite entre la quantité de dioxygène apportée aux tissus, la concentration d’EPO dans le sang et le nombre de globules rouges circulants : en cas d’hypoxie, la synthèse d’EPO augmente.
L’hypoxie tissulaire peut être consécutive à une anémie ou à une hémorragie (un abaissement du nombre de globules rouges entraîne un abaissement du taux d’hémoglobine Hb et une diminution de la capacité de transport du dioxygène vers les tissus) ou à une diminution de la pression partielle artérielle en dioxygène (par exemple lors d’un séjour en altitude). Le taux d’EPO plasmatique augmente exponentiellement avec la diminution de la concentration sanguine d’hémoglobine (les valeurs d’EPO peuvent passer de 15 à 10 000 UI/L).
L’unité EPO ou UI EPO (unité internationale EPO)
Par définition 1 unité EPO entraîne la même stimulation de l’érythropoïèse chez les rongeurs (historiquement le rat à jeun) que 5 micromoles de chlorure de cobalt. Cette unité est préférentiellement utilisée, plutôt que sa masse, du fait du mélange de plusieurs molécules similaires mais non identiques, dans les préparations d’érythropoiétine recombinante utilisées actuellement. Pour l’époétine-alpha, 1000 UI d’EPO sont équivalents à 8,4 microgrammes.
L’hypoxie tissulaire entraîne une stimulation de la production d’EPO par l’organisme. Les organes producteurs d’EPO sont principalement les reins (80 à 90 % de la production totale d’EPO est réalisée par les cellules fibroblastiques péritubulaires situées dans le cortex du rein) mais également le foie. Durant la vie fœtale c’est le foie qui produit l’EPO.
Il existe, au niveau des cellules productrices d’EPO (ou dans leur environnement immédiat) un système permettant de déceler les variations de la concentration en dioxygène. L’hypoxie induit, dans ces cellules, la transcription du gène de l’EPO dans un délai de deux heures. En cas d’hypoxie, une molécule, HIF (hypoxia-inducible factor, protéine hétérodimère dont la sous-unité alpha est régulée par l’hypoxie), pénètre dans le noyau et, après dimérisation avec la sous-unité bêta, active le complexe de transcription du gène de l’EPO. La sécrétion de la protéine nouvellement formée est immédiate (il n’y a pas de réserve intracellulaire d’EPO). L’EPO va alors stimuler l’érythropoïèse en provoquant la prolifération et la différenciation des BFU-E en érythroblastes.
Un adulte standard possède environ 2,5 × 1013 globules rouges (4-5 × 1012 globules rouges/litre de sang) qui ont une durée de vie moyenne de 120 jours (et une demi-vie moyenne de 28 jours). Pour en assurer le renouvellement, l’organisme produit donc environ 2 × 1011 globules rouges par jour, soit 2,5 millions par seconde. En condition d’oxygénation normale des tissus, l’érythropoïèse se déroule en 5 jours à partir du proérythroblaste, mais cette durée peut-être raccourcie à 2 jours sous l’action de l’EPO.
D’autres effets de l’EPO sont moins connus car non-associés au dopage. L’EPO intervient notamment dans la cicatrisation. Dans le cerveau, l’EPO exerce un effet neurotrophique et neuroprotecteur. Il intervient dans la réparation des dommages consécutifs à un accident vasculaire cérébral.
L’EPO s’oppose à l’apoptose
Le rôle de l’EPO est de protéger les progéniteurs érythroïdes (notamment au stade CFU-E) de l’apoptose. Lorsque les globules rouges sont en nombre suffisant, le taux d’EPO diminue et les progéniteurs médullaires meurent. À l’inverse lorsque leur nombre est insuffisant, les concentrations d’EPO augmentent et les cellules sont sauvées de la mort.
C’est la présence ou l’absence d’EPO qui détermine, pour le progéniteur, l’entrée en différenciation ou en apoptose (voir Figure 2).
La similitude de certains changements morphologiques s’opérant au cours de la différenciation de l’érythroblaste en hématie (comme la condensation nucléaire, la condensation de la chromatine, du cytoplasme, la perte de certains organites) avec ceux observés lors de l’apoptose, ont conduit à l’hypothèse de l’implication des enzymes de l’apoptose, les caspases, dans la différenciation érythroblastique. La présence d’EPO protège le facteur de transcription des gènes érythroïdes d’une enzyme (caspase 3) et empêche l’activation d’autres caspases, enzymes impliquées dans l’apoptose.
L’EPO protège GATA-1
Les érythroblastes expriment de façon constitutive une protéine de choc thermique appelée Hsp70 qui se localise dans le noyau et interagit avec GATA-1 (un facteur de transcription qui permet la régulation positive des promoteurs des gènes érythroïdes comme la glycophorine, l’hémoglobine et le récepteur de l’érythropoïétine), en le protégeant du clivage opéré par une caspase (caspase 3).
L’EPO permet le maintien de la localisation nucléaire de Hsp70, ce qui assure la protection de GATA-1 vis-à-vis de la caspase 3.
En absence d’EPO, la protéine Hsp70 sort du noyau, GATA-1 est clivé par la caspase. Il y a activation d’autres caspases et déclenchement de l’apoptose, ainsi qu’une diminution de la transcription des gènes responsables de la différenciation érythroïde.
Mode d’action de l’EPO au niveau moléculaire
Structure de la molécule d’EPO
Depuis l’isolement de l’EPO par Miyake et Goldvasser, les connaissances relatives aux caractéristiques et à la structure de cette molécule progressèrent continuellement, jusqu’au clonage moléculaire du gène de l’EPO en 1985.
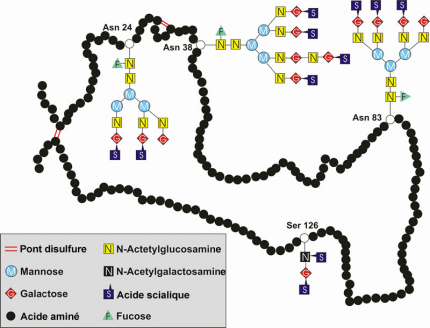
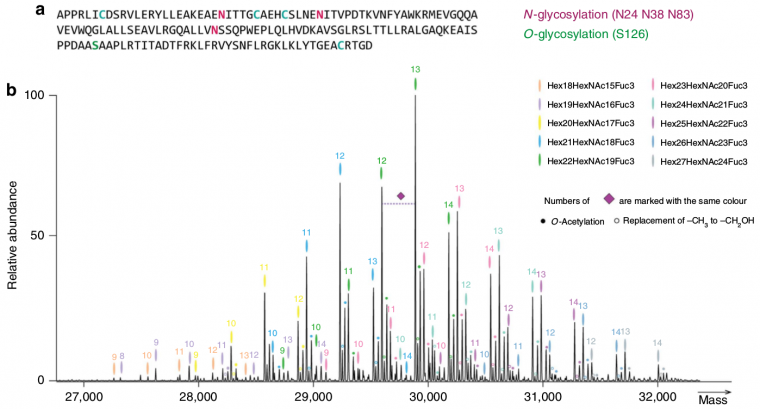
L’EPO comporte un cœur protéique et 4 chaînes glucidiques. Il existe quatre sites de glycosylation. Trois de ces sites correspondent à de la N-glycosylation (sur l’acide aminé asparagine : Asn 24, 38 et 83), ces acides aminés portent des arbres glucidiques relativement importants, et un site de O-glycosylation (sur la sérine : Ser 126), dont le motif glucidique est plus petit.
L’EPO humaine est une glycoprotéine de 30 kDa, contenant 165 acides aminés. La masse molaire moléculaire moyenne d’un acide aminé étant de 110 Da, une protéine de 165 acides aminés devrait avoir une masse molaire moléculaire de seulement 18 kDa environ. L'« excès » de masse de l'EPO est dû à la présence de quatre motifs glucidiques qui sont greffés sur certains acides aminés (voir Figure 3), ceux-ci représentant environ 40 % de la masse moléculaire de l’EPO. Ces quatre chaînes glucidiques contiennent, chacune, entre deux et quatre molécules d’acides sialiques. Il existe ainsi plusieurs isoformes de l’EPO, définies par le nombre de molécules d’acides sialiques (entre 4 et 14), leur comportement biologique, l’affinité pour leur récepteur et leur demi-vie.
La diversité des motifs des 4 chaînes glucidiques fixées sur le squelette protéique de l’érythropoïétine, fait varier la masse moléculaire de l’EPO humaine de 26 kDa à 33 kDa, la masse de 30 kDa correspondant à la forme la plus fréquente.
L’EPO est une cytokine qui a pour particularité de ne pas être produite par des cellules du système immunitaire. Cela dit, elle partage une structure secondaire commune avec de nombreuses cytokines, au sein de la sous-famille de type IL-2 (interleukine de type 2). Cette structure secondaire se caractérise par la présence de 4 hélices alpha anti-parallèles. La structure tertiaire du squelette protéique de la molécule d’érythropoïétine est visible sur le site RSCB PDB.
Par ailleurs, le récepteur de l’EPO possède un domaine « récepteur de cytokines » commun avec plusieurs interleukines (IL 2, 4, 7 et 9), la prolactine et l’hormone de croissance.
Mécanisme d’action de l’EPO
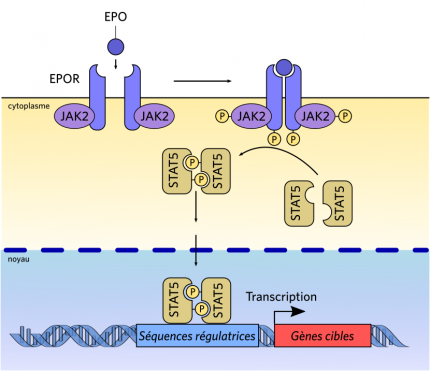
La fixation du ligand EPO sur son récepteur entraîne un changement de conformation de ce dernier et un rapprochement des deux molécules du récepteur (homodimérisation). Ceci induit la phosphorylation des deux Janus kinases 2 (JAK2, une tyrosine kinase) ainsi que celle des tyrosines du récepteur de l’EPO. Cela permet la fixation du facteur de transcription STAT5, qui est à son tour phosphorylé par JAK2. Le facteur de transcription STAT5, sous forme phosphorylée, va se dimériser, migrer vers le noyau et agir sur la transcription.
L’EPO agit comme un facteur de croissance. Comme toute hormone, son action passe par une liaison à un récepteur spécifique, nommé EPO-R. Celui-ci est membranaire, l’EPO étant une glycoprotéine hydrophile.
Le récepteur à l’EPO est constitué d’un dimère d’une unique chaîne, à un seul segment transmembranaire. Ce récepteur possède un domaine extracellulaire assurant la fixation avec l’EPO (deux sites de fixation d’affinité différente, l’un de haute affinité, de l’ordre du nanomolaire, et l’autre de faible affinité, de l’ordre du micromolaire) et un domaine, intracellulaire, d’activation de la voie de signalisation JAK/STAT. Ce dernier est susceptible d’être phosphorylé sur quatre sites différents, et active plusieurs relais intracellulaires (voies JAK/STAT5, PI3-kinase, Ras/MAP kinase) qui vont, in fine, agir en empêchant l’apoptose de la cellule cible et stimuler sa prolifération et sa différenciation (voir Figure 4).
On trouve ce récepteur chez les progéniteurs érythroïdes – ils sont présents sur un continuum de cellules allant des BFU-E mûres aux érythroblastes, avec un maximum sur les CFU-E – mais aussi chez les mégacaryocytes (cellules de la moelle hématopoïétique produisant les plaquettes). On les trouve également sur d’autres cellules : cellules endothéliales, cellules nerveuses, et dans le placenta.
Relation structure/fonction dans la molécule d’EPO
Les motifs sucrés que porte cette glycoprotéine jouent un rôle important dans la fonction de la molécule.
L’ablation des acides sialiques situés aux extrémités des chaînes glycosylées de l’EPO (qu’il s’agisse d’EPO urinaire ou de synthèse) augmente l’activité de cette molécule in vitro mais abolit son activité in vivo. La digestion de l’EPO urinaire humaine par une endoglycosidase – provoquant l’élimination des oligosaccharides fixés par N-glycosylation en Asn 24, 38 et 83 – entraîne une disparition totale de l’activité de l’EPO in vivo alors qu’elle persiste et même augmente in vitro.
En absence de ces résidus sialiques, la vitesse d’élimination de la molécule par l’organisme augmente. L’EPO dépourvue de ses acides sialiques se fixerait sur les cellules hépatiques, au niveau de récepteurs aux sucres, par ses galactoses, N-acétylglucosamines et mannoses ainsi mis à nu, entraînant sa métabolisation rapide par ces cellules hépatiques. De plus, la présence de chaînes d’oligosaccharides pourrait empêcher les molécules d’EPO de former des agrégats entre elles, agrégats qui diminuent l’activité biologique de la molécule.
Concernant l’affinité avec le récepteur, il a été montré que la molécule d’EPO dépourvue des oligosaccharides fixés en N sur les asparagines mais possédant encore les acides sialiques de la chaîne fixée en O sur la sérine, présente une augmentation (× 2) de son affinité avec le récepteur de l’EPO et que cette augmentation est encore plus forte (× 4) si tous les acides sialiques ont été ôtés. Les acides sialiques gêneraient donc la fixation au récepteur de l’EPO.
On peut retenir que la partie protéique de la molécule d’EPO suffit à sa liaison à son récepteur et que les sucres protègent la molécule de son inactivation dans l’organisme avant qu’elle n’atteigne ses cellules cibles, mais gênent sa fixation au récepteur.
Les EPO de synthèse
Depuis le clonage moléculaire du gène de l’EPO, en 1985, il est possible d’utiliser ce dernier pour produire de l’EPO de synthèse par recombinaison génétique. La molécule produite est nommée rHuEPO (recombinant human EPO).
Les cellules de mammifères sont essentielles pour produire l’EPO, car cette molécule comporte une grande partie glucidique (40 % de sa masse) qui ne peut être construite par la machinerie cellulaire d’une bactérie.
La production de rHuEPO par génie génétique se fait couramment par transfert du gène humain de l’EPO dans des cellules d’ovaire de hamster chinois (CHO, pour chinese ovary cells), ou de cellules de rein humain, qui vont produire, en culture, la protéine. Le code génétique étant universel, la séquence en nucléotides du gène codant la séquence en acides aminés de la protéine va permettre la production d’une chaîne identique d’acides aminés, quelle que soit la cellule qui la produit. En revanche, la glycosylation n’est pas codée par le gène en lui-même, et ces modifications post-traductionnelles peuvent dépendre du type cellulaire dans lequel se déroule la biosynthèse.
De récentes données de spectrométrie de masse (voir Figure 5) montrent la grande variété des modifications post-traductionnelles possibles dans le cas de la production d’EPO recombinante (rHuEPO).
(a) Séquence de l’EPO avec mise en évidence des asparagines (N) et de la sérine (S) glycosylées, ainsi que des cystéines (C) impliquées dans la formation de ponts disulfures (voir également Figure 3).
(b) Au-dessus de chaque pic la marque de couleur indique une composition particulière en glycanes et le numéro indique le nombre d’acides sialiques de l’isoforme.
Lorsque l’on enregistre l’ensemble des isoformes de la rHuEPO par spectrométrie de masse de haute résolution, on observe plus de 230 pics, allant de 26 000 à 33 000 Da, le plus haut pic correspondant à une masse de 29 888 Da, avec une composition en glycanes : Hex22HexNAc19Fuc3Sia13 (vert) et 13 acides sialiques.
Dans le cas de ce pic, une augmentation de 16 Da (petit pic juste à droite, marqué d’un petit cercle vert vide) correspond au remplacement de NAc par NGc (–CH3 devenant –CH2OH), alors qu’une augmentation de 42 Da (pic encore plus à droite, marqué d’un petit cercle vert plein) correspond à une O-acétylation d’acides sialiques. Enfin la perte d’un acide sialique (losange violet) représente une diminution de masse de 309 Da.
Il existe maintenant une grande variété de molécules d’EPO recombinantes, dont la partie protéique diffère peu de l’EPO endogène mais dont la partie glucidique diffère davantage, notamment dans le ratio de chaînes glycosylées bi-antennaires et tétra-antennaires et le nombre de molécules d’acide sialique.
Dès 1988, deux formes de rHuEPO, possédant la même structure protéique et les mêmes types de chaînes glycosylées que l’EPO endogène, ont été disponibles comme outil thérapeutique : l’époétine alpha (Eprex) et bêta (Recormon). Mais une des limitations majeures de l’époétine est la nécessité, en cas d’utilisation thérapeutique, de l’administrer plusieurs fois par semaine.
La NESP (novel erythropoiesis stimulating protein), également appelée darbépoétine alpha (commercialisée sous le nom d’Aranesp), est une EPO synthétique de deuxième génération. Cette molécule a été obtenue par mutagenèse dirigée du gène de l’EPO, créant deux nouveaux sites de N-glycosylation (sur les asparagines en position 30 et 88, après substitution de 5 acides aminés : Ala30Asn, His32Thr, Pro87Val, Trp88Asn et Pro90Thr). La darbépoétine alpha possède donc cinq chaînes de N-glycosylation et une de O-glycosylation. Elle possède 22 molécules d’acides sialiques et un poids moléculaire de 37 kD.
| EPO endogène | NESP (darbépoétine) | |
|---|---|---|
| Nombre d’acides aminés | 165 | 165 (dont 5 mutés) |
| Masse moléculaire | 30 kD | 37 kD |
| Nombre de chaînes N-glycosylées | 3 | 5 |
| Nombre de chaînes O-glycosylées | 1 | 1 |
| Pourcentage de masse en sucre | 40 % | 51 % |
| Nombre d’acides sialiques | 14 | 22 |
Elle présente une meilleure stabilité et une demi-vie plus longue que les rHuEPO de première génération et autorise un plus grand espacement des injections (injections hebdomadaires). Administrée par voie intraveineuse sa demi-vie est de 25,3 h, contre 8,5 h pour les rHuEPO de première génération ; administrée par voie sous-cutanée sa demi-vie est d’environ 50 h, c’est-à-dire le double de la demi-vie des rHuEPO de première génération.
La NESP, du fait de sa richesse en glucides, se fixe 5 fois moins vite sur l’EPO-R que la molécule naturelle. En effet, comme vu plus haut, plus l’érythropoïétine est glycosylée moins il y a d’affinité entre cette molécule et son récepteur.
Il a été montré récemment que le récepteur de l’EPO internalise la molécule d’EPO ou la molécule de rHuEPO après sa fixation. Une fois fixée sur l’EPO-R, la molécule d’EPO, qu’elle soit naturelle ou de synthèse, est internalisée à la même vitesse dans le cytoplasme de la cellule cible, puis est soit dégradée (40 %) soit re-sécrétée intacte (60 %). Le fait d’avoir une moins bonne affinité avec le récepteur entraîne, pour la NESP, une diminution de sa dégradation par internalisation dans les cellules cibles.
Cette seconde génération de rHuEPO, de type NESP, a été supplantée en 2008 par une EPO de troisième génération, nommée CERA (continuous erythropoietin receptor activator, commercialisée sous le nom de Mircera). C’est une EPO « retard », efficace sur une période de trois semaines au lieu d’une. Cette molécule de masse molaire 60 kD, présente une demi-vie de 135 heures. Cette méthoxy polyéthylène glycol-époétine bêta est constituée d’un squelette d’érythropoïétine (époétine-bêta) auquel sont fixés (sur les lysines de la protéine) des acides méthoxy polyéthylène glycol butanoïques. Cette molécule présente une affinité avec le récepteur de l’EPO réduite par rapport à l’EPO naturelle et à d’autres EPO recombinantes, mais garde une activité in vivo efficace, de par l’augmentation de sa demi-vie (134 h après injection intra-veineuse et 139 h après injection sous-cutanée).
Parmi les dernières recherches dans le domaine, une classe particulière de molécules est explorée, ce sont les « peptides mimétiques de l’EPO » (EMP). C’est en construisant une banque aléatoire de peptides fixés à la surface de phages et en l’incubant avec le récepteur de l’EPO qu’a été mis en évidence un peptide agoniste capable de se fixer au domaine extracellulaire du récepteur de l’EPO. Le premier peptide identifié (EMP1) est un oligopeptide cyclique dont la séquence en acides aminés diffère totalement de celle de l’EPO. Cependant il est capable, in vitro, d’induire la formation de colonies érythroblastiques à partir de moelle humaine normale et de déclencher la cascade de phosphorylations intracellulaires, comme le ferait l’EPO. D’autres peptides ont ensuite été synthétisés et sélectionnés afin d’obtenir une meilleure affinité avec le récepteur de l’EPO.
La première molécule de ce type à être commercialisée, fut l’hématide (ou Péginesatide). C’est un peptide synthétique lié à une molécule de polyéthylène glycol. Son utilisation chez des patients anémiés et dialysés a montré, en 2013, une efficacité aussi grande que l’époétine, mais sa commercialisation (sous le nom d’Omontys) a cessé en 2014 (notamment suite à des cas de réactions immunitaires graves).
Utilisation médicale de l’EPO
Dans tous les cas, l’EPO utilisée dans un but thérapeutique est une EPO produite par génie génétique et non la molécule endogène purifiée. Son mode d’administration se fait exclusivement par injection, la voie orale n’étant pas efficace.
Après le clonage du gène de l’érythropoïétine en 1985, l’érythropoïétine recombinante fut introduite en 1988 dans le traitement de l’anémie chronique due à une insuffisance de sécrétion d’érythropoïétine, essentiellement lors d’une insuffisance rénale chronique, mais aussi lors de certains cancers.
Chez les patients souffrant d’une anémie dite « rénale » (présentant une production rénale d’EPO insuffisante ou inadaptée), l’injection intraveineuse a d’abord été choisie par souci de simplicité, lors de la dialyse. Par la suite, de nombreuses études ont comparé l’efficacité des modes d’administration par voie intraveineuse et sous-cutanée et ont démontré que l’injection par voie sous-cutanée prolongeait la demi-vie de la rHuEPO plasmatique.
L’EPO recombinante a fait son entrée dans le domaine transfusionnel en complément des transfusions sanguines, par exemple dans le cas de chirurgie orthopédique avec pose de prothèse (entraînant une perte sanguine importante).
Elle peut également être utilisée lors de traitements par chimiothérapie entraînant une aplasie (destruction des cellules souches de la moelle osseuse), car cette hormone présente un effet protecteur vis-à-vis des cellules souches érythrocytaires.
Enfin l’EPO de synthèse est utilisée dans la prise en charge des grands prématurés, en même temps qu’une supplémentation en fer et en acide folique. Du fait de son mécanisme d’action, cette molécule n’a pas une action immédiate sur l’anémie (cela prend deux semaines) et ne peut donc se substituer à une transfusion sanguine quand le taux d’hémoglobine de l’enfant est trop bas ou que l’anémie est mal tolérée cliniquement. Les bébés prématurés ont un risque d’anémie plus important que les bébés nés à terme du fait d’une carence en fer (environ 80 % des réserves de fer sont accumulées pendant le dernier trimestre de la grossesse), d’une réponse érythropoïétique à l’hypoxie immature ainsi que d’une spoliation sanguine liée à la répétition des prélèvements sanguins, indispensables à leur prise en charge médicale (pour un très grand prématuré de 500 g un prélèvement de 2 mL de sang représente 5 % de son volume sanguin total).
Les anémies associées à des maladies chroniques telles que rhumatismes inflammatoires, cancers (voir plus loin), myélomes, pourraient bénéficier d’un traitement par l’EPO recombinante. Le taux d’EPO endogène mesuré dans ces situations est plus bas que chez des patients ayant une anémie de même importance, due à une simple carence en fer. En effet certaines cytokines inflammatoires comme l’IL-1, le TNF-alpha et l’interféron-bêta sont présents chez ces malades et agissent comme inhibiteurs de la production d’EPO et aussi de l’hématopoïèse.
L’administration d’érythropoïétine sur une longue période entraîne un besoin en fer accru. Par exemple, un traitement sur 4 semaines (dose totale de rHuEPO de 3600 UI/kg), multiplie l’érythropoïèse par 2,5. La consommation de fer augmente donc de façon importante et nécessite un apport de cet élément par voie orale (ou même intraveineuse). La modification du métabolisme du fer est un signe recherché dans les contrôles anti-dopage (voir plus loin).
Malgré la diversité des rHuEPO employées, il ne semble pas que la présence de telle ou telle autre architecture de chaînes glycosylées entraîne la production d’anticorps chez les patients traités avec ces molécules.
Les résistances relatives (la réponse au traitement par EPO recombinante est incomplète) observées dans le cas de patients présentant une anémie rénale sont essentiellement dues à un déficit absolu en fer ainsi qu’à une source de spoliation sanguine.
Utilisation de l’EPO à des fins de dopage
Conduite dopante
L’EPO exogène a été régulièrement détournée de sa vocation thérapeutique pour être utilisée à des fins d’amélioration des performances sportives. Son utilisation permet en effet d’augmenter le nombre de globules rouges circulants, donc les capacités de transport du dioxygène vers les tissus, et en particulier vers les muscles, gros consommateurs de dioxygène lors d’un effort. L’amélioration des performances apportée par l’EPO est donc plus particulièrement sensible pour les sportifs pratiquant un sport d’endurance, dans lequel les muscles fonctionnent majoritairement en aérobie (cyclistes, marathoniens, nageurs, skieurs de fond, footballeurs, rugbymen).
Les effets de l’EPO sont plus importants et/ou plus faciles à mettre en œuvre que d’autres méthodes d’augmentation du taux de globules rouges également utilisées par certains sportifs (séjour en altitude, grossesse interrompue pour les femmes, transfusion ou autotransfusion). Ces effets perdurent jusqu’à 15 à 20 jours après l’arrêt des injections, ce qui rend la détection de l’EPO exogène difficile.
Les risques liés au dopage par l’EPO
Outre que l’utilisation de l’EPO dans une optique d’amélioration des performances va à l’encontre de l’éthique et de l’équité sportive, la lutte contre ce type de dopage est nécessaire, car il n’est pas sans conséquences délétères pour l’utilisateur.
La stimulation de la lignée rouge entraîne une augmentation de la viscosité du sang par augmentation de l’hématocrite (volume occupé par les globules rouges circulants dans le sang exprimé en pourcentage par rapport au volume total du sang). L’hématocrite, dont les valeurs normales varient de 37 à 46 % chez les femmes et de 40 à 52 % chez les hommes peut alors atteindre 55 % (norme de dangerosité fixée par la communauté scientifique), voire 60 %. Cette viscosité limite la circulation sanguine, en particulier des organes vitaux, et expose à des complications cardiovasculaires.
L’activité sportive, elle-même, augmente naturellement l’hématocrite, en raison de la déshydratation consécutive à l’effort. Chez le sportif dopé, l’hématocrite déjà élevé au repos, atteindra rapidement, avec l’effort, la zone de dangerosité située entre 55 % et 60 %. Ce risque reste difficile à maîtriser, car l’hématocrite continue d’augmenter pendant 5 à 10 jours après la dernière injection d’EPO, ce qui prolonge le risque d’accident vasculaire.
En activant l’érythropoïèse on augmente non seulement le taux de globules rouges dans le sang, donc la capacité de transport de dioxygène, ce qui est l’effet recherché, mais on augmente également le volume, la viscosité du sang et l’agrégation plaquettaire. Il en résulte une augmentation du risque de thrombose artérielle pouvant aller jusqu’à l’infarctus de différents organes (un infarctus est une lésion causée par la nécrose des cellules, suite à un apport en sang insuffisant). À plus long terme, il y a également une augmentation du risque d’hypertension artérielle.
Le référentiel sur l’anémie en cancérologie (2016) préconise, du fait de l’augmentation du risque d’hypertension artérielle et de thromboembolie liée à l’utilisation des ASE (agents stimulants l’érythropoïèse), que l’emploi d’EPO recombinantes humaines pour lutter contre l’anémie de patients cancéreux tienne compte des facteurs de risque individuels tels que l’âge avancé et la présence d’une cardiopathie ischémique
Le dépistage de l’EPO
Détection de l’EPO recombinante dans l’urine ou le sang
L’analyse d’urine est le moyen le plus utilisé pour détecter de nombreux dopages. L’agence française de lutte contre le dopage réalise en moyenne plus de 10 000 prélèvements d’urine par an.
L’érythropoïétine peut être détectée et dosée dans le sérum, ou dans l’urine, par immunodosage. Cependant, cette technique ne permet pas de séparer l’EPO endogène de la rHuEPO, ce que permet l’électrophorèse.
En 1999, Françoise Lasne et Jacques de Ceaurriz, alors directeur du LNDD (laboratoire national de dépistage du dopage de Chatenay-Malabry, créé en 1966, par la loi Herzog, devenu depuis 2006 le laboratoire d’analyse de l’agence française de lutte contre le dopage), exploitant le fait que les charges électriques portées par les différentes formes d’EPO ne sont pas identiques, mettent au point un test urinaire très fiable. Utilisé pour la première fois aux Jeux olympiques de Sydney, en 2000, il sera dans un premier temps doublé par un test sanguin indirect, mettant en évidence, non pas la présence d’EPO, mais ses effets : hématocrite élevé, taux de fer élevé (la prise de fer est généralement associée à la prise d’EPO).
Depuis 2003, le test urinaire mis au point à Châtenay-Malabry est utilisé par l’ensemble des laboratoires antidopage du monde entier et ne nécessite pas de dosage sanguin, plus difficile à mettre en œuvre.
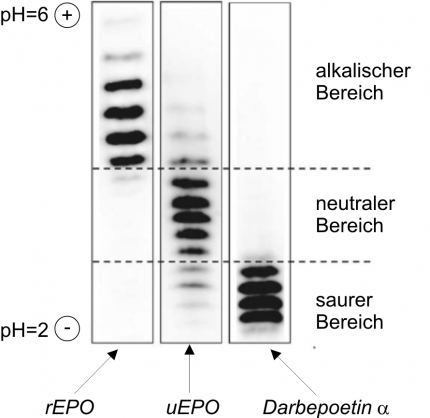
Dans l’urine, les concentrations d’érythropoïétine sont physiologiquement faibles (inférieure à 3 UI soit 25 ng/l). L’urine est préparée par ultrafiltration centrifuge, permettant d’éliminer dans le filtrat une partie des constituants urinaires de faible poids moléculaire et de concentrer de 500 à 1000 fois les protéines de plus haut poids moléculaire (supérieur à 30 kDa, dont l’érythropoïétine), dans le retentat. Ce dernier est ensuite soumis à une iso-focalisation électrique (électrophorèse dans un gradient de pH) qui permet de séparer chacune des protéines présentes en ses isoformes constitutives. L’érythropoïétine ne représentant qu’une petite partie des protéines focalisées (1/10 000 000), sa mise en évidence nécessite l’utilisation d’anticorps spécifiques, dans un procédé appelé double-blotting. Les profils isoélectriques sont alors visualisés par chimioluminescence, avec émission de lumière au niveau de chacune des isoformes de l’érythropoïétine (voir Figure 7).
L’érythropoïétine endogène est caractérisée par un point isoélectrique (pl) compris entre pH 3,92 et 4,42. Les érythropoïétines recombinantes de première génération, époétine alpha et bêta, ont des pl compris entre pH 4,42 et 5,11. Cette différence constatée au niveau des profils isoélectriques est le reflet d’une divergence dans certaines modifications post traductionnelles de l’hormone, lors de la synthèse, en particulier au niveau de sa sialoglycosylation. La darbépoétine alpha ou NESP (Aranesp), de masse plus élevée et possédant un plus grand nombre d’acides sialiques, se positionne dans la zone acide du profil.
Image du profil isoélectrique de l’époétine alpha et bêta (rEPO), de l’érythropoïétine urinaire endogène (uEPO) et de l’agent de stimulation de l’érythropoïèse Aranesp (darbépoétine alpha)
saurer Bereich = zone acide ; neutraler Bereich = zone neutre ; alkalisher Bereich = zone alcaline.
Cependant le risque de faux négatifs dû aux faibles doses d’ASE (agents stimulants l’érythropoïèse) utilisées et le fait que les molécules de haut poids moléculaire comme CERA (60 kDa) soient difficilement excrétées dans l’urine, a fait préférer d’autres méthodes électrophorétiques, plus sensibles, utilisables sur l’urine et le sang (plasma, sérum), et impliquant, avant l’électrophorèse elle-même, une dénaturation des molécules testées. Cette dénaturation peut être réalisée par du SDS (sodium dodécyl sulfate) dans le cas de la méthode SDS-PAGE (SDS-polyacrylamide gel electrophoresis) ou par du SAR (sarcosyl), dans le cas de la méthode SAR-PAGE (lire aussi l’article L’électrophorèse). Le sarcosyl est un surfactant anionique qui, contrairement au SDS, se fixe uniquement sur la partie protéique de l’EPO de synthèse et permet une meilleure détection de celle-ci (notamment dans le cas où elle possède un polyéthylène glycol sur lequel se fixe le SDS).
L’agence mondiale antidopage exige que l’analyse des ASE dans l’urine et le sang, se fasse, selon la molécule recherchée, par la méthode électrophorétique la plus adaptée :
- focalisation isoélectrique ou SAPR-PAGE pour les rHuEPO, NESP (darbépoétine alpha) et CERA
- SAR-PAGE pour l’EPO-Fc (voir plus loin)
- SDS-PAGE ou SAR-PAGE pour la Péginesatide (ou hématide, peptide mimétique de l'EPO).
Détection des marqueurs sanguins du dopage par EPO
Il s’agit d’une méthode indirecte, décelant les conséquences de l’utilisation d’une molécule de type érythropoïétine, et non la molécule elle-même. Elle est basée sur la mesure de « marqueurs » biologiques spécifiques de l’accélération de l’érythropoïèse comme :
- l’hématocrite. Par exemple, pour une femme dont l’hématocrite normal se situe environ à 47 %, il y a suspicion de dopage par l’EPO si l'hématocrite dépasse 50 %.
- le taux d’hémoglobine ;
- le nombre de réticulocytes (jeunes globules rouges immatures). Le pourcentage normal, donné par rapport au nombre total de globules rouges, est entre 0,5 et 1 %.
- le nombre de macrocytes (érythrocytes de grande taille).
Cette méthode permet de détecter la fraude, même après l’excrétion de la molécule incriminée, mais l’inconvénient est qu’elle ne permet pas de détecter directement la substance dopante.
Depuis 2008, le passeport biologique de l’athlète est entré en vigueur et permet un suivi à long terme plus efficace que des analyses ponctuelles. Dans le module hématologique du passeport (il existe aussi un module stéroïdien), différents marqueurs sanguins sont suivis et certains d’entre eux sont corrélés mathématiquement. Huit marqueurs sont pris en compte dans le module hématologique du passeport biologique de l’athlète pour définir son ABPS (abnormal blood profile score) et suspecter une pratique dopante :
- HCT (haematocrit, hématocrite) ;
- HGB (haemoglobin, hémoglobine) ;
- RBC (red blood cell count, nombre de globules rouges) ;
- RET % (reticulocytes percentage, pourcentage de réticulocytes) ;
- RET# (reticulocytes count, nombre de réticulocytes) ;
- MCV (mean corpuscular volume, volume globulaire moyen) ;
- MCH (mean corpuscular haemoglobin, teneur corpusculaire moyenne en hémoglobine = taux moyen d’hémoglobine par hématie, indice obtenu en calculant le rapport de l’hémoglobine totale en g/L par le nombre de globules rouges dans un litre, exprimé en pg, avec une valeur de référence de 27-33 pg) ;
- MCHC (mean corpuscular haemoglobin concentration, concentration corpusculaire moyenne en hémoglobine = taux moyen d’hémoglobine dans le volume occupé par les globules rouges dans le sang. Indice obtenu en divisant le taux d’hémoglobine par l’hématocrite, valeur de référence 330-360 g/L)
Le OFF-score est un « index de stimulation » permettant de détecter le dopage par auto-transfusion (blood doping) et par EPO. Il se calcule par la formule suivante : OFF-score = [Hb] – 60 $\sqrt{RET\%}$, avec [Hb] en g/L.
Les valeurs normales sont de l’ordre de 85 à 95.
Perspectives du dopage par l’EPO
Si l’on prend l’exemple du cyclisme (mais l’usage du passeport hématologique a montré que l’athlétisme était de loin le sport le plus « contaminé » par le dopage), on peut dire que l’EPO exogène a changé la face de ce sport dans les années 1990, période à laquelle un coureur dopé pouvait prendre jusqu’à cinq injections de 2000 UI d’EPO recombinante, tous les deux jours. Cette pratique a cessé avec l’avènement du dépistage permettant de déceler une positivité après des injections de doses très faibles, de l’ordre de 500 UI.
Le passeport hématologique a fait évoluer ces pratiques dopantes dans le « bon sens ». Néanmoins il a ses propres limites, notamment lorsque les paramètres étudiés se maintiennent dans le domaine de valeurs du sujet, ce qui est le cas lors d’injections de micro-doses d’EPO, permettant d’augmenter la masse d’hémoglobine sans faire varier la concentration en Hb et le OFF-score (de même avec de faibles retraits ou injections de petit volumes de globules rouges).
Aujourd’hui, des ASE de haut poids moléculaire comme l’EPO-Fc (deux molécules d’EPO humaine liées à la portion Fc d’une immunoglobuline IgG1) sont développés. D’autres substances comme les peptides mimétiques de l’EPO et les stabilisateurs d’HIF (dont l’effet est équivalent à celui de micro-doses d’EPO, mais qui sont plus faciles à détecter), ont déjà été utilisés en tant que dopants. D’autres molécules telles que les agonistes non érythropoïétiques du récepteur de l’EPO, les inhibiteurs de GATA ou surtout les piègeurs de l’activine (molécule de la famille des TGFß, impliquée dans l’atrophie musculaire) risquent d’être prochainement utilisées. Enfin, la thérapie génique de l’EPO par biopompes (thérapie génique ex vivo consistant à prélever des petits cylindres de derme, à les transfecter avec le gène de l’EPO et à les ré-implanter dans l’abdomen du patient) pourrait constituer une autre méthode de dopage. Cependant l’EPO ainsi produite dans le muscle présente un profil isoélectrique différent de celle naturellement produite par les reins, ce qui la rend facilement détectable, tout comme la présence du transgène.
Références
Références générales
- L’erythropoïétine
Catherine Lacombe, Patrick Mayeux ; médecine/sciences 1995 ; 11:947-55 - Molecular biology of Erythropoietin
Wolfang Jelkman ; Internal Medicine Vol. 43, N° 8 (August 2004) - The role of carbohydrate in recombinant human erythropoietin
Eisuke Tsuda, Gosei Kawanashi, Masatsugu Ueda, Seiji Masuda and Ryuso Sasaki ; Eur. J. Biochem. 188, 405-411 (1990) - Transduction du signal par les récepteurs de cytokines
Isabelle Dusanter-Fourt, Patrick Mayeux, Sylvie Gisselbrecht ; médecine/sciences 1994 ; 10:825-35
EPO et apoptose
- Une avancée dans la compréhension du rôle essentiel de l’érythropoïétine dans la production des globules rouges
CNRS - HSP70, ange gardien de GATA-1
Julie Vandekerckhove, Jean-Antoine Ribeil, Yaël Zermati, Carmen Garrido, Geneviève Courtois, Eric Solary, Olivier Hermine; médecine/sciences 2008
EPO et médecine
- Régulation de l’érythropoïèse : applications physiopathologiques en néphrologie
Y. Zermati, F. Fakhouri, R. Delarue, J.A. Ribeil, B. Knebelmann et O. Hermine ; 2003 - L’intérêt des érythropoïétines recombinantes humaines dans la prise en charge de l’anémie rénale
- Anémie et cancers
Référentiels inter régionaux en Soins Oncologiques de Support ; « Anémie et cancer », 16/11/2016
EPO et dopage
- Valeurs de l’hématocrite
Université Médicale Virtuelle Francophone - Agence française de lutte contre le dopage, rapport d’activité 2016
- Erythropoïétine recombinante et performance aérobie ; facteurs centraux vs périphériques ; rôle de l’hypoxie
Paul Robach - Dopage sanguin
Paul Robach - EPO : production, effet, dépistage
E. Varlet-Marie, M. Audran ; Université Montpellier 1 - Blood doping and its detection
Wolfgang Jelkmann and Carsten Lundby - Erythropoietin as a performance-enhancing drug : its mechanistic basis, detection and adverse effects
Nouveaux agents stimulant l’érythropoïèse
- Nouveaux agents stimulant l'érythropoïèse
- Nicole Casadevall, Jerôme Rossert, 2006
- Development and characterization of novel erythropoiesis stimulating protein (NESP)
- Joan C. Egrie and Jeffrey K. Browne
- Methoxy polyethylene glycol-epoetin beta
Wikipédia - 2018 Liste des substances et méthodes interdites
Agence mondiale anti-dopage - Recombinant Human EPO-Fc Protein
Novus Biologicals - “Genetic Doping” with erythropoietin cDNA in primate muscle is detectable, 2004