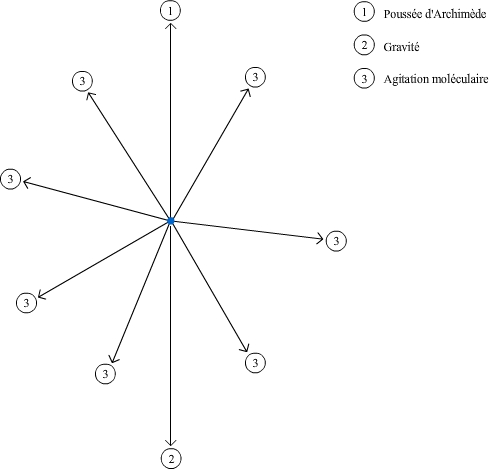
Les constituants contenus dans un liquide, de la taille et masse d'une molécule à celle d'une cellule, peuvent être séparés par centrifugation. Ces particules sont soumises à plusieurs types de force: la force de gravité, la poussée d'Archimède et pour la majorité d'entre elles; l'agitation moléculaire.
Cet article présente les différentes techniques de centrifugation, avec leurs contraintes techniques et leurs utilisations possibles.
Principe de la technique
La gravité et la poussée d'Archimède sont faibles, comparées à l'agitation moléculaire. Celle dernière peut entraîner un mouvement de la particule, mais, comme elle n'a pas de direction privilégiée, statistiquement l'ensemble des particules ne se déplace pas.
La centrifugation permet de séparer des constituants de taille et de masse très variables contenus dans un liquide, depuis des molécules jusqu’à des cellules entières. Tous les constituants contenus dans un échantillon sont soumis à la gravité, force qui s’exerce du haut vers le bas, et à la poussée d’Archimède, force qui s’exerce du bas vers le haut. En dehors du cas particulier dans lequel ces deux forces sont parfaitement équilibrées (voir plus bas « La centrifugation à l’équilibre »), on pourrait donc s’attendre qu’avec le temps tous les constituants finissent par tomber au fond du récipient dans lequel ils se trouvent (sédimentation) ou remontent à la surface. C’est d’ailleurs ce qui arrive pour certains. Mais pour la majorité d’entre eux, un autre phénomène intervient qui empêche ce résultat : l’agitation moléculaire. Elle n’a pas de direction privilégiée, et à l’échelle microscopique l’agitation moléculaire est de très loin plus importante que la gravité et la poussée d’Archimède, de sorte que les effets de ces dernières sont négligeables (voir Fig. 1).
La gravité et la poussée d'Archimède sont augmentées, au contraire de l'agitation moléculaire, et ne sont plus négligeables. Ayant une direction privilégiée, elles peuvent entraîner un mouvement global des particules vers le haut, si la poussée d'Archimède est supérieure à la gravité apparente, ou vers le bas, dans le cas inverse.
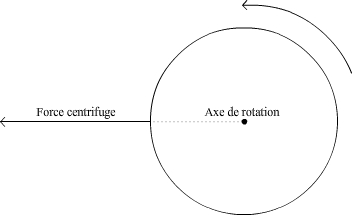
En faisant tourner l’échantillon, on fait apparaître une nouvelle force, la force centrifuge, qui est une accélération qui s’exerce radialement vers l’extérieur de l’axe de rotation (voir Fig. 3). Pour un constituant donné, en choisissant correctement la vitesse de rotation, l’accélération obtenue peut devenir prépondérante par rapport à l’agitation moléculaire (voir Fig. 2), ce qui entraîne sa sédimentation vers le fond du récipient ou sa remontée. L’accélération obtenue, notée g, est fonction de la vitesse angulaire de rotation et de la distance à l’axe de rotation. Elle est donnée par la formule suivante :
g = w2 r = 1,119 x 10-5 x r x n2
avec :
- w : vitesse angulaire (rad/s) ;
- r : distance à l’axe de rotation ;
- n : nombre de rotations par minute (rpm).
Notons que le tube contenant l’échantillon n’étant pas plat, dans une expérience donnée la distance au rotor est comprise dans une fourchette. Par convention, dans les protocoles en dehors de toute autre précision, on donne l’accélération obtenue au fond du tube, c’est-à-dire à la distance maximale. Par ailleurs, on indique généralement l’accélération souhaitée de préférence à la vitesse de rotation du rotor, car dans ce dernier cas le résultat dépend du rotor utilisé. A charge donc pour l’expérimentateur d’adapter la vitesse de rotation selon le rotor utilisé.
Le matériel
Une centrifugeuse est une machine équipée d’un axe de rotation enfermé dans une enceinte. Excepté pour les centrifugeuses de paillasse dont la vitesse de rotation et le temps typique d’utilisation sont relativement limités, il est nécessaire d’empêcher l’échauffement des échantillons. Pour cela, l’enceinte est réfrigérée et souvent soumise à un vide poussé pour éviter les frottements. Par ailleurs, un rotor qui tourne à haute vitesse (jusqu’à 100 000 rpm) possède beaucoup d’énergie cinétique. Potentiellement, il peut donc faire beaucoup de dégâts en cas de problème. C’est pourquoi l’enceinte de la centrifugeuse est blindée. Les normes actuelles imposent qu’un rotor se détachant de son axe à pleine vitesse de rotation doit rester confiné dans l’enceinte de la centrifugeuse. De plus, la centrifugeuse elle-même ne doit pas se déplacer de plus d’un mètre par rapport à sa position initiale.
Le rotor qui supporte les tubes contenant les échantillons doit à la fois être suffisamment solide pour supporter les forces qui s’exercent sur lui (on peut atteindre plusieurs dizaines de tonnes pour des gros rotors) et le plus léger possible, sa propre masse étant soumise à l’accélération centrifuge. Le meilleur matériau actuel est le titane, avec son excellent rapport poids/résistance, d’autant qu’il est également non-magnétique. Le seul inconvénient est son prix élevé. On le réserve pour les rotors de forte capacité et/ou à haute vitesse de rotation. On utilise, sinon, des alliages d’aluminium, plus rarement de l’acier (pour des rotors ne tournant pas très vite). Chaque rotor possède une vitesse maximum de rotation (donc d’accélération) pour laquelle il est garanti. Ce maximum est diminué après un certain nombre de rotations effectuées pour tenir compte du vieillissement. Il est évident que chaque rotor est adapté à certains modèles de centrifugeuses, qui elles aussi ont une vitesse maximum de rotation.
Il existe essentiellement deux grands types de rotors, les rotors à angle fixe, et les rotors à godets mobiles. Il existe également un troisième type de rotors, les rotors verticaux, mais ils sont beaucoup moins utilisés. Dans un rotor à angle fixe, les tubes sont placés dans des logements creux généralement inclinés entre 15 et 40°. La surface du liquide, horizontale à l’arrêt, devient verticale en rotation sous l’effet de l’accélération centrifuge. Ce type de rotor est parfaitement adapté à une centrifugation différentielle (voir « La centrifugation différentielle ») mais moins à une centrifugation à l’équilibre (voir « La centrifugation à l’équilibre »). Dans les rotors à godets mobiles (d’où le nom anglais de swinging ou SW qui est couramment utilisé), les tubes sont placés dans des godets qui sont libres de prendre tous les angles possibles entre la verticale et l’horizontale. Lors de la rotation, le godet va donc adopter l’angle pour lequel l’accélération subie s’exercera toujours du haut vers le bas du tube. Cette situation est particulièrement intéressante dans le cas d’une centrifugation à l’équilibre.
Quel que soit le rotor utilisé, un point crucial concerne l’équilibrage. Un rotor doit être parfaitement équilibré, c’est-à-dire que la masse en chaque point doit être idéalement identique à celle du point symétrique par rapport à l’axe de rotation. Concernant le rotor en lui-même, cela est du ressort du constructeur. Notons cependant que pour les rotors à angle variable, les godets sont numérotés et ont une place assignée sur le rotor qu’il convient de respecter. Mais bien entendu l’expérimentateur doit équilibrer les échantillons qu’il va centrifuger. Pour cela, il faut équilibrer les tubes deux à deux, chaque couple de tubes devant être placé symétriquement par rapport à l’axe de rotation. En revanche, il n’est pas nécessaire que tous les couples de tubes aient exactement la même masse. La tolérance est fonction de l’accélération qui sera imposée. Pour donner une idée, dans le cas d’une centrifugation à 100 000 g (vitesse classique pour du fractionnement subcellulaire) une différence de 0,1 gramme entre deux tubes entraîne un balourd de 10 kg que l’axe de rotation doit supporter, contre 100 g pour une centrifugation à 1 000 g.
Le coefficient de sédimentation
Lors d’une centrifugation, la vitesse de sédimentation d’une particule va être fonction de sa masse, de son volume et de la densité du solvant (ce qui détermine la poussée d’Archimède), de l’accélération à laquelle elle est soumise, mais également aux forces de frottement liées à son déplacement dans la solution, forces qui vont dépendre de la taille et de la forme de la particule. La vitesse de sédimentation fait donc intervenir de nombreuses variables, c’est pourquoi elle n’est pas calculée mais mesurée expérimentalement. On mesure donc un coefficient de sédimentation exprimé en Svedberg (S) qui correspond à 10-13 s. Plus la valeur est élevée, plus la vitesse de sédimentation est importante. Pratiquement, on mesure la vitesse de déplacement d’un front de migration de la particule étudiée.
La centrifugation différentielle
Dans ce type de centrifugation, le principe est de séparer les différents constituants le plus souvent à l’aide de plusieurs cycles de centrifugation à accélération croissante. Dans une première centrifugation à faible accélération, les éléments les plus massifs vont sédimenter et former un culot au fond du tube. Tous les autres éléments (pour lesquels l’accélération a été trop faible pour contrebalancer les effets de l’agitation moléculaire, ou pour lesquels le temps de centrifugation a été trop court) vont rester dans la fraction liquide appelée alors surnageant. On récupère alors séparément le surnageant et le culot ce qui revient à avoir séparé les constituants qui les composent. Cette méthode est par exemple couramment utilisée pour récupérer les éléments figurés (les cellules) du sang qui sédimentent pour des accélérations très faibles (quelques dizaines de g).
Au besoin, on peut recommencer un second cycle de centrifugation avec le surnageant précédent, mais avec une accélération plus importante. Progressivement, on sépare ainsi les différents constituants en terminant par les éléments les plus petits et ayant le moins de différence de densité avec le solvant. Précisons que les fractions obtenues sont généralement loin d’être pures, d’autant que les échantillons initiaux sont souvent complexes (exemple du broyat total d’un tissu). L’intérêt est justement de pouvoir traiter des échantillons très complexes, et ce sur des volumes importants avec des rotors adaptés.
Le choix des accélérations dépend du matériel à traiter. Le plus souvent, il y a une phase de mise au point permettant d’adapter le protocole à partir des données de la littérature. Une fois mis au point, le protocole est utilisé dans un but préparatif. La figure 4 dresse une liste non exhaustive des constituants cellulaires et des valeurs d’accélération nécessaires pour les faire sédimenter.
| Constituant cellulaire | Conditions de sédimentation |
|---|---|
| Noyau | 10 minutes à 500 g |
| Mitochondries, lysosomes, peroxysomes | 10 minutes à 5 000 g |
| Réticulum endoplasmique, appareil de Golgi | 1 heure à 100 000 g |
| Ces valeurs peuvent varier en fonction du matériel utilisé, la composition des membranes pouvant en particulier modifier la densité des constituants. On constate que des constituants différents sédimentent approximativement dans les mêmes conditions. Pour pouvoir les séparer il faut d’autres méthodes, par exemple une centrifugation à l’équilibre sur gradient de saccharose (voir ci-dessous) qui permet de séparer les différents compartiments de l’appareil de Golgi (on parle plutôt de fractions enrichies). | |
La centrifugation à l’équilibre
L'échantillon a été représenté au sommet ce qui suppose qu'il soit moins dense que la première couche de solution de saccharose. Il arrive que l'on place l'échantillon au fond, au besoin en ayant au préalable augmenté sa densité en ajoutant du saccharose (par exemple).
Dans une centrifugation à l’équilibre, les différents constituants atteignent une position dont ils ne vont plus bouger, car étant en équilibre. Or l’équilibre est atteint lorsque la densité d’une particule est égale à la densité du solvant, ce qui entraîne que la force gravitationnelle est égale à la poussée d’Archimède. On va donc utiliser un solvant dont la densité va varier en fonction de la position dans le tube, permettant aux différents constituants de rejoindre la zone de densité équivalente à la sienne : on parle de gradient. Pour obtenir des solutions de densités différentes, la méthode la plus classique est d’utiliser des solutions de concentration croissante en saccharose, mais on utilise aussi du chlorure de césium. D’autres molécules sont aussi utilisées mais beaucoup plus marginalement.
Le gradient peut être linéaire, mais aussi exponentiel ou logarithmique, selon les besoins. On le coule en faisant varier en continu le débit de deux pompes qui mélangent deux solutions, l'une à 10% et l'autre à 60% de saccharose, dans le cas présent.
Il existe deux types de gradients : discontinus et continus. Dans les deux cas la vitesse de sédimentation ne doit pas intervenir. Il est donc nécessaire de laisser le temps aux particules d’atteindre leur position d’équilibre, ce qui implique des temps de centrifugation assez longs. Bien entendu, les particules les moins denses peuvent se retrouver au sommet du tube (particules moins denses que la solution la plus haute) et les particules les plus denses peuvent former un culot (particules plus denses que la solution la plus basse). Le contenu du tube peut être récupéré par fractions successives, souvent du bas vers le haut, pour utilisation et/ou analyse ultérieure.
- Les gradients discontinus sont constitués d’un empilement de solutions de moins en moins dense (voir Fig. 5). Les différents éléments s’accumulent aux interfaces entre les solutions de densité différentes. Au-dessus, leur densité étant plus élevée, ils migrent vers le bas, et au-dessous, leur densité étant plus faible, ils migrent vers le haut. Il arrive de limiter le gradient à deux densités seulement avec une solution inférieure très dense. On peut alors utiliser ce gradient minimaliste pour une centrifugation différentielle. La différence est qu’au lieu de former un culot, les éléments les plus denses resteront en phase liquide. Cette méthode est donc beaucoup plus douce que la formation d’un culot (qui impose entre autre de resolubiliser) c’est pourquoi on parle de « coussin ».
- Les gradients continus pour lesquels la variation de densité est continue (comme leur nom l’indique ; voir Fig. 6). Les différents constituants vont alors migrer jusqu’à atteindre le point précis où leur densité est égale à celle du solvant, formant des bandes parfois visibles à l’œil nu (diffusion de la lumière).