Auteur : Didier Pol
Table des matières
1. Introduction
Après dissection et pose des ligatures comme indiqué à la page "Dissection de l'escargot et isolement du cœur vivant", le cœur est placé dans un cristallisoir rempli d'un liquide physiologique approprié. Différents liquides physiologiques dont la composition est indiquée dans ce dernier document permettent le maintien en survie du cœur d'escargot isolé.
 |
Le cœur d'escargot isolé continue à se contracter, souvent pendant plusieurs heures, illustrant ainsi l'origine endogène des contractions cardiaques puisque l'isolement du cœur s'accompagne de la destruction de l'ensemble de son innervation. Un simple chronomètre permet de relever la fréquence des contractions qui est habituellement comprise entre 6 et 12 contractions par minute à la température du laboratoire. Entre 15°C et 40°C, la fréquence augmente avec la température. Au delà de 40-45°C, les contractions cessent. Des méthodes plus sophistiquées (enregistrement de l'électrocardiogramme, enregistrement des contractions, enregistrement video) permettent d'enregistrer automatiquement différents aspects de l'activité cardiaque et peuvent donc être mises à profit pour étudier expérimentalement l'action de divers facteurs physiques ou chimiques.
2. Enregistrement sur ordinateur des contractions cardiaques
L'enregistrement informatisé des contractions du cœur d'escargot isolé peut être réalisé avec différents types de capteurs comme, par exemple, un dynamomètre suffisamment sensible ou un montage optoélectronique (barrière optique, fourche optique) branchés sur une interface d'acquisition reliée à un ordinateur. Si l'on dispose d'un colorimètre, il suffit d'introduire le cœur isolé dans une cuvette standard remplie de liquide physiologique et de fixer sur le bord de la cuvette, par exemple avec une petite boule de pâte à modeler, un des deux fils de ligature mis en place lors de l'isolement du cœur. Si nécessaire, on peut lester le fil opposé avec un une autre boule de pâte à modeler de façon à maintenir le cœur dans la cuve dans la position voulue. La position adéquate est déterminée empiriquement de façon à ce que le faisceau lumineux de l'appareil soit intercepté au moins partiellement par l'organe. Dans ces conditions, les contractions cardiaques modifient la quantité de lumière reçue par le détecteur permettant ainsi d'obtenir un tracé graphique des contractions.
 |
Le cliché de la figure 2 montre le matériel utilisé (colorimètre et interface d'acquisition) pour obtenir les tracés présentés dans cette page. Pour enregistrer les contractions cardiaques sur ordinateur, l'interface est pilotée par un logiciel généraliste quelconque (Visuel-Orphy, Regressi). On peut se procurer l'ensemble du matériel ainsi que le logiciel d'acquisition chez le fabricant (Micrelec).
3. Résultats
Le tracé ci-dessous obtenu avec la méthode indiquée précédemment montre l'activité mécanique du cœur d'escargot pendant trois minutes d'enregistrement. Chaque accident correspond à une révolution cardiaque.
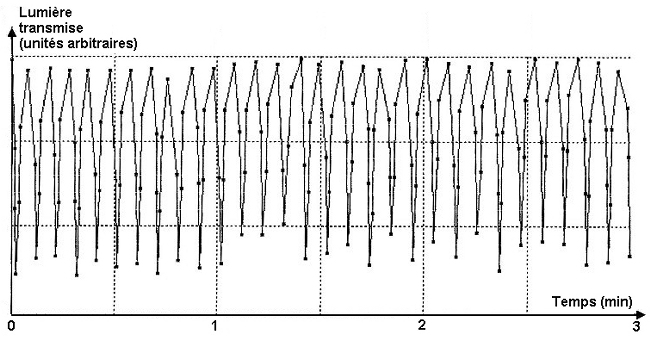 |
Pour obtenir ce tracé, aucun traitement particulier n'a été appliqué au cœur et les mesures ont été réalisées à la température du laboratoire (19-20°C). Dans ces conditions, la fréquence cardiaque mesurée est de 10 contractions par minute.
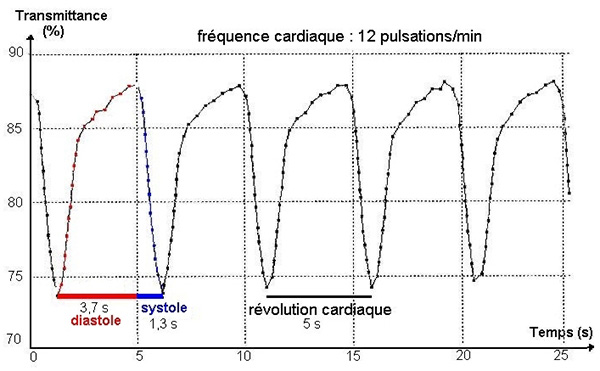
Un enregistrement sur une période plus courte permet d'identifier les phases de la révolution cardiaque.
La systole (1,3 s) est plus brève que la diastole (3,7 s) et elle est marquée par une variation plus abrupte du tracé. Le tracé correspondant à la diastole montre successivement une phase de relâchement rapide suivie d'une phase de relâchement plus lente :
 |
L'orientation des tracés peut être différente selon la manière dont le cœur est placé dans la cuve par rapport au faisceau lumineux et au photodétecteur de l'appareil. Si l'effet d'écran augmente lors de la systole, le tracé correspondant est dirigé vers le bas. En revanche, si l'effet d'écran diminue lors de la systole, le tracé correspondant est dirigé vers le haut.
Le dispositif permet également d'étudier l'action de facteurs physicochimiques :
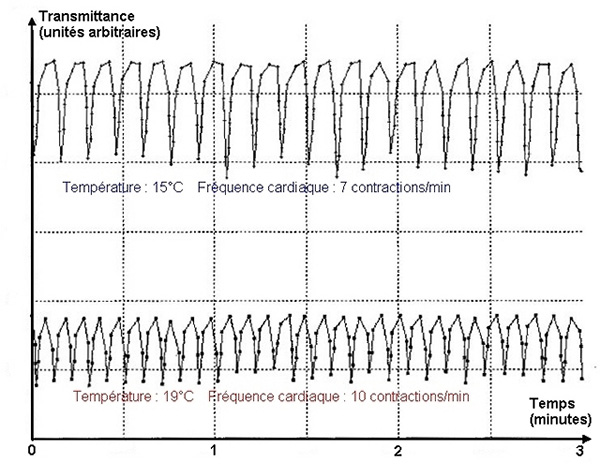 |
Les contractions cardiaques ont été enregistrées à deux températures différentes en remplaçant le liquide physiologique à température ambiante par du liquide plus froid et les tracés obtenus ont été superposés sur le même graphique. La diminution de température conduit à un ralentissement de la fréquence des contractions.





