Rôle des mitochondries dans le stress oxydatif. Production d'ERO et d'ERA. Lien avec la santé.
Les mitochondries sont des organites impliqués dans la production d’ATP. Ce faisant, elles fabriquent également des espèces chimiques appelées espèces réactives de l’oxygène ou ERO (ROS en anglais). Il s’agit notamment de l’anion superoxyde O2- et du peroxyde d’hydrogène H2O2. Les mitochondries produisent à elles seules près de 50 % des ERO dans les cellules tandis que le réticulum endoplasmique en produit aussi à hauteur de 25 %. Enfin les peroxysomes et des enzymes intracellulaires telles que les oxydases, les cyclo-oxygénases (enzymes impliquées dans la production des prostaglandines lors d’une réaction inflammatoire), les monoxygénases et les oxyde nitrique synthases (NOS) en produisent également.
Les espèces réactives de l’oxygène, des alliés à dose physiologique
Les espèces réactives de l’oxygène provoquent l’oxydation de différentes molécules dans les cellules. Ce processus n’est pas nécessairement dangereux. En effet, à des niveaux physiologiques, il permet l’oxydation des éléments vieillissants tels que les protéines ou les lipides ce qui permet leur élimination. L’accumulation d’éléments endommagés est en effet dangereuse pour une cellule qui peut en mourir directement (apoptose) ou glisser progressivement vers sa mort à travers un processus appelé la sénescence. La mort de ces cellules est ensuite compensée par la mise en place de nouvelles cellules.
À doses physiologiques, les ERO servent également à stimuler l’activité mitochondriale et la quantité de mitochondries (biogenèse mitochondriale). Les ERO bien contrôlés forment ainsi un puissant régulateur du métabolisme d’où l’idée que le maintien d’un stress modéré peut être bénéfique pour la santé.
Les espèces réactives de l’oxygène sont également utiles aux macrophages qui les utilisent pour détruire les pathogènes qu’ils ont ingérés. Par ailleurs, la présence d’ERO dans le sang est un signal qui stimule le système immunitaire pour se préparer à se défendre contre une invasion.
Une super défense antioxydante qui nous protège tous les jours
Les cellules sont capables de réguler leur concentration intracellulaire en espèces réactives de l’oxygène grâce à de nombreuses protéines. Parmi celles-ci, les super oxyde dismutases (ou SOD) transforment O2- en H2O2 tandis que la catalase transforme le peroxyde d’hydrogène H2O2 ainsi produit en H2O et O2. Ces deux types d’enzymes sont présents partout dans les cellules et se retrouvent notamment en grande quantité dans les mitochondries. Il arrive cependant que la défense antioxydante n’arrive plus à suivre l’accumulation des ERO ou qu’elle soit elle-même endommagée par ceux-ci. Les ERO s’accumulent alors dangereusement dans les cellules allant jusqu’à endommager les mitochondries et modifier la production d’énergie.
Les antioxydants, des produits à utiliser avec précaution
Pour contrer les ERO, impliqués notamment dans les cancers, l’homme a développé des molécules antioxydantes qui ont été testées comme thérapies pour ces maladies. On s’est cependant rendu compte que certains antioxydants ne tuaient pas les cellules cancéreuses mais bien au contraire les aidaient à proliférer. C’est ainsi que depuis 2014, des études ont démontré que deux antioxydants, le NAC (N-acétylcystéine) et la vitamine E (Tocophérol) favorisent la croissance tumorale. Ces résultats ont été largement médiatisés. Oui, certains antioxydants peuvent favoriser et même provoquer certains cancers, comme ceux des poumons ou de la peau. Il est donc fortement déconseillé aux patients en cours de traitement anti-cancer ou en ayant subi un de consommer des compléments alimentaires enrichis en certains antioxydants. Un avis médical est recommandé avant toute consommation. Rassurez-vous, les antioxydants naturellement présents dans l’alimentation (fruits et légumes) sont à des doses tellement faibles que leurs effets sont bénéfiques.
Pourquoi les antioxydants ne fonctionnent-ils pas toujours ?
Les espèces réactives de l’oxygène ne sont pas les seules molécules potentiellement dangereuses dans les cellules. Celles-ci fabriquent aussi les nitroxydants ou espèces réactives de l’azote (ERA ou RNS en anglais). Les ERA les plus connus sont l’oxyde nitrique (NO), les nitrites NO2-, les nitrates NO3- et les dangereux peroxynitrites (ONOO-), formés par réaction entre une ERA (NO) et une ERO (O2-). Les ERA sont produites par le métabolisme des acides aminés. En particulier, l’action des oxyde nitrique synthases (NOS) sur l’arginine est responsable de la production d’oxyde nitrique, également appelé monoxyde d’azote, NO. Une perturbation de l’activité des NOS (due à une exposition aux UV ou à leur oxydation par les ERO et ERA) peut entraîner la production d’ERO (O2-) par celles-ci. Les ERA et ERO provoquent en moyenne 150 000 oxydations de l’ADN nucléaire chaque jour, qui peuvent être à l’origine de cassures de l’ADN et de mutations.
Il existe un équilibre entre ERO et ERA dans les cellules. Les antioxydants, qui ciblent majoritairement les ERO, perturbent cet équilibre et peuvent donc créer des problèmes dans les cellules, par exemple en altérant la production énergétique mitochondriale. Il apparaît donc crucial de trouver de nouvelles molécules qui pourraient cibler à la fois les ERO et les ERA. Par exemple, le curcumin, une épice utilisée en cuisine, est un puissant antioxydant ayant cette double propriété intéressante. Nous travaillons également activement au laboratoire sur cette recherche de nouveaux antioxydants à double propriété.
Les stress oxydatifs ou nitrosatifs sont causés respectivement par une trop grande concentration en ERO ou ERA dans les cellules. La nourriture, les médicaments, les drogues et d’autres facteurs extérieurs (exposition aux UV, qualité de l’air, qualité de l’eau) peuvent constituer des facteurs perturbant l’équilibre ERO/ERA.
Le stress au cours de la grossesse et la pré-éclampsie
Au cours du premier trimestre d’une grossesse, l’implantation d’un embryon déclenche très rapidement un profond chamboulement qui s’accompagne par une baisse transitoire de la quantité de dioxygène dans l’utérus (une hypoxie locale transitoire). Cette chute en dioxygène favorise la mise en place du placenta en stimulant des cellules extrêmement sensibles, les cytotrophoblastes. Ceux-ci vont se modifier radicalement et pour certains vont même migrer autour des vaisseaux sanguins pour les dilater et permettre un apport important en dioxygène et en nutriments à l’embryon par le sang maternel. Mais parfois une mutation génétique peut ralentir ou bloquer les modifications des cytotrophoblastes. Les vaisseaux sanguins conservent un faible diamètre ce qui provoque de l’hypertension chez la mère et un manque de dioxygène et de nutriments pour l’embryon : c’est la pré-éclampsie. Celle-ci touche 8 millions de femmes enceintes dans le monde et est responsable de 500 000 décès par an (maman et bébé). Actuellement, il n’y a aucun traitement efficace.
La pré-éclampsie peut être due à une mutation du gène STOX1. La protéine STOX1 mutée s’accumule alors dangereusement dans le placenta. En collaboration avec le laboratoire du Dr. Daniel Vaiman, INSERM U1016, Institut Cochin, nous avons démontré que lors de la mise en place du placenta, STOX1 permet une profonde modification de l’équilibre ERO/ERA et une puissante stimulation des mitochondries. Nous avons démontré que lorsque STOX1 est muté, les mitochondries sont extrêmement perturbées et que la production de NO, un vasodilatateur des vaisseaux, diminue fortement. Nos travaux publiés en 2014 et toujours en cours, ouvrent ainsi la voie à une potentielle thérapie tournée vers les ERA dans les cas de pré-éclampsie [1].
Un autre désordre de la balance nitroso-rédox (équilibre ERO/ERA) se retrouve dans les cancers.
De nouvelles thérapies anti-cancer tournées vers les mitochondries
L’utilisation d’antioxydants pour traiter les cancers est très controversée. Une piste de recherche actuelle est, au contraire, d’utiliser des ERO et/ou ERA pour tuer les cellules cancéreuses.
Une autre piste de traitement des cancers serait de « réveiller » les mitochondries. En effet, les cellules cancéreuses produisent leur énergie essentiellement grâce à la glycolyse et non pas grâce à leurs mitochondries. Il a été démontré que le réveil des mitochondries provoque la mort des cellules cancéreuses. Le futur anti-cancer passera donc par le réveil des mitochondries et par la modulation à la fois des ERO et des ERA. Au laboratoire, nous tâchons de déterminer comment une cellule saine devient une cellule cancéreuse et comment cette dernière peut résister à un traitement anti-cancer et entraîner une récidive. Un de nos collaborateurs, le Prof. Jiri Neuzil en Australie a montré en 2015 que des cellules cancéreuses affaiblies ont la capacité de récupérer de l’ADN mitochondrial de cellules saines, ce qui augmente leur capacité de prolifération. Les recherches sur les transferts de mitochondries ou d’ADN mitochondrial de cellules à cellules prennent de l’ampleur [2] et notre laboratoire étudie cette thématique.
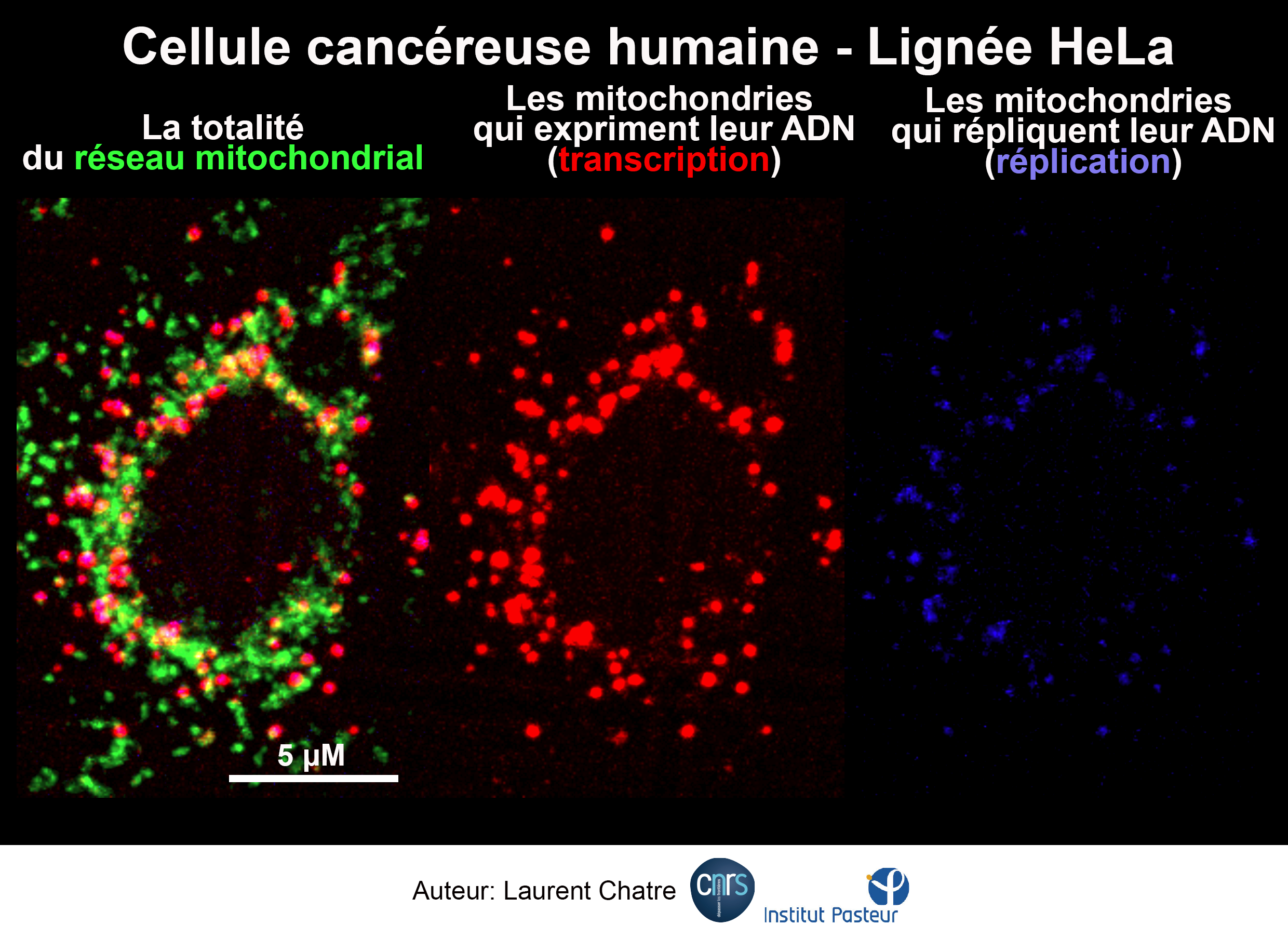
Cellule cancéreuse pour laquelle on a mis en évidence le réseau mitochondrial (en vert), les mitochondries pour lesquelles il y a transcription de l'ADN mitochondrial (en rouge) ou réplication de celui-ci (en bleu). Certaines mitochondries de la cellule cancéreuse ne font que de la transcription, d’autres que de la réplication, d'autres les deux et enfin d'autres aucun des deux. Il y a une hétérogénéité de l’activité mitochondriale dans les cellules cancéreuses. Dans les cellules saines, les mitochondries font la réplication et la transcription. Technologie d’imagerie mTRIP.
La lutte contre le cancer passe aussi par son diagnostic précoce. Au laboratoire, j’ai développé avec mes collaborateurs un nouvel outil d’imagerie des mitochondries, outil breveté et baptisé mTRIP, qui permet de détecter l’expression et la réplication de l’ADN des mitochondries en lien avec l’état énergétique et prolifératif des cellules. Cet outil a permis de démontrer que l’expression et la réplication de l’ADN des mitochondries sont coordonnées avec celles de l’ADN nucléaire au cours du cycle cellulaire, ce qui n’était pas bien admis avant. De plus, en détectant finement ces modifications mitochondriales, mTRIP est capable de mettre en évidence précocement un changement d’état prolifératif, bien avant d’autres marqueurs de stress. Cette technique pourrait donc permettre de contribuer au diagnostic précoce des cellules cancéreuses et même de maladies mitochondriales telles que les myopathies [3, 4]. Nous avons même démontré l’utilité de mTRIP pour détecter la cytotoxicité de molécules testées comme médicaments. L’action cytotoxique de celles-ci s’effectue en effet très souvent sur les mitochondries [5].
Si vous souhaitez en savoir plus sur le stress et notamment ses liens avec la douleur, vous pouvez visionner cette conférence Stress et douleur de Laurent Chatre.
Références
- Doridot, Chatre et al. 2014, Antioxidants & Redox Signaling, 20:49-54
- Tan et al. 2015, Cell Metabolism, 21(1) :81-94
- Chatre, Ricchetti. 2013, Journal of Cell Science, 126(Pt4):914-26
- Chatre, Ricchetti. 2013, Nucleic Acids Research, 41(5) :3068-78
- Chatre et al. 2016, Methods in Molecular Biology 1351:46-65