Caractéristiques essentielles des cellules animales et végétales. Nombreuses images, utilisant différentes techniques de microscopie (optique, électronique, à fluorescence...)
Introduction
En comparant des cellules d’origines différentes (essentiellement chez les eucaryotes), il est assez aisé de montrer, malgré une grande diversité, une unité structurale et fonctionnelle. Cependant, une cellule n’est pas observable directement.
Les documents photographiques sont présentés sous forme d’icônes. En cliquant dessus, vous accédez aux photos de grande taille.
Sur le même thème, voir aussi le document Comparaison cellule animale - cellule végétale.
La cellule vue en microscopie
Lorsque la cellule est isolée (organisme unicellulaire ou cellule isolée à partir d’un organisme pluricellulaire), l’emploi d’un microscope permet d’en observer une image agrandie qui reflète bien sa structure réelle, même si l’image est virtuelle sur le plan de l’optique.
L’observation du monde végétal
Chez les organismes pluricellulaires, des observations vitales peuvent être réalisées chez les végétaux, en utilisant des feuilles ou des thalles d’algues ne comportant qu’une ou quelques cellules en épaisseur (exemples : épiderme d’oignon, feuille d’élodée, lentille d’eau, ulve). Il est aisé dans ce cas d’observer un noyau, des organites (les chloroplastes, quand ils existent, sont les plus visibles) mais la présence d’une paroi extracellulaire empêche la visualisation de la membrane plasmique. Or, la mise en évidence de celle-ci est primordiale pour définir la notion même de cellule (limite entre l’intérieur cellulaire et le milieu extracellulaire).
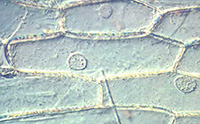 Épiderme de bulbe d'oignon Épiderme de bulbe d'oignon |
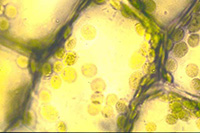 Feuille d'élodée du Canada Feuille d'élodée du Canada |
Des techniques permettent de lever cet obstacle. La plasmolyse d’un tissu permet, en provoquant une diminution de volume du cytoplasme (vacuole comprise) de séparer la paroi cellulaire de la membrane plasmique qui est ainsi mise en évidence.
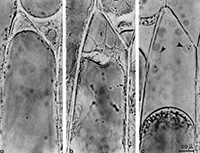 Plasmolyse progressive d'une cellule d'épiderme d'oignon Plasmolyse progressive d'une cellule d'épiderme d'oignon |
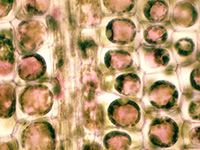 Cellules plasmolysées d'une feuille d'élodée Cellules plasmolysées d'une feuille d'élodée |
Une autre méthode expérimentale consiste à éliminer la paroi cellulaire par digestion enzymatique (cellulases et pectinases) après une plasmolyse préalable. L’observation de telles cellules sans paroi (des protoplastes) montre bien qu’une membrane plasmique isole la cellule du milieu extérieur.
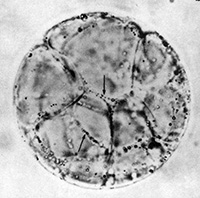 Protoplastes non chlorophylliens Protoplastes non chlorophylliens |
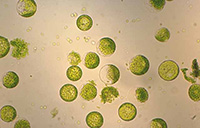 Protoplastes chlorophylliens Protoplastes chlorophylliens |
La notion de cellule a été la première fois définie en observant des coupes de liège. Des coupes de tissus végétaux, montées telles quelles ou après une coloration anatomique montrent à l’évidence qu’un organisme est essentiellement formé de cellules. Ne perdons pas de vue que dans une coupe anatomique végétale, c’est essentiellement les parois (donc le réseau de matrice extracellulaire) que l’on observe, membrane plasmique, cytoplasme, noyau et organites ayant souvent été éliminés !
 Un exemple de coupe anatomique chez les végétaux. Section transversale de tige de labiée. Un exemple de coupe anatomique chez les végétaux. Section transversale de tige de labiée. |
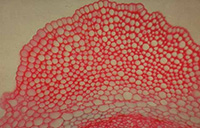 Un exemple de coupe anatomique chez les végétaux. Détail du collenchyme. Un exemple de coupe anatomique chez les végétaux. Détail du collenchyme. |
Les coupes histologiques d’échantillons animaux
Chez les organismes pluricellulaires (principalement animaux), la généralisation de la notion de cellule (ainsi que l’observation de leur diversité) peut être approfondie par l’examen de coupes histologiques. Cependant, ce que l’on observe n’est plus une image simplement agrandie des cellules. Les tissus ont subi une fixation, une déshydratation complète puis une inclusion. Les tissus sont ensuite sectionnés et l’on observe une tranche de cellule et non une cellule complète. Enfin, la section est peu observable telle quelle et doit être colorée. Les images observées dépendent alors autant de la technique de préparation que de la structure de la cellule.
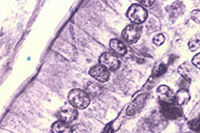 Intestin Intestin |
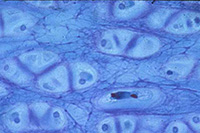 Cartilage Cartilage |
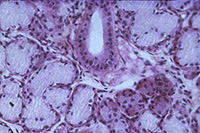 Glande salivaire Glande salivaire |
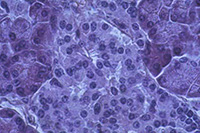 Pancréas Pancréas |
La microscopie à fluorescence
La virtualité des images observées augmente lorsque les techniques de visualisation concernent un élément spécifique. C’est tout particulièrement le cas avec la technique de l’immuno-fluorescence.
Les cellules ont été traitées par un colorant spécifique de l’ADN (le DAPI, fluorescence bleue) et par un anticorps marqué à la fluorescéine (fluorescence verte) dirigé contre la tubuline. Les deux images obtenues peuvent être superposées (Clichés Philippe Guillaud).
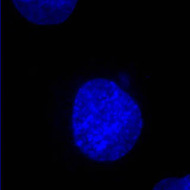 Cellule PtK : DAPI Cellule PtK : DAPI |
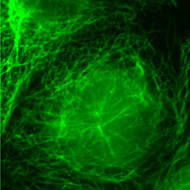 Cellule PtK : anti-tubuline Cellule PtK : anti-tubuline |
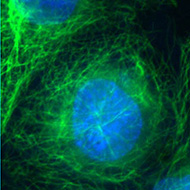 Superposition des deux images Superposition des deux images |
La microscopie électronique
En microscopie électronique à transmission classique, la visualisation des structures dépend essentiellement du dépôt de métaux lourds (opaques aux électrons). Cela permet une visualisation générale des structures protéiques. Par suite de la très faible épaisseur des sections l’interprétation dans l’espace est souvent difficile.
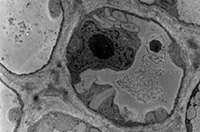 Cellule jeune de collenchyme (contrastant général) Cellule jeune de collenchyme (contrastant général) |
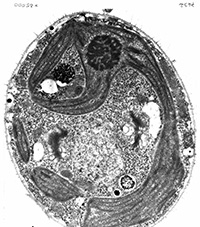 Chlamydomonas (contrastant général) Chlamydomonas (contrastant général) |
Des techniques plus sophistiquées (cytochimie, coloration négative, cryofracture, etc.) permettent de mettre en évidence des composants autrement invisibles.
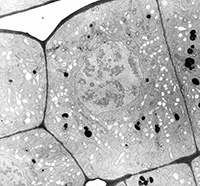 Racine de pois (Cytochimie des polysaccharides) Racine de pois (Cytochimie des polysaccharides) |
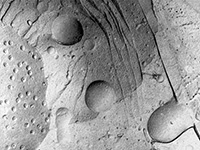 Racine de pois (cryofracture) Racine de pois (cryofracture) |