Auteur : Didier Pol
Table des matières
1. Introduction
C'est en 1924 que le biochimiste russe A. Oparine publia une monographie dans laquelle il proposait que des substances organiques synthétisées sous l'action du rayonnement ultraviolet puissent être à l'origine de la vie sur Terre à la suite d'une évolution chimique prébiotique. Le biochimiste anglais J.B.S. Haldane présentait des idées similaires en 1929. Oparine et d'autres chercheurs comme le chimiste américain Sydney Fox s'intéressèrent aux processus par lesquels des macromolécules en solution peuvent conduire à la formation de gouttelettes colloïdales en suspension dans une solution aqueuse, forme simple de compartimentation. Ils obtinrent des gouttelettes limitées par des polymères qu'ils appelèrent coacervats, protéinoïdes ou microsphères. Ces goutelettes présentaient certaines caractéristiques de cellules. Elles se révélèrent en effet capables d’abriter des réactions élémentaires comme l’accumulation transmembranaire de substances ou le transport d'électrons à l'image d'un métabolisme primitif. Diverses associations de polymères permettent de former de telles goutelettes : glucides et protéines, protéines et protéines, protéines et acides nucléiques. Les coacervats ne correspondent pas aux premières cellules vivantes, d'autant qu'ils sont constitués de matériaux résultant du métabolisme cellulaire actuel. Ils peuvent constituer cependant des modèles de fonctionnement chimique d'unités séparées de leur milieu par une membrane.
2. Protocole
- Mélanger dans un tube à essai 5 mL d’une solution de gélatine à 1 % avec 3 mL d’une solution de gomme arabique à 1 %. Recouvrir de parafilm et bien mélanger en agitant.
- Mesurer le pH de la solution et le noter.
- Monter une goutte de la solution sur une lame porte objet et l’observer au faible grossissement du microscope (objectif 10 x). Mettre la lame de côté.
-
Ajouter goutte à goutte une solution d’acide chlorhydrique à 1 % dans le tube à essai et bien agiter après chaque goutte. Attendre après chaque goutte pour vérifier si la solution devient trouble. Si elle reste limpide, ajouter une nouvelle goutte. Quand la solution devient trouble, bien agiter. Si elle s’éclaircit de nouveau, ajouter une nouvelle goutte d’acide.
Attention : si l’acide chlorhydrique est en excès, le trouble disparaît. Dans ce cas, le pH est devenu trop bas pour obtenir des coacervats et les opérations doivent être recommencées. - Quand la solution reste trouble en permanence, mesurer de nouveau le pH, le noter et préparer une autre lame avec une goutte. À ce stade, des coacervats devraient être visibles, éventuellement au grossissement moyen. Comparer avec la première lame dans laquelle il n'y a pas de coacervats.
- Observer au fort grossissement du microscope.
| Figure 1A : Coacervats en microscopie optique (faible grossissement) | Figure 1B : Coacervats en microscopie optique (fort grossissement) |
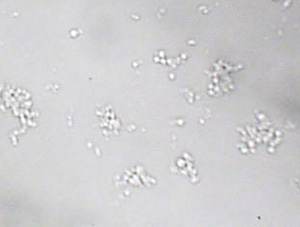 |
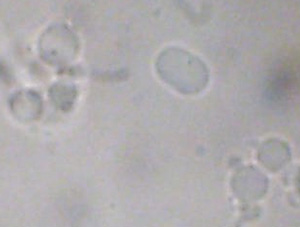 |
| Les coacervats peuvent être observés sans coloration comme ci-dessus mais l'utilisation d'un colorant les rend mieux visibles et permet de montrer qu'ils sont capables d'accumuler des substances chimiques. On peut essayer divers colorants, bleu de méthylène, rouge neutre, rouge Congo. | |
- Colorer les coacervats avec du bleu de méthylène en mélangeant sur des lames différentes une goutte de la solution avec une goutte de chaque colorant et recouvrir d’une lamelle.
- Observer au microscope.
| Figure 2A : Coacervats colorés par le bleu de méthylène (moyen grossissement) | Figure 2B : Coacervats colorés par le bleu de méthylène (fort grossissement) |
 |
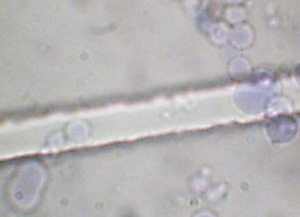 |
| Un échantillon a été introduit dans la chambre d'une lame de numération dont les traits de grille ont une épaisseur de 15 µm. On peut ainsi évaluer le diamètre des coacervats de 10 à 20 µm environ. | |




