En domestiquant les plantes et les animaux dont elle se nourrit, l'espèce humaine a, involontairement, modifié les pressions de sélection qui pèsent sur elle.
Introduction
Avant les débuts de l’agriculture, les sociétés humaines pratiquaient la chasse et la cueillette pour se nourrir. Puis une transition s’est effectuée vers l’agriculture et l’élevage grâce à la domestication d’espèces végétales et animales, au cours de ce qu’on appelle la révolution néolithique. Cette révolution s’est déroulée entre 10 000 et 2 500 ans av. JC, et a débuté indépendamment dans plusieurs régions du globe, dont la plus connue est le croissant fertile en Mésopotamie. Elle s’est ensuite propagée grâce à des migrations de populations et des diffusions de connaissances vers d’autres régions, comme l’Europe ou l’Asie. C’est un tournant majeur dans l’histoire humaine, car le développement de l’agriculture a permis la sédentarisation et la formation de villages puis de villes, la modification importante de l’environnement pour l’adapter à cette nouvelle production, la possibilité d’une économie de commerce, mais a aussi été à l’origine d’une modification de l’alimentation et des interactions avec les autres espèces – domestiquées ou parasites. Tous ces changements ont provoqué une modification des pressions de sélection s’exerçant sur les populations humaines. Alors que l’être humain est souvent considéré comme une nouvelle force influençant l’évolution des espèces domestiques (comme le montre l’analogie entre sélection artificielle et sélection naturelle) et comme étant en quelque sorte en dehors de la nature (avec l’opposition nature culture), les conséquences de la révolution néolithique montrent qu’il a aussi été, involontairement, un acteur de sa propre évolution. Nous verrons au travers de divers exemples comment l’humain, en modifiant lui-même son mode de vie, a indirectement influé sur sa propre évolution.
De grands enfants
Un des caractères dérivés du groupe des Mammifères est la production de lait pour nourrir les petits. Le sucre présent dans le lait est le lactose, qui est composé de glucose et de galactose. L’accès à cette source d’énergie par les petits mammifères est rendue possible par la production en grande quantité dans leur intestin grêle de la lactase, enzyme capable de séparer les deux monomères formant le lactose. Après le sevrage, la plupart des Mammifères ne produisent plus cette enzyme, devenue inutile, et sûrement coûteuse à produire. Pourtant, un tiers des humains continue de pouvoir digérer le lactose une fois adulte.
Génétique
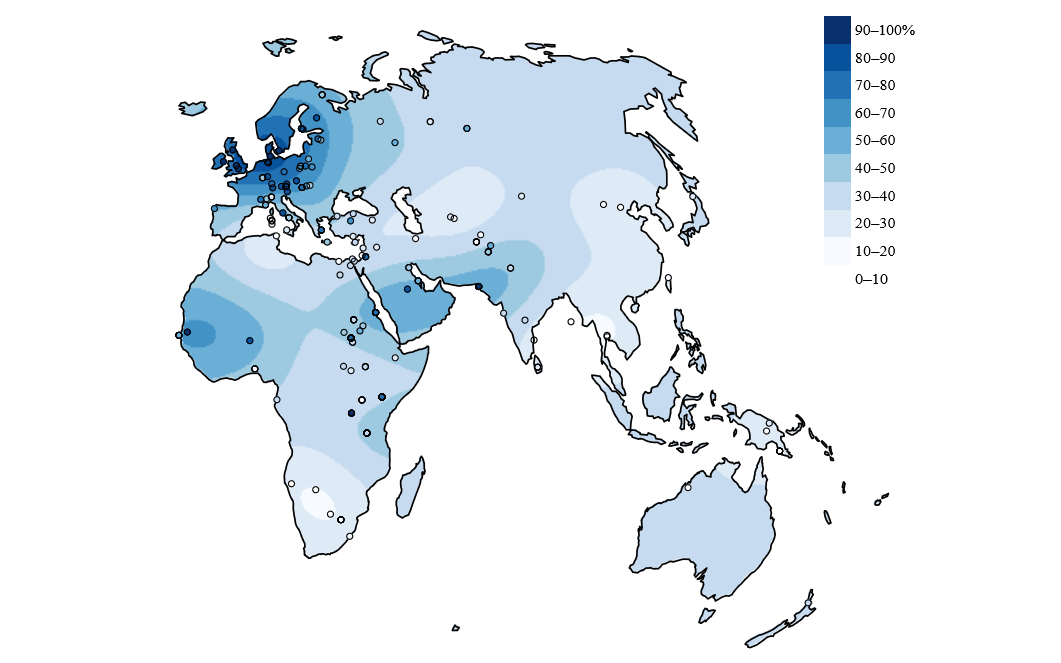
Pourcentage d’adultes dans les populations indigènes pouvant digérer le lactose.
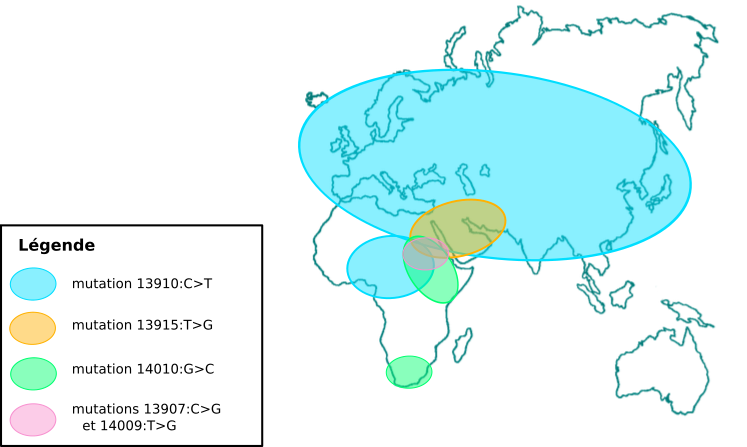
La lactase est codée par le gène LCT qui est situé sur le chromosome 2 chez l’homme. Chez les individus ne produisant pas la lactase à l’âge adulte, la transcription est inhibée après le sevrage, tandis qu’elle continue chez les personnes digérant le lactose. Cette capacité a été étudiée dans de nombreuses populations, et cinq mutations causales ont été identifiées. Ces cinq mutations sont situées à environ 14 kb en amont du promoteur, et constituent chacune un nouveau site de fixation pour un facteur de transcription activant l’expression de LCT. Ces mutations sont apparues indépendamment à plusieurs endroits du globe et sont responsables du phénotype de lactase persistence (LP). L’une d’elles est surtout présente en Europe, Asie et Afrique du Nord, une autre est principalement présente en Afrique et dans la péninsule arabique, tandis que les trois autres sont surtout présentes en Afrique (Fig 2).
Figure réalisée à partir des données de Ségurel L. et Bon C. (2017) [1]
Avantages et sélection
Des études de génétique évolutive se sont penchées sur ces mutations, et ont permis de montrer que le locus du gène LCT avait été soumis à de fortes pressions de sélections [1]. La sélection a été aussi forte sur ce locus que sur ceux apportant une résistance à la malaria dans les régions touchées par cette maladie, et plus forte que pour la sélection pour les peaux plus claires aux latitudes élevées ou la réponse à l’hypoxie chez les Tibétains. Cette sélection s’est effectuée il y a entre 2 000 et 20 000 ans lors du Néolithique, et est un peu plus ancienne en Europe qu’en Asie. On remarque également qu’elle a eu lieu indépendamment dans différentes régions, sur des allèles apparus indépendamment, ce qui confirme le caractère avantageux de ces mutations. Le phénotype de digestion du lactose est donc un exemple de convergence évolutive.
La révolution néolithique, et plus précisément la domestication d’animaux il y a environ 10 500 ans, a permis de faire du lait une nouvelle ressource alimentaire, contenant lipides, protéines, sucres, mais aussi vitamine D, sels minéraux et eau. Nous savons qu’il était déjà consommé dès le début du Néolithique et parfois transformé, grâce à des traces de protéines retrouvées dans des poteries [2]. Cependant, en consommer en quantité relativement importante n’est pas possible pour les adultes ne produisant pas la lactase. Les intolérants au lactose peuvent subir des problèmes digestifs assez importants (diarrhées, flatulences, constipation) suite à une consommation trop élevée de lait. Selon l’hypothèse historico-culturelle, la plus répandue actuellement, les mutations permettant la digestion du lactose à l’âge adulte se seraient propagées dans la population car les individus les portant auraient pu étendre leur régime alimentaire et profiter de cette nouvelle source de nutriments. Cette hypothèse est soutenue par la forte corrélation observée entre l’agro-pastoralisme et la proportion d’adultes pouvant digérer le lactose.
Ce paramètre n’est cependant pas le seul à prendre en compte, car même les adultes ne produisant plus la lactase peuvent consommer du lait en petite quantité et ainsi profiter de ses nutriments sans trop de gêne, voire consommer ses produits dérivés comme le fromage, la crème, le beurre, beaucoup moins riches en lactose (Table 1). De plus, certaines populations élevant des animaux laitiers ont une faible proportion d’adultes digérant le lactose (Kazakhs, Mongols, certains éleveurs en Afrique), ce qui semble contradictoire avec cette hypothèse. D’autres hypothèses ont été proposées pour expliquer l’avantage de ce phénotype, comme l’apport en eau propre, en électrolytes, ou en calcium permis par la consommation de lait. Cependant ces éléments pouvaient être obtenus par d’autres moyens, comme les produits laitiers dérivés. De plus, ces hypothèses n’ont pas pu être vérifiées par les études qui ont été réalisées.
| Type de produit laitier | Teneur en lactose (g pour 100 g) |
|---|---|
| Lait entier (vache, chèvre, brebis) | 4-5 |
| Lait entier (jument, ânesse, femme) | 6-7 |
| Lait entier (renne) | 2-3 |
| Fromage | 0-2 |
| Yaourt | 2-3 |
| Crème | 3-4 |
| Beurre | 0,5-1 |
En revanche, d’autres paramètres ont pu être identifiés pour compléter l’hypothèse historico-culturelle, notamment le microbiote. Ainsi, une flore intestinale adaptée et une alimentation diversifiée peuvent réduire les désagréments liés à la consommation de lait frais. Le lactose est alors fermenté par certaines bactéries de la flore intestinale (comme Bifidobacterium) ce qui peut permettre la réduction des symptômes (notamment le risque de diarrhée) et la production d’acides gras à chaîne courte disponibles pour l’hôte [1]. En Europe, un déséquilibre alimentaire dû à une forte consommation de céréales au détriment d’autres aliments (produits animaux, fruits et légumes) aurait pu accentuer l’avantage des porteurs de la mutation 13910:C>T du gène LCT. À l’inverse, si le lait était systématiquement transformé pour des raisons culturelles ou climatiques (peuples nomades, conservation pour une saison pauvre, etc.), l’avantage apporté par la mutation était alors moins important, ce qui peut expliquer une sélection plus faible. Ainsi, plus qu’avec le pastoralisme, la persistance de la lactase est positivement corrélée avec la quantité de lait non transformé consommé. De plus, toutes les espèces laitières ne produisent pas un lait aussi riche en lactose, et certains laits sont donc plus digestes que d’autres, ce qui peut permettre leur consommation par les adultes ne produisant plus la lactase. Cependant, même si la mutation était sélectionnée dans une population, des immigrations en provenance de populations ne possédant pas cette mutation peuvent ralentir la diffusion de l’allèle.
Bilan
Produire la lactase à l’âge adulte apporte l’avantage de pouvoir obtenir du glucose à partir du lait sans trouble digestif, et les allèles permettant cela ont été fortement sélectionnés dans les populations agro-pastorales après la révolution néolithique. Cependant, cette faculté à digérer le lait à l’âge adulte et l’apport énergétique lié n’expliquent pas à eux seuls la répartition des allèles dans la population mondiale. Cet avantage a pu en effet être accentué dans le cadre d’une alimentation déséquilibrée, comme ce fut le cas en Europe, ou au contraire compensé par une flore intestinale adaptée, une alimentation diversifiée ou une transformation du lait en fromage. Cette hypothèse historico-culturelle rassemble donc de nombreux paramètres, aussi bien physiologiques, que culturels et démographiques.
Les céréales comme base de l’alimentation
Le développement de l’agriculture suite à la révolution néolithique a été étroitement lié à la domestication de différentes espèces de céréales. Cette domestication a consisté à sélectionner certains caractères utiles à l’humain, comme le maintien des graines en épi à maturité, des glumes plus petites ou non fusionnées aux graines (graines nues), et enfin des graines plus grosses et donc plus riches en amidon, source de glucose importante dans l’alimentation humaine.
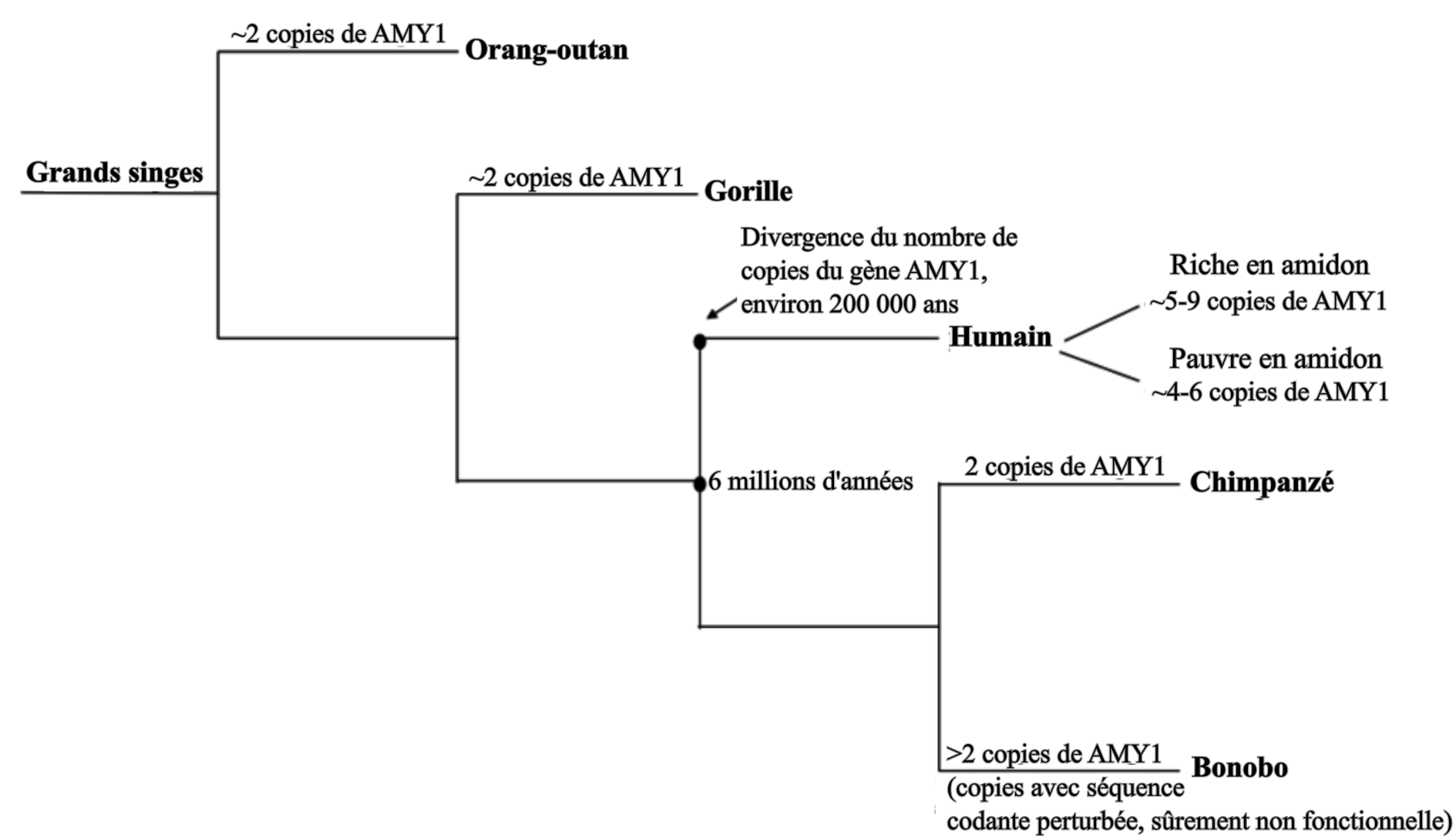
L’amidon est un polymère de glucose et la principale forme de stockage de l’énergie chez les végétaux. Son hydrolyse, et donc la récupération du glucose absorbable et utilisable par l’organisme, est possible grâce aux amylases. Ces enzymes existent sous deux types chez les Primates, l’amylase salivaire (AMY1) et l’amylase pancréatique (AMY2), dont les gènes sont regroupés en un cluster multigénique. Parmi les Primates, les humains sont les seuls à posséder de fortes concentrations d’amylase salivaire, ce qui s’explique par les multiples copies du gène AMY1 dans le cluster, non présentes chez les autres Primates (Fig 3). Ces copies permettent une production plus importante d’enzymes, ce qui mène à une digestion plus importante de l’amidon dans la bouche. De multiples copies de AMY2 sont par ailleurs présentes chez les chiens, mais pas chez les loups (les chiens n’expriment pas l’amylase salivaire), signe du changement de régime alimentaire lors de la domestication [3]. Le nombre de copies de AMY1 varie d’une population humaine à l’autre (CNV, Copy Number Variation), et leur apparition, encore mal datée, est estimée à remontant à moins d’un million d’années, et potentiellement causée par des transpositions virales. Par comparaison avec les génomes anciens, les plus hauts nombres de copies (hauts CNV) seraient apparus après la divergence de sapiens d’avec les dénisoviens et les néandertaliens, il y a entre 450 000 et 660 000 ans.
Selon Hardy et al. (2015) [3], cette particularité humaine serait corrélée au changement de mode d’alimentation. En effet, la maîtrise du feu et la cuisson des aliments ont permis de faciliter la digestion des aliments, entraînant des changements au niveau de l’appareil digestif : raccourcissement du tube digestif, diminution de la capacité à digérer les fibres et les végétaux crus, diminution de la taille des dents, etc. Si l'amidon cristallin est peu accessible pour les amylases salivaires et donc difficile à digérer, la cuisson (hydrothermale) permet de le gélifier, ce qui le rend accessible pour ces enzymes qui peuvent commencer sa digestion avant même son arrivée dans l'intestin. Avec le développement de la cuisson des féculents, le paramètre limitant l'assimilation de l'amidon serait alors devenu sa digestion avant son arrivée dans l’intestin, et non plus son accessibilité. Un nombre important de copies de AMY1 serait alors devenu un avantage évolutif, ce qui aurait contribué à sa transmission. De plus, une meilleure assimilation du glucose de l’amidon aurait favorisé le développement du cerveau, organe très consommateur de ce nutriment. La cuisson aurait aussi permis une digestion plus facile pour les jeunes enfants qui ne produisent pas encore l’amylase pancréatique (50 % de la digestion de l’amidon se fait dans la bouche), permettant un sevrage plus précoce et une réduction du temps entre les naissances.
Cette évolution aurait eu lieu longtemps avant la révolution néolithique, mais on observe le même schéma du changement d’alimentation causant un changement de pressions de sélection et donc la sélection d’allèles particuliers (ici des CNV). L’humain commença donc à être adapté à la consommation d’amidon avant même le début de la domestication des céréales, par exemple grâce à la consommation de tubercules ou d’autres organes de réserve végétaux, souvent riches en amidon.
De nouveaux dangers
Le développement de l’agriculture et l’urbanisation n’ont pas eu que des effets positifs sur l’évolution humaine. Ils ont aussi permis la rencontre de nouveaux pathogènes, et favorisé la propagation d’anciens.
La tuberculose et la densité de population
La tuberculose est une maladie infectieuse des poumons, causant également des lésions osseuses (reconnaissables sur les fossiles), et très souvent associée à la pauvreté et une forte densité de population. Malgré les croyances précédentes [4], la souche humaine est plus ancienne que la souche bovine, et la tuberculose était donc déjà présente dans les populations humaines bien avant la domestication du bétail. Cependant, le développement de l’agriculture fut liée à une croissance démographique importante des populations humaines, ainsi qu’à une urbanisation croissante. Cela contribua à l’augmentation de la densité de population, l’agriculture permettant de subvenir aux besoins de villes de plus en plus grandes. Cette densité de population, associée au commerce et aux migrations, a facilité la propagation du bacille tuberculeux dans les populations humaines [5], augmentant par la même la pression de sélection qui lui était associée. Cette coévolution a continué pendant la colonisation des différents continents, amenant à la différenciation de plusieurs souches bien localisées (Asie, Océanie et Asie du Sud-Est, Europe…). Si différentes souches géographiques sont apparues, on constate également un polymorphisme humain dans certains gènes de l’immunité innée, première barrière contre les infections, aussi corrélé à la géographie et donc aux différentes souches bactériennes.
Autres paramètres
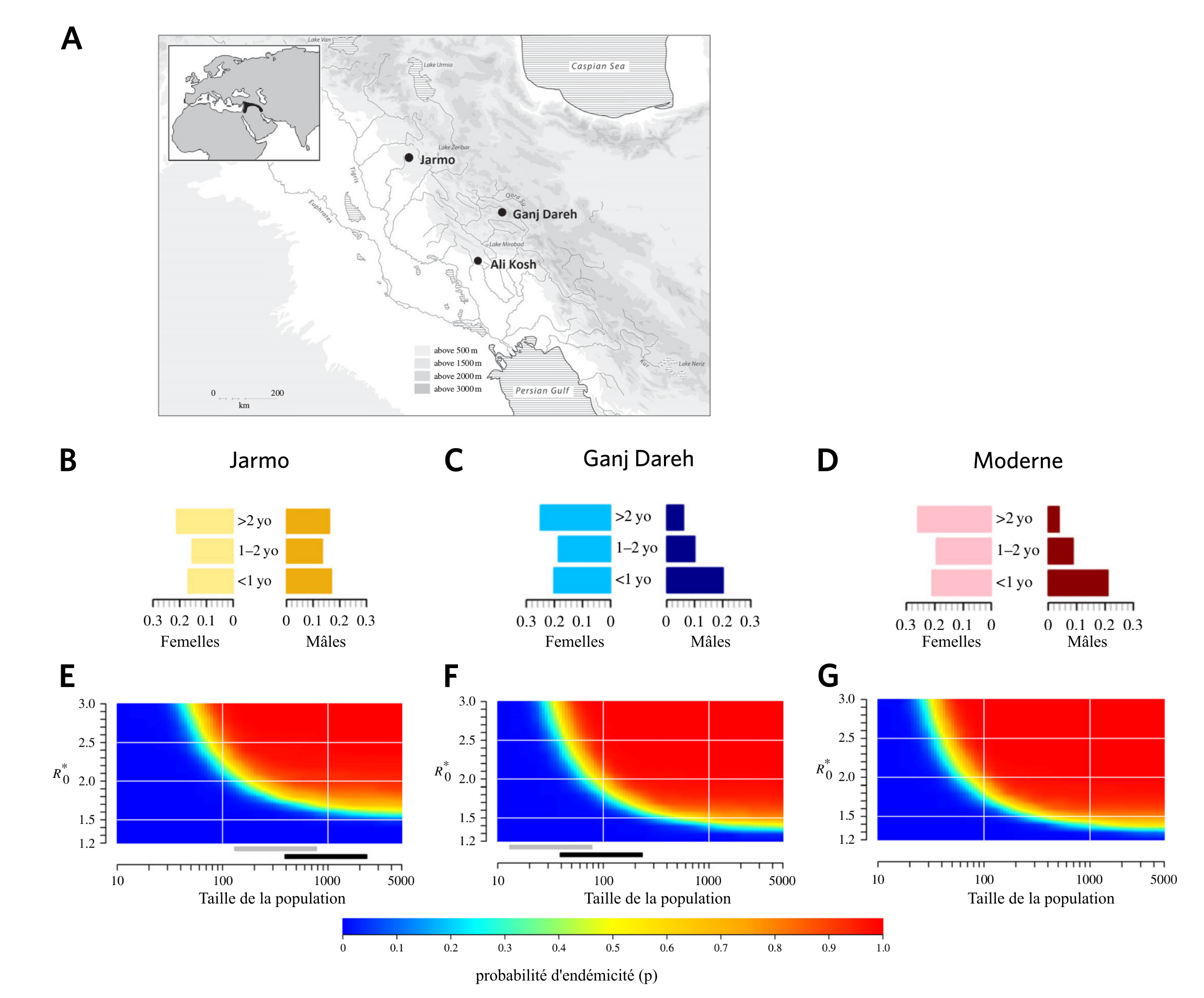
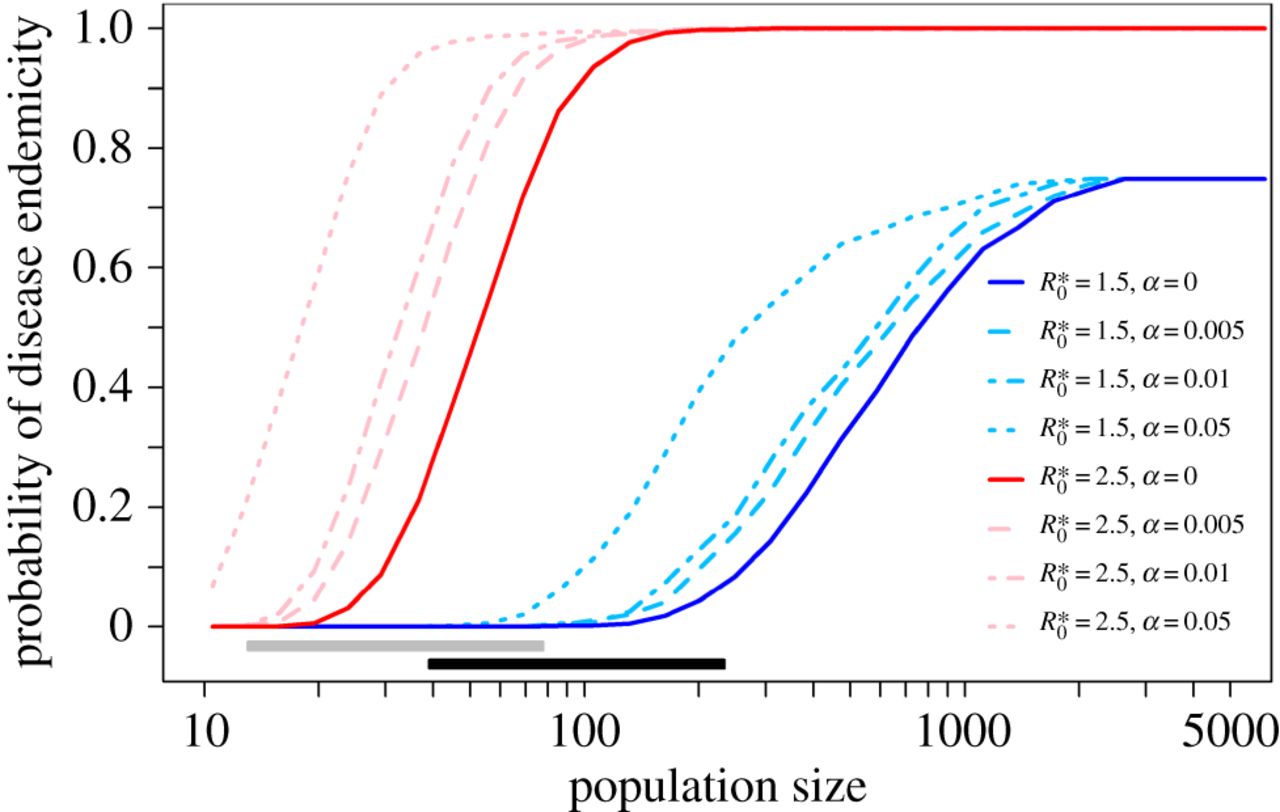
La brucellose est une maladie provoquée par l’infection par Brucella melitensis, notamment via la consommation de produits laitiers non pasteurisés ou le contact d’animaux infectés (le plus souvent ovins et caprins). Cette maladie d’origine zoonotique est supposée avoir émergé suite à la domestication de ces animaux au cours du Néolitihique. Pour tester cette hypothèse et l’influence des conditions d’élevage sur la transmission de la maladie, des chercheurs ont modélisé cela à partir de données paléontologiques [6]. Ils ont ainsi confirmé que la concentration des animaux et des hommes provoquée par le développement de l’agriculture est bien un facteur favorisant la transmission des maladies. La propagation de Brucella melitensis est également favorisée par un sex ratio modifié par l’abattage des jeunes mâles pour la consommation de viande (les femelles étant les plus contagieuses) (Fig 4), ou encore les migrations entre villages proches, qui permet de maintenir la bactérie dans la méta-population plus facilement et de la réintroduire dans les villages où elle a disparu (Fig 5).
Haut : A. Carte montrant la localisation de deux sites archéologiques du Croissant fertile : Jarmo et Ganj Dareh.
Milieu : B et C. Profils démographiques des populations de chèvres des villages de Jarmo et de Ganj Dareh, déduits de l’étude des restes fossiles. D. Profil démographique théorique d’une population moderne de chèvres, déduit d’après d’après les caractéristiques des chèvres actuelles. L’échelle horizontale représente le pourcentage de la population ayant l’âge indiqué (supérieur à deux ans, entre un et deux ans, inférieure à un an ; yo : years old).
Bas : Probabilité p de maintien de la brucellose dans une population de chèvres en fonction de la taille de la population et du R*0 qui correspond au nombre moyen de nouveaux cas à partir d’un seul individu malade dans une population saine. La valeur de R*0 dépend du profil démographique de la population considérée.
Plus la taille de la population est grande et plus R*0 est élevé, plus la probabilité que la maladie soit endémique (qu’elle persiste dans la région considérée) est importante. Les barres grises et noires montrent les étendues des populations en supposant une densité de population de 100 à 300 individus par hectare, respectivement. À Ganj Dareh (F), comme le profil démographique est proche du profil moderne (G), la probabilité d’endémicité est très proche de la probabilité moderne, contrairement à celle de Jarmo (E), qui présente un profil démographique différent de l’actuel.
α représente la proportion de contact qu’une chèvre a avec des chèvres d’autres villages. R*0 correspond au nombre moyen de nouveaux cas à partir d’un seul individu malade dans une population saine. Le R*0 utilisé dans cette simulation est celui d’une population moderne de chèvres. Les barres grises et noires montrent les étendues des populations en supposant une densité de population de 100 à 300 individus par hectare, respectivement. On voit que l’augmentation des migrations entre populations (valeur de α élevée), par exemple dues au commerce, favorisent le maintien de la brucellose dans la métapopulation.
Conclusion
Lorsqu’il est question de sélection en évolution, il s’agit le plus souvent de sélection naturelle ou de sélection artificielle, ou des parallèles entre les deux. L’être humain, en sélectionnant des caractères d’intérêt dans les populations de plantes et d’animaux domestiqués réalise une sélection artificielle. Ce faisant, il s’expose en retour, involontairement, aux pressions de sélection (naturelle) induites par ces organismes . En voulant modifier des espèces pour son utilisation propre, l’espèce humaine a en fait modifié les contraintes de son environnement et par la même la direction de son évolution. Nous avons ici vu l’exemple de l’élevage d’animaux laitiers et la sélection de la persistance de la lactase, et celui de la cuisson des aliments favorisant la sélection de certains gènes qui devenaient alors avantageux. De façon intéressante, ces sélections ne se sont pas uniquement effectuées sur les humains, mais aussi sur les animaux domestiques, comme les chiens ayant plus de copies de l’amylase que les loups. Cependant, ces modifications liées à la sélection artificielle ne se font pas toujours à l’avantage du sélectionneur. En effet, l’élevage artificiel, la concentration des animaux et des hommes ont permis la mise en place de conditions favorables à la transmission de maladies zoonotiques. Plus récemment, l’abus des antibiotiques a illustré le même phénomène, avec l’apparition de souches bactériennes résistantes à tous les antibiotiques connus.
La sélection naturelle n’est donc pas une force simple, et ne peut le plus souvent pas être résumée à des contraintes fixes de l’environnement sur une population donnée. Cela est d’autant plus vrai dans le cas de l’espèce humaine, ou des autres espèces architectes, qui modifient profondément leur environnement et donc les contraintes qu’elles subissent. L’environnement exerce un ensemble de pressions sur les individus, mais des interactions inverses existent également.
Références
- Ségurel L. and Bon C., On the Evolution of Lactase Persistence in Humans, Annual Review of Genomics and Human Genetics (2017) 18:297-319
- Evershed RP, Payne S, Sherratt AG, Copley MS, Coolidge J, et al. 2008. Earliest date for milk use inthe Near East and southeastern Europe linked to cattle herding. Nature 455:528–31
- Karen Hardy, Jennie Brand-Miller, Katherine D.Brown, Mark G. Thomas, Les Copeland, The Importance of Dietary Carbohydrate in Human Evolution, The Quarterly Review of Biology 90, no. 3 (September 2015): 251-268.
- HershkovitzI, et al., Tuberculosis origin: The Neolithic scenario, Tuberculosis (2015), http://dx.doi.org/10.1016/j.tube.2015.02.021
- Perrin P, Human and tuberculosis co-evolution: an integrative view, Tuberculosis (2015), http://dx.doi.org/10.1016/j.tube.2015.02.016
- Fournié G, Pfeiffer DU, Bendrey R. (2017) Early animal farming and zoonotic disease dynamics: modelling brucellosis transmission in Neolithic goat populations. R. Soc. open sci. 4: 160943. http://dx.doi.org/10.1098/rsos.160943
- Joe Roe - Own work (http://www.joeroe.eu/blog/lactose-intolerance-around-the-world/) Data Itan, Yuval (2010). "A worldwide correlation of lactase persistence phenotype and genotypes". BMC Evolutionary Biology10: 36. DOI:10.1186/1471-2148-10-36. PMID20144208. PMC: 2834688. ISSN1471-2148. Global Lactase persistance Association Database. Molecular and Cultural Evolution Lab. University College London (April 2012).