L’épidémie récente du virus Zika, notamment en Amérique, et les maladies neurologiques qui lui sont associées ont déclenché une urgence de santé publique internationale. De nombreuses études scientifiques ont alors vu le jour afin de comprendre comment le virus Zika se multiplie. Un des moyens pour y parvenir est l’utilisation de la vidéo-microscopie pour filmer en temps réel l’infection par le virus Zika dans des cultures de cellules humaines. Grâce à cette méthode on a pu observer d’importants changements morphologiques menant à l’implosion et la mort des cellules infectées.
Introduction
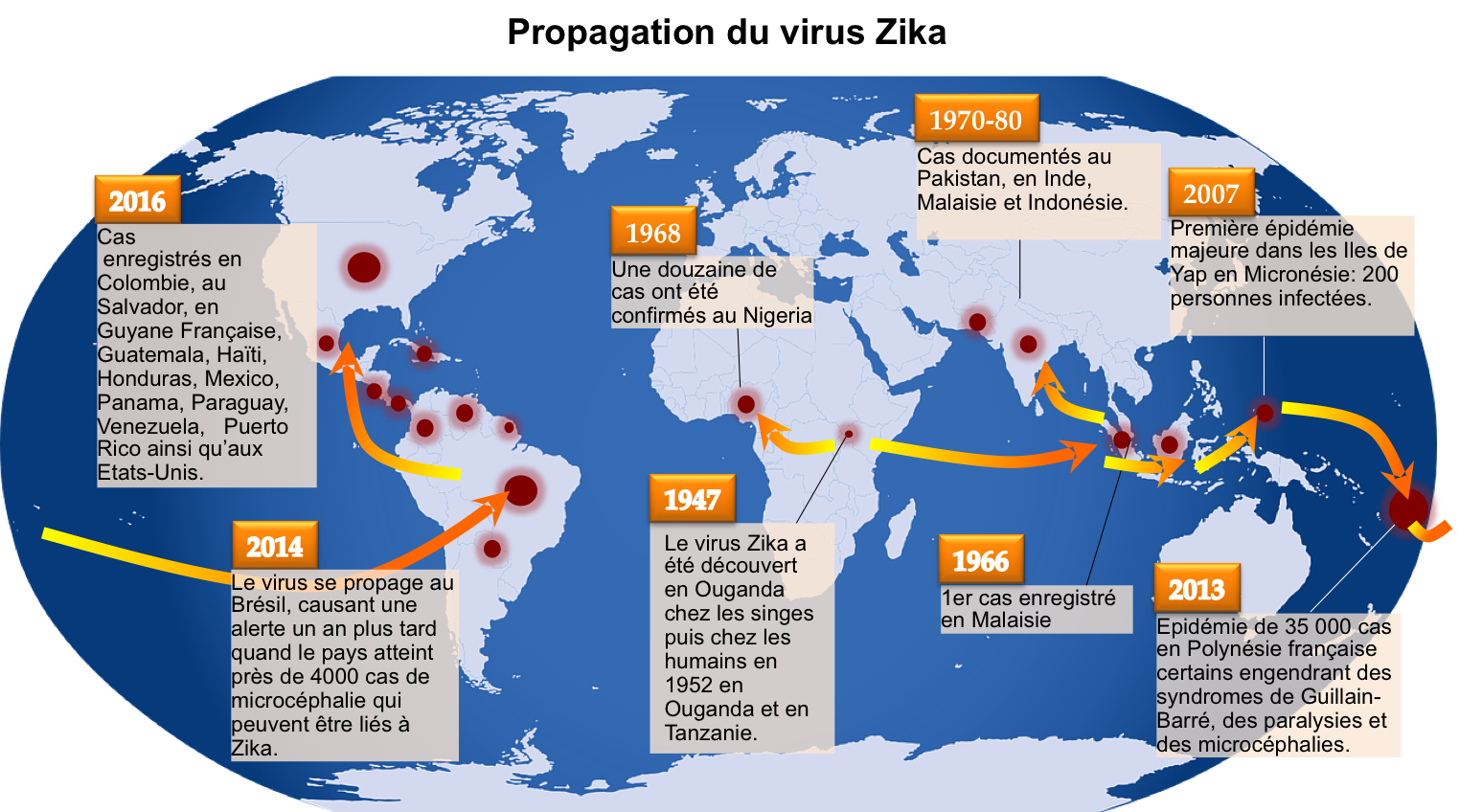
Le virus Zika (ZIKV) a été découvert pour la première fois en Afrique en 1947 [1] cependant il ne s’est propagé que récemment en Asie, en Polynésie française, dans les Caraïbes et en Amérique (Figure 1). L’association entre des infections par le virus Zika et des troubles neurologiques tels que le syndrome de Guillain-Barré (maladie du système nerveux périphérique dont l’un des symptômes caractéristiques est une parésie soit la diminution de la force musculaire d’un ou plusieurs muscles) et des microcéphalies (dimensions anormalement petites de la tête) a provoqué une inquiétude mondiale pour la santé [2, 3, 4].
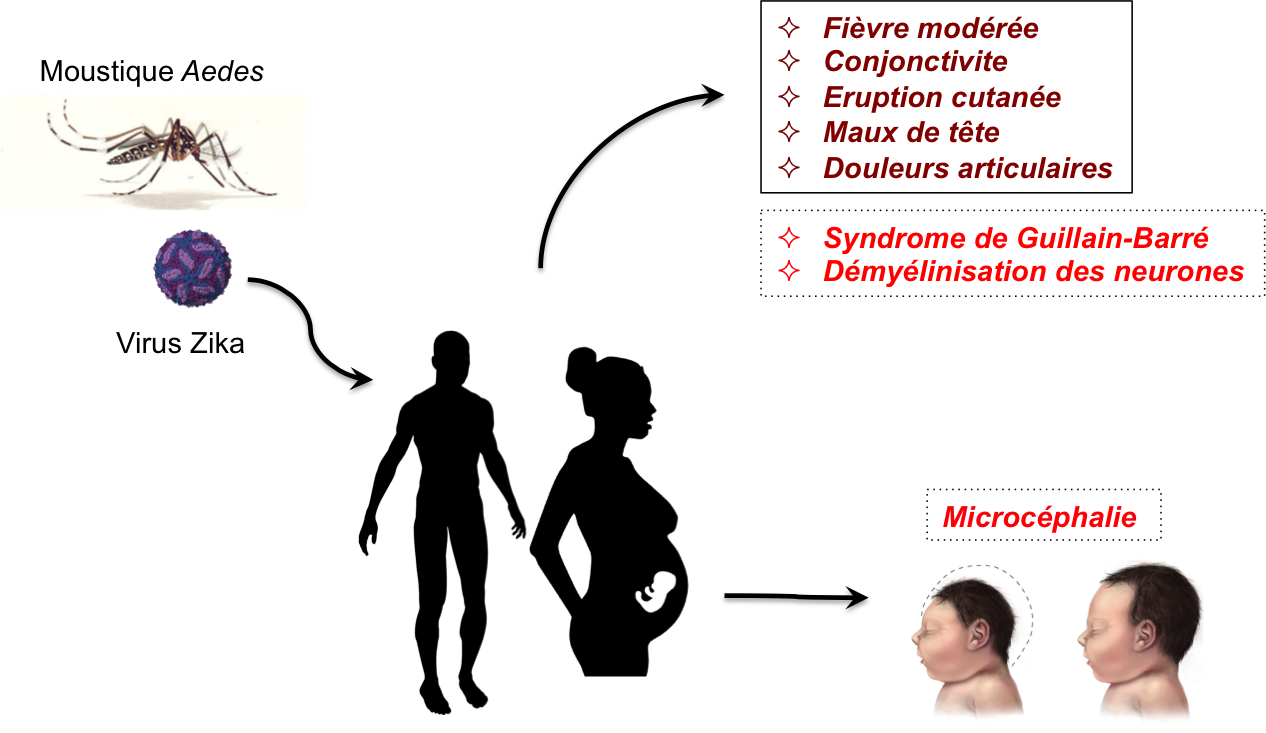
Le virus se transmet par piqûre d’un moustique infecté ou lors de la grossesse, de la mère infectée au fœtus. Quelques cas rares de transmission sexuelle ont été décrits [5, 6]. L’infection par ZIKV est généralement asymptomatique mais dans 20 % des cas les personnes infectées développent une fièvre et d’autres symptômes non spécifiques (Figure 2) [3, 6]. Cependant, un syndrome de Guillain-Barré peut se déclarer avec une fréquence estimée à 1 cas sur 5 000 [3, 7].
Avec les images d'Emil August Goeldi (1905), Manuel Almagro Rivas, et le Center for Disease Control and Prevention.
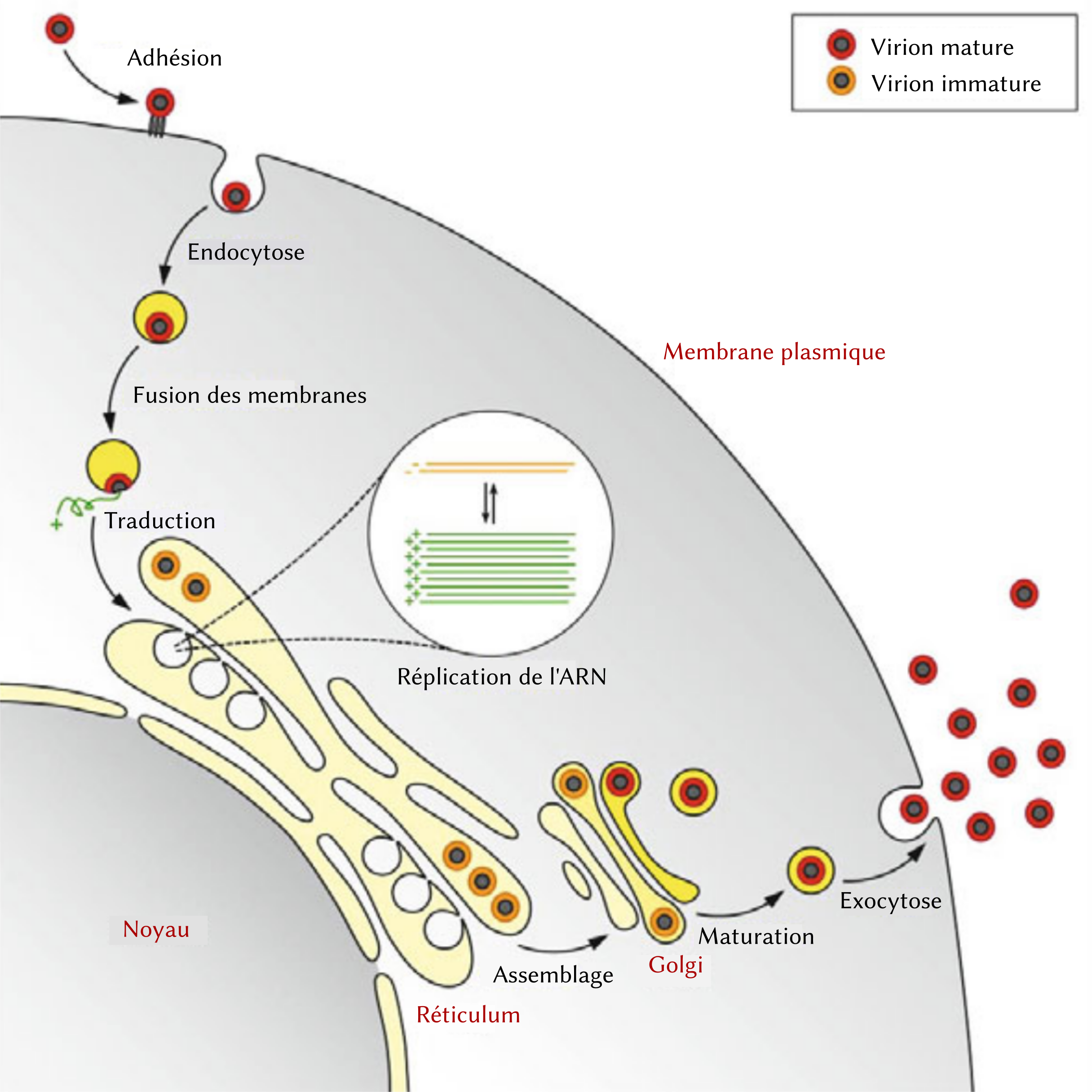
Le virus Zika fait partie du genre des Flavivirus qui comprend également entre autres le virus de la dengue et celui de la fièvre jaune. Bien que différents, ils partagent le même cycle de multiplication (Figure 3) qui a lieu principalement dans le réticulum endoplasmique (RE) de la cellule [8.].
- Le virus Zika est un virus enveloppé. L’attachement de la protéine virale d’enveloppe (E) au récepteur de l’hôte induit l’internalisation du virus dans la cellule.
- Fusion de la membrane virale avec la membrane de la cellule hôte. L’ARN viral est alors relargué dans le cytoplasme.
- L’ARN génomique viral (simple brin positif) est alors traduit en une polyprotéine, qui est clivée pour produire les différentes protéines virales dont celles essentielles à la réplication du virus.
- La réplication a ensuite lieu à la surface du réticulum endoplasmique dans des « sites de production » viraux cytoplasmiques. L’ARN génomique viral (double brin) est synthétisé à partir de l’ARN simple brin positif. L’ARN génomique viral (double brin) est ensuite transcrit et répliqué afin de fournir des ARN messagers pour produire de nouvelles protéines virales et de nouveaux ARN génomiques viraux simples brins positifs.
- L’assemblage du virus se déroule dans le réticulum endoplasmique (RE). Les particules virales « bourgeonnent » à la surface du RE et sont transportées dans l’appareil de Golgi.
- La protéine précurseure de la membrane virale est clivée dans le Golgi produisant par conséquent des virions matures capables de fusionner.
- Relargage de particules virales matures et infectieuses par exocytose.
Le virus Zika est composé de trois protéines structurales : les protéines d’enveloppe (E), de capside (C) et de membrane (M) ainsi que de sept protéines non-structurales (Figure 4).
Dessin d’un virus Zika vu de l’extérieur (à droite) et en coupe (à gauche) alors qu’il interagit avec une cellule. Les deux principales protéines de l’enveloppe, la protéine d’enveloppe et la protéine de membrane, sont représentées en rouge et violet, respectivement. Les lipides membranaires de l’enveloppe sont de couleur lavande. Les protéines de capside, en orange, interagissent avec le génome d’ARN, en jaune, au centre du virus. Les récepteurs de la surface cellulaire sont en vert, le cytosquelette en bleu et les protéines du plasma sanguin en doré.
Le virus, en se répliquant dans les cellules humaines, interagit avec des protéines cellulaires et perturbe le bon fonctionnement des cellules jusqu’à induire leur mort et ceci pour différent types cellulaires [ 9, 10, 11, 12, 13, 14, 15]. Les effets cytopathiques du virus Zika (altération métaboliques, biochimiques et morphologiques de la cellule infectée) étaient jusqu’ici peu caractérisés. Nous avons pu filmer l’infection des cellules par le virus Zika, par vidéo-microscopie. Nous avons observé d’importants changements morphologiques de la cellule avant que celle-ci implose et meurt. Nous avons également observé que lorsque les cellules humaines expriment une protéine appelée IFITM3 (qui fait partie de la famille de protéines antivirales IFITM induites par l’interféron de type 1) les cellules sont protégées contre l’entrée du virus et par conséquent de la mort induite par le virus Zika.
L’effet cytopathique caractérisé par vidéo-microscopie
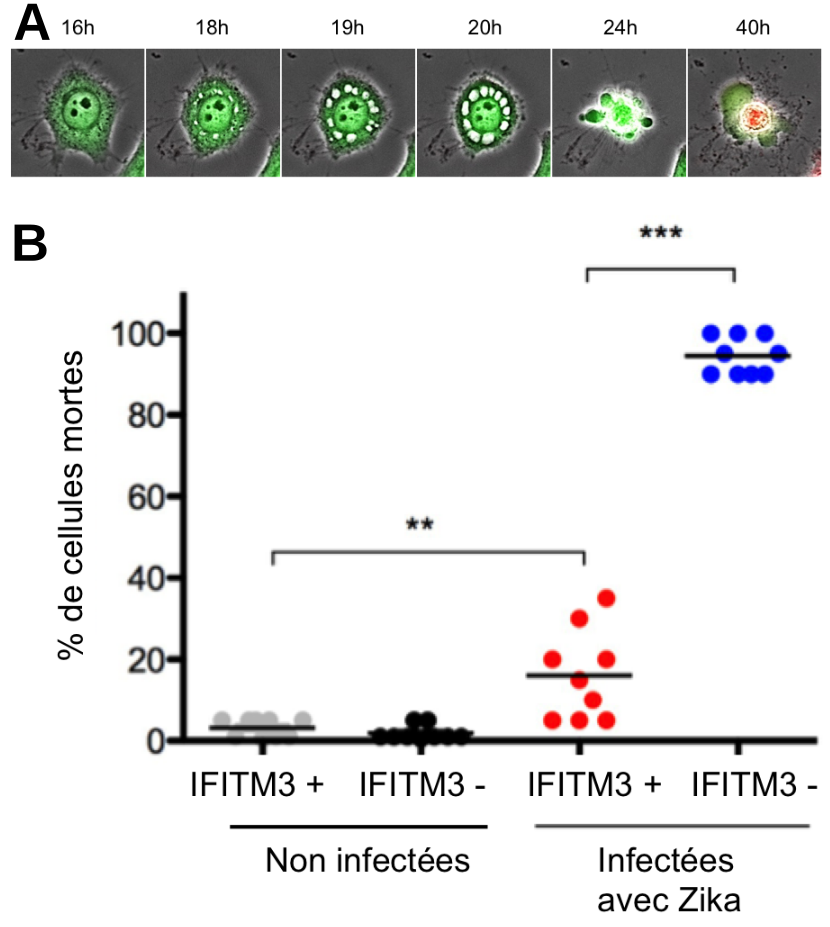
A . Des cellules humaines ont été infectées par le virus Zika et filmées par vidéo-microscopie jusqu’à 40 h après l’infection. Une fois morte la cellule devient rouge. B. Graphique représentant la mort cellulaire induite par le virus Zika. Celle-ci est réduite en présence d’IFITM3. Les points représentent les différentes valeurs mesurées et les barres horizontales la moyenne de ces valeurs. Les étoiles indiquent des différences statistiquement significatives entre les conditions expérimentales.
Nous avons étudié l’effet cytopathique du virus, plus précisément les changements morphologiques des cellules lorsque le virus se multiplie. Pour cela nous avons infecté des cellules épithéliales humaines avec une souche de virus Zika et nous les avons filmées par vidéo-microscopie. Nous montrons qu’ une cellule infectée réagit en formant de grosses vacuoles qui vont aboutir à l’implosion et la mort de la cellule (Figure 5A). Pour faciliter la visualisation, les cellules saines sont colorées en vert et lorsqu’elles meurent elles deviennent rouges. Avec ce système, nous pouvons alors quantifier le signal rouge qui représente la mort cellulaire induite par le virus. Nous nous intéressons également aux facteurs de restriction qui sont des protéines cellulaires à activité antivirale servant à protéger la cellule contre l’infection de différents virus. Parmi les facteurs de restriction étudiés, nous avons observé que l’absence d’une des protéines IFITM (Interferon – Induced Transmembrane) nommée IFITM3, permettait au virus Zika d’accéder au cytoplasme des cellules et d’y induire la formation de vacuoles menant à la mort cellulaire (Figure 5B).
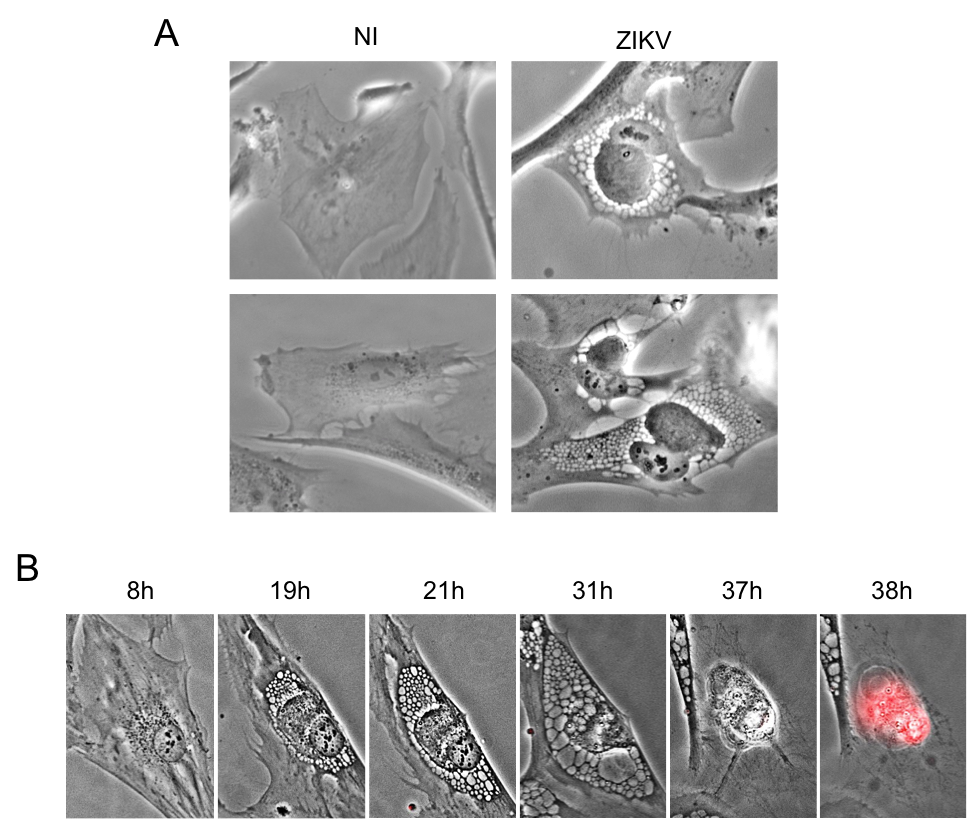
Nous avons observé ces effets cytopathiques du virus Zika dans différents types de cellules humaines : cellules épithéliales (cellules qui constituent les épithéliums, tissus marquant la limite entre l’organisme et son environnement : peau, épithélium intestinal, pulmonaire, etc.), fibroblastes cutanés (sûrement une des premières cibles du virus au niveau de la peau après la piqûre par le moustique) et également dans les astrocytes, des cellules du système nerveux central (Figure 6). Le virus Zika, comme nous l’avons mentionné précédemment, provoque des perturbations et des maladies neurologiques. Par conséquent, comprendre comment le virus infecte, perturbe et détruit les cellules du cerveau est primordial.
A. Des astrocytes ont été infectés par le virus Zika et observés au microscope 24 h plus tard. NI : cellules non infectées ; ZIKV : cellules infectées par le virus Zika. B. Des fibroblastes de peau ont été infectés avec le virus Zika et filmés pendant une quarantaine d’heures. Une fois morte, la cellule devient rouge.
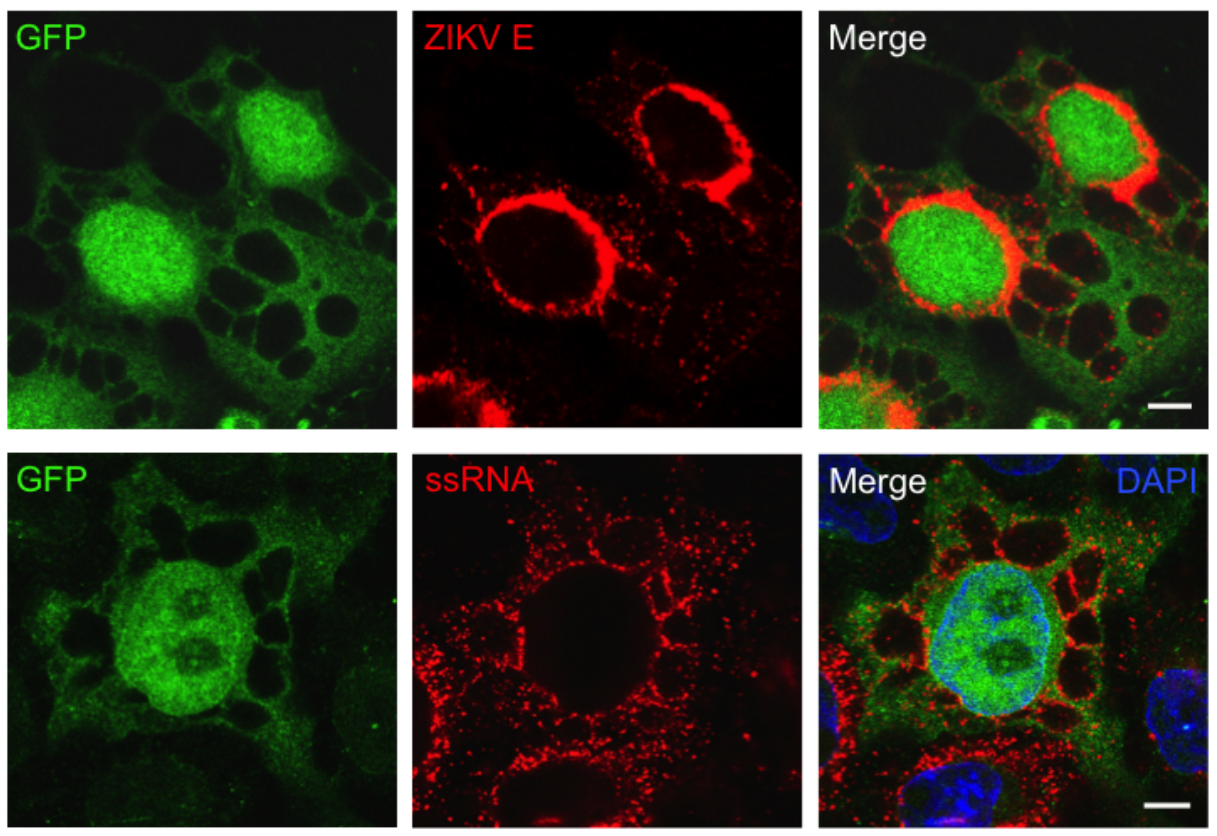
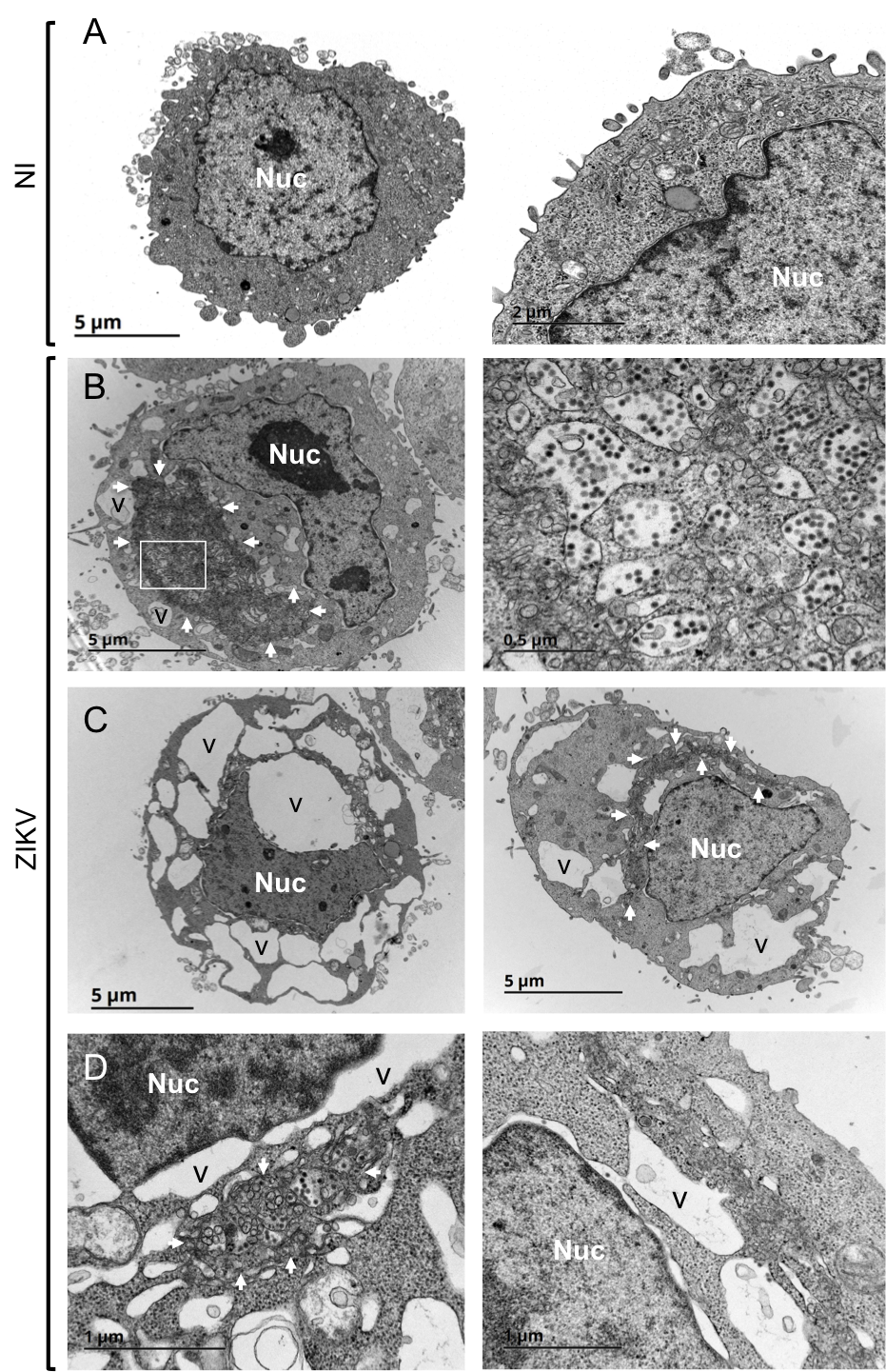
En utilisant une technique de microscopie dite confocale, nous avons pu caractériser de manière plus poussée l’infection par le virus Zika. À l’aide de marqueurs fluorescents nous avons pu détecter dans les cellules humaines la protéine virale de l’enveloppe E ainsi que l’ARN viral (Figure 7). Nous avons alors pu constater que le virus, comme tous les flavivirus, se multipliait principalement au niveau du réticulum endoplasmique (RE) un organite proche du noyau de la cellule et principal lieu de production des protéines cellulaires. De façon intéressante, nous avons remarqué la présence de protéines et d’ARN viraux autour des vacuoles. Ces résultats ont été confirmés par microscopie électronique (Figure 8).
Des cellules épithéliales humaines (colorées en vert car exprimant de la GFP : protéine à fluorescente verte) ont été infectées par le virus Zika et observées au microscope confocal 24 h plus tard. En rouge est indiqué la protéine virale de l’enveloppe E (en haut) ou l’ARN viral (en bas). Les noyaux des cellules apparaissent en bleu.
Des cellules humaines épithéliales ont été infectées par le virus Zika et observées par microscopie électronique 24 h après. Les particules du virus Zika apparaissent sous forme de points noirs et sont plus facilement identifiables lorsque l’on zoome sur la cellule au niveau du RE (Panel B à droite).
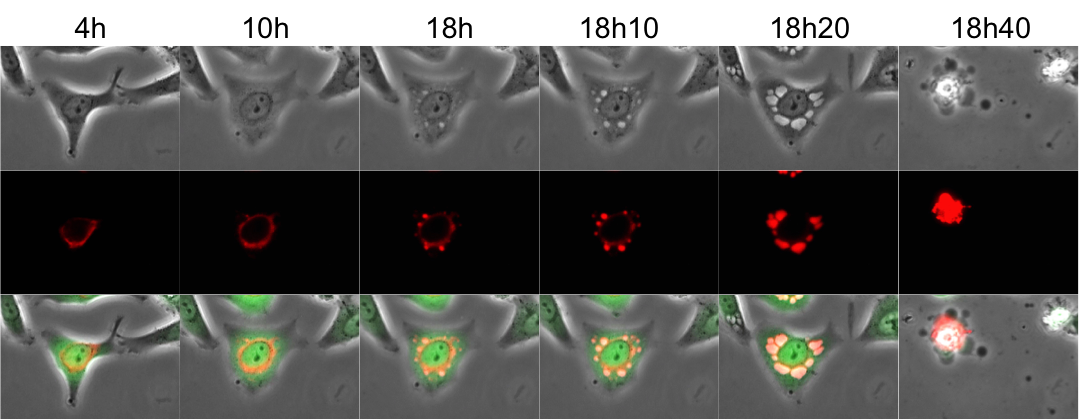
Nous avons ensuite voulu caractériser ces vacuoles formées dans les cellules infectées. En nous basant sur nos précédentes observations, nous nous sommes demandés si les vacuoles provenaient du RE. Nous avons donc filmé de nouveau les cellules infectées mais cette fois nous avons utilisé un marqueur du RE apparaissant alors en rouge (protéine fluorescente basée sur la calréticuline, qui est une protéine du RE – Figure 8). Nous avons observé que le signal rouge du RE se situait autour du noyau dans les cellules saines comme attendu mais que celui-ci s’intensifiait et migrait à l’intérieur des vacuoles. Cela a confirmé notre hypothèse : les vacuoles induites par le virus Zika se forment à partir du RE. Ce type de mort cellulaire montrant des vacuoles provenant du RE se nomme « la paraptose ».
Des cellules épithéliales (coloration verte) ont été infectées par le virus Zika et filmées par vidéo-microscopie pendant 20 heures. Le réticulum endoplasmique apparaît en rouge.
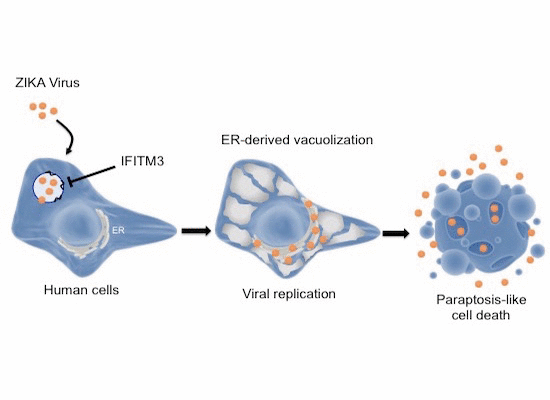
Pour conclure, nous avons démontré qu’une fois que le virus Zika dépassait la barrière provoquée par IFITM3 à l’entrée de la cellule, il induisait de fortes modifications morphologiques des cellules humaines. Ces transformations sont des vacuoles formées à partir de réticulum endoplasmique et sont suivies par l’implosion et la mort de la cellule par paraptose (Figure 9). Ces résultats permettent de mieux comprendre la multiplication du virus Zika et la réaction de l’organisme hôte.
L’infection des cellules humaines par le virus Zika, une fois la barrière d’IFITM3 passée (représenté par des petites vagues noires), induit une vacuolisation importante provenant du RE et menant à l’implosion et la mort de la cellule par paraptose.
Références
- Dick, G.W., Kitchen, S.F. & Haddow, A.J. Zika virus. I. Isolations and serological specificity. Trans R Soc Trop Med Hy g 46, 509-520 (1952).
- Cauchemez, S. et al. Association between Zika virus and microcephaly in French Polynesia, 2013-15 : a retrospective study. Lancet 387, 2125-2132 (2016).
- Lessler, J. et al. Assessing the global threat from Zika virus. Science 353, aaf8160 (2016).
- Weaver, S.C. et al. Zika virus : History, emergence, biology, and prospects for control. Antiviral Res 130, 69-80 (2016).
- Musso, D. & Gubler, D.J. Zika Virus. Clin Microbiol Rev 29, 487-524 (2016).
- Peterson, A.T., Osorio, J., Qiao, H. & Escobar, L.E. Zika Virus, Elevation, and Transmission Risk. PLoS Curr 8 (2016).
- Cao-Lormeau, V.M. et al. Guillain-Barre Syndrome outbreak associated with Zika virus infection in French Polynesia : a case-control study. Lancet 387, 1531-1539 (2016).
- Mukhopadhyay, S., Kuhn, R.J. & Rossmann, M.G. A structural perspective of the flavivirus life cycle. Nat Rev Microbiol 3, 13-22 (2005).
- Hamel, R. et al. Biology of Zika Virus Infection in Human Skin Cells. J Virol 89, 8880-8896 (2015).
- Garcez, P.P. et al. Zika virus impairs growth in human neurospheres and brain organoids. Science 352, 816-818 (2016).
- Hamel, R. et al. Zika virus : epidemiology, clinical features and host-virus interactions. Microbes Infect 18, 441-449 (2016).
- Jurado, K.A. et al. Zika virus productively infects primary human placenta-specific macrophages. JCI Insight 1 (2016).
- Nowakowski, T.J. et al. Expression Analysis Highlights AXL as a Candidate Zika Virus Entry Receptor in Neural Stem Cells. Cell Stem Cell 18, 591-596 (2016).
- Tabata, T. et al. Zika Virus Targets Different Primary Human Placental Cells, Suggesting Two Routes for Vertical Transmission. Cell Host Microbe 20, 155-166 (2016).
- Tang, H. et al. Zika Virus Infects Human Cortical Neural Progenitors and Attenuates Their Growth. Cell Stem Cell 18, 587-590 (2016).