Auteur : Françoise Ibarrondo
Table des matières
- Diabète de type I, allogreffe et xénogreffe
- La xénogreffe de tissu embryonnaire de porc
- Le risque de contamination par les virus
- Conclusion
- Bibliographie
1. Diabète de type I, allogreffe et xénogreffe
L'insuline est une hormone produite par des groupes de cellules spécialisées situées dans le pancréas : les cellules β des îlots de Langerhans.
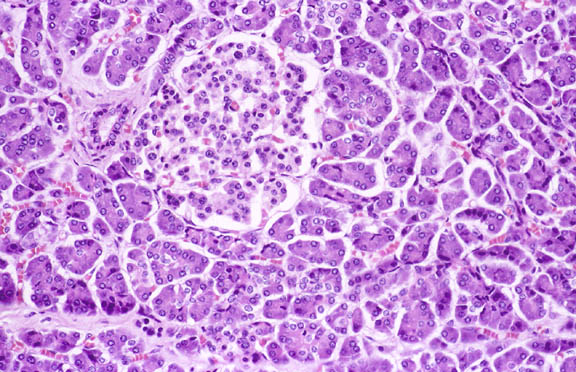 |
| La majorité de la coupe est occupée par le pancréas exocrine. Presqu'au centre on observe un îlot de Langerhans responsable de la fonction endocrine du pancréas. Ces îlots sont constitués de cellules α productrices de glucagon, de cellules β productrices d'insuline, de cellules δ productrices de somatostatine et de cellules PP productrices du polypeptide pancréatique. A gauche de l'îlot de Langerhans, se trouve un vaisseau sanguin reconnaissable à la lumière centrale. (G = x66). Source : Department of Pathology / Duke University Medical Center (Etats Unis). |
En cas de secrétion insuffisante d'insuline, un diabète de type I apparaît. Lorsque le déficit d'insuline est important, le glucose n'entre plus suffisamment dans les cellules hépatiques, musculaires, adipeuses et nerveuses, et c'est le risque d'évolution vers un coma diabétique. En outre, l'hyperglycémie chronique conduit à des complications rétiniennes, rénales, neurologiques et cardio-vasculaires.
Le déficit d'insuline est actuellement corrigé par un apport d'insuline humaine fabriquée par génie génétique que les malades s'injectent plusieurs fois par jour, et ce jusqu'à la fin de leur vie. Ces injections se font après avoir mesuré scrupuleusement la glycémie du moment pour connaître les doses à injecter nécessaires.
La greffe d'îlots de Langerhans humaine ou allogreffe (greffe où le donneur et le receveur appartiennent à la même espèce) est une voie thérapeutique innovante, mais elle oblige à un traitement antirejet continu. Par ailleurs, les prélèvements pancréatiques capables de fournir les cellules à greffer sont loin de satisfaire les besoins potentiels des malades.
D'où l'idée qui existe depuis longtemps de recourir à la greffe d'îlots de Langerhans provenant d'animaux ou xénogreffe (greffe où le donneur et le receveur appartiennent à des espèces différentes). Cette potentialité se heurte à deux difficultés majeures :
- Maîtrise de la réaction de rejet, a priori bien plus intense que celle qui se déploie face à l'allogreffe humaine;
- Problème essentiel des éventuels virus présents dans les cellules animales, et en particulier les rétrovirus hébergés dans le matériel héréditaire de la cellule. La barrière d'espèce n'est en effet pas infranchissable et la transmission de virus animaux à la personne greffée pourrait déboucher sur l'apparition de nouveaux types de virus humains, générateurs de nouvelles maladies graves et imprévisibles (il n'y a qu'à songer au SRAS, et très probablement au SIDA).
En dépit de ces difficultés, les recherches se poursuivent. Pour ces xénogreffes, un bon fournisseur possible de cellules pancréatiques insulinosecrétrices est le porc avec ses organes très semblables à ceux de l'homme, son élevage aisé et sa progéniture nombreuse : il pourrait procurer en quantité les précieux îlots.
2. La xénogreffe de tissu embryonnaire de porc
Une xénogreffe de ce type vient d'être réalisée par Sharon A Rogers et collaborateurs de l'Université Washington (St Louis, Missouri) chez des rats diabétiques à partir de cellules pancréatiques embryonnaires de porc (Ref. 1). Celles-ci ont été greffées dans le péritoine, qui est la membrane entourant les organes abdominaux des rats, un premier lot de rats recevant un traitement anti-rejet et un autre non.
Les résultats sont très encourageants.
- le premier d'entre eux est essentiel : le pancréas embryonnaire greffé s'est mis à produire correctement de l'insuline et les rats se sont trouvés guéris de leur diabète, non pas transitoirement, mais jusqu'à la fin de leur vie.
- Le second résultat est plus inattendu : les cellules pancréatiques embryonnaires n'ont eu à subir aucun rejet, même chez les rats n'ayant reçu aucun traitement immunosuppresseur. Il est donc prouvé que, dans les conditions de l'expérience - c'est à dire chez le rat et avec un tout jeune tissu pancréatique embryonnaire de porc - le traitement immunosuppresseur n'est pas nécessaire. Le pancréas embryonnaire greffé n'affiche manifestement pas de motifs antigéniques susceptibles de le faire rejeter, et cela aussi bien au moment de sa transplantation que plus tard lorsqu'il se développe à l'intérieur de son hôte-rat.
- Troisième sujet de satisfaction : poursuivant sa différenciation, le pancréas embryonnaire ne se met pas à produire les enzymes digestives que fabrique normalement un pancréas, ce qui aurait pu sérieusement hypothéquer voir annihiler la production de l'insuline par digestion.
Pour la première fois, un diabète de type I est donc guéri et non plus seulement compensé. On imagine bien que les chercheurs ne vont pas s'arrêter en si bon chemin. Ainsi, ils prévoient de tenter la même expérience sur des singes diabétiques.
3. Le risque de contamination par les virus
Qu'en est-il du risque de contamination par les rétrovirus porcins ? Cette question n'était pas l'objet de l'étude de Sharon et collaborateurs qui ont consacré tous leurs efforts à suivre la correction du diabète chez leurs rats d'expérience. Mais des pratiques anciennes et quelques-unes des données récentes apportent leur lot d'informations intéressantes et contradictoires.
Durant quatre vingts ans, avant la mise au point de la fabrication d'insuline humaine par génie génétique, le diabète de type I a été soigné par des injections d'insuline porcine qui, à l'époque, ne pouvait pas être totalement exempte de contaminations. Et pourtant, malgré des millions d'injections, jamais à ce jour une infection par un virus porcin n'a été relevée, ni chez les malades, ni dans leur entourage.
De même, tissus de porc et tissus de diabétiques ont été mis en contact depuis plus de douze ans : brèves dérivations extracorporelles de sang diabétique au travers de rate, foie ou rein de porcs avant une allogreffe; greffes - pansements transitoires de peau de porc chez de grands brûlés... Khazal Paradis, du groupe pharmaceutique Novartis, et des laboratoires de recherche du monde entier ont mené une enquête de grande envergue chez 160 de ces patients (Ref. 2). Avec des techniques variées, ils ont cherché à détecter la trace éventuelle d'une infection virale : ils ont ainsi testé la présence d'ARN viral ou d'anticorps-antirétrovirus dans le sérum de malades et la présence d'ADN viral dans l'ADN du noyau d'un type de globules blancs. Toutes les recherches effectuées ont débouché sur un résultat négatif.
Est-ce la preuve que la transmission des rétrovirus porcins à l'Homme est impossible ? L'interrogation reste de mise. "L'absence de preuve n'est pas la preuve de l'absence" : l'herpès humain est l'exemple-type d'une maladie dont le virus ne se détecte pas dans un test sanguin. Par ailleurs, un seul type de cellule a été testé par l'équipe de Khazal Paradis : les rétrovirus porcins pourraient fort bien être tapis dans le noyau d'autres types cellulaires. Tout cela en sachant que le génome humain code pour des récepteurs similaires à ceux qui fixent les rétrovirus chez le porc et leur ouvrent la voie pour une infection (Ref. 3). Or on ne connaît que trop, par les exemples catastrophiques du SIDA et du SRAS, la capacité qu'ont les virus à pouvoir franchir un jour la barrière d'espèce.
4. Conclusion
Les xénotransplantations porcines soulèvent un grand espoir, mais il faut redoubler de précaution et se garder d'aller trop vite. le Comité Consultatif National d'Ethique (CCNE) français, à l'instar des organismes équivalents dans d'autres pays, a déjà rendu l'avis suivant sur les xénogreffes : "Approuvant le principe de la xénotransplantation, le CCNE incite à la prudence dans sa mise en oeuvre, tout en évaluant risques et bénéfices à l'égard tant des receveurs potentiels (rejet ou infection virale) que de l'ensemble de la société (transmission infectieuse interhumaine). Le CCNE souhaite une réglementation pour ces pratiques." Les autorités musulmanes et juives ne refusent pas le principe des xénogreffes porcines mais invitent à la même prudence (Ref. 4 ).
Malgré la demande pressante et ô combien compréhensible des malades, la sagesse et le sens de la responsabilité doivent donc à chaque instant prévaloir. La xénogreffe du pancréas ou des cellules β d'origine porcine est encore très loin d'une application clinique en raison des réserves extrêmes concernant le risque de transmission de virus par saut d'espèce. Mais la recherche est loin de baisser les bras : laboratoires pharmaceutiques et universitaires s'ingénient à obtenir une lignée de cellules porcines débarrassée de ses rétrovirus. Avec un commencement de succès depuis fevrier dernier (Ref. 5)...
5. Bibliographie
- S.A. Rogers et coll. "Islet cell engraftment and control of diabetes in rats after transplantation of pig pancreatic anlagen." Am J Physiol Endocrinol Metab (2004) 286: E502-E509.
- K. Paradis et coll. "Search for cross-species transmission of porcine endogenous retrovirus in patients treated with living pig tissue." (1999) Science 285:1236-1241.
- T.A. Ericsson et coll. "Identification of human receptors for pig endogeneous retrovirus." (2003) PNAS 100(11):6759-6764.
- D. Boubakeur Recteur de l'Institut Musulman de la Mosquée de Paris "Xénogreffes-bioéthique islamique".
- S. Hayes "PERVs most infectious to human cells not part of germe-line DNA of mini-swine." Site EurekAlert.


